Borrmann Ⅳ型胃癌的多排螺旋CT特征及对临床病理的影响
2020-08-08汪心韵倪婧任刚蔡嵘
汪心韵 倪婧 任刚 蔡嵘
1上海交通大学医学院附属新华医院放射科(上海200092);2上海交通大学医学院附属瑞金医院放疗科(上海200025)
我国是胃癌的高发国家,发病数和死亡数分别占全球胃癌总发病数和总死亡数的42.6%和45.0%[1]。目前,临床上对进展期胃癌大体形态分类多采用1926年由Borrmann 提出的分型方案,其中Borrmann Ⅳ型胃癌,即弥漫浸润型胃癌,又称“硬癌”、“皮革胃”,是一种特殊类型的胃癌,其特征是肿瘤细胞膜缺失细胞黏附蛋白而导致细胞间黏附性差,从而呈现弥漫型生长方式[2],随着病变的进程,可形成丰富的纤维间质,同时胃腔扩张受限。由于Borrmann Ⅳ型胃癌患者在确诊时往往已经处于疾病的晚期,通常丧失手术机会,而采用全身化疗的治疗方式,或是新辅助化疗,但若能根治性切除可提高患者的生存时间[3]。Borrmann Ⅳ型胃癌在所有类型胃癌中预后最差,肿瘤细胞分化程度差,易突破浆膜层发生腹膜播散转移,从而导致病情发现晚、预后差[4]。肿瘤细胞主要累及黏膜下层,无明显的溃疡和肿块[5],内镜下胃黏膜病理活检假阴性率高[6]。综上,BorrmannⅣ型胃癌患者的生存率低,漏诊率及误诊率却高于其他分型胃癌[7]。
Borrmann Ⅳ型胃癌在CT 上表现为局灶性或广泛性胃壁弥漫增厚,多排螺旋CT(multi-detector spiral computed tomography,MDCT)可以准确显示肿瘤胃壁内侵犯、强化方式、淋巴结及远处转移等情况,结合三维成像可进一步提高病变的检出率及术前分期的准确率[8]。本文旨在探究Borrmann Ⅳ型胃癌的MDCT 强化特征及对临床病理的影响,提高对Borrmann Ⅳ型胃癌的认识,从影像学的角度与胃壁弥漫性增厚的疾病相鉴别。
1 资料与方法
1.1 病例资料回顾性收集本院2012年11月至2019年7月术前行MDCT 增强检查并经手术病理证实为Borrmann Ⅳ型胃癌患者136 例,所有患者均行根治性/姑息性手术治疗。既往接受过胃切除手术的患者除外。
1.2 MDCT 检查采用Siemens Somatom Definition 64 层双源CT、Philips 256 层Brillancei CT 机、Philips 64 层Brillance CT 机及相应的图像后处理工作站。患者于检查前1 天晚餐后禁食。检查前1~2 h 患者口服水750 mL,检查前15 min 再口服250 mL。平扫后立即动态增强扫描,对比剂选用碘海醇或优维显,采用LF 双筒高压注射器经肘静脉团注对比剂,剂量100 mL/人,速率3.5 mL/s,动脉期、静脉期、平衡期延迟时间分别为28、60、120 s。扫描参数为120 kV,电流为自动毫安技术,范围200~250 mAs,扫描层厚及间距为5 mm 容积扫描。FOV 35 cm×40 cm,矩阵为512×512,旋转时间0.5 s/圈,螺距1.0,标准重建。为显示胃部CT 扫描中不同密度组织,选择窗宽180~280 Hu,窗位30~35 Hu。1次扫描屏气5~7 s。扫描范围:膈顶至髂嵴水平,疑大范围转移者扫描范围包括盆腔。对原始数据以1.0 mm 层厚重建,即将所获得的容积扫描数据传输至工作站,利用同机配备的软件进行图像多平面重建,包括冠状位及矢状位。
1.3 图像分析与数据收集由两位研究小组的高年资放射科医师盲法阅片,记录一致的观察结果,意见分歧时通过讨论达成共识。在胃腔适度充盈的条件下,当胃壁厚度≥6 mm 时,判定为癌性增厚[9]。在图像分析中,数据统计包括:(1)肿瘤部位,按照原发病灶位于胃上部、胃中部、胃下部、跨两部分及跨三部分。(2)测量病灶最大层面的胃壁厚度。(3)测量三期扫描中病变胃壁内外层CT 值。(4)增强后按强化方式分为有分层强化和无分层强化(分层强化为增强后内外层强化程度存在肉眼可分辨的差异)。(5)淋巴结转移的标准按淋巴结的短径胃周>6 mm 或胃周外>8 mm,或周边相对高密度中心相对低密度为转移[10]。
1.4 胃癌病变区域强化程度的判定及CT 值的测量按照以下标准对胃癌病变区域强化程度进行判定:(1)轻度强化:当胃癌病变区域强化程度与邻近肌肉组织相似时;(2)中度强化:当胃癌病变区域强化程度高于邻近肌肉组织,但低于血管时;(3)明显强化:当胃癌病变区域强化程度接近血管时。通过在病变最大层面放置感兴趣区(ROI)来测量CT 值,将ROI 分别放置在3 个不同区域中,并计算得到3 个ROI 的平均CT 值。
1.5 病理学分析根据日本胃癌分类(第3 版英文版)[11]确定136 例病例的组织学类型、肿瘤基质和浸润模式。将病理类型先按照WHO 组织学分类,再按照日本胃癌学会2010年指南进一步分为分化型和未分化型(分化型:中-高分化的管状腺癌和乳头状腺癌,未分化型:低分化腺癌、印戒细胞癌和黏液腺癌)[12]。肿瘤基质分为3 级:髓样型(med):少量间质;硬型(sci):丰富间质;中间型(int):间质数量介于其他两种类型之间。浸润模式分为3 级:INFa:肿瘤呈扩张性生长,与周围组织边界不明显;INFb:肿瘤呈介于INFa 和INFc 之间的中间型;INFc:肿瘤呈浸润性生长,与周围组织无明显边界。
1.6 统计学方法采用SPSS(statistical package for social science)23.0,计量资料用均数±标准差,采用两样本独立样本t检验,计数资料用χ2检验;非参数检验的Mann-WhitneyU检验。利用二元Logistic回归分析影响MDCT 分层强化的因素,并用Wald检验。P<0.05 为差异有统计学意义。
2 结果
2.1 临床病理特征本院2012年11月至2019年7月之间经手术病理证实的胃癌患者共2 969 例,其中Borrmann Ⅳ型胃癌136 例,占4.6%。入组的136 例Borrmann Ⅳ型胃癌患者的临床病理特征见表1、2。
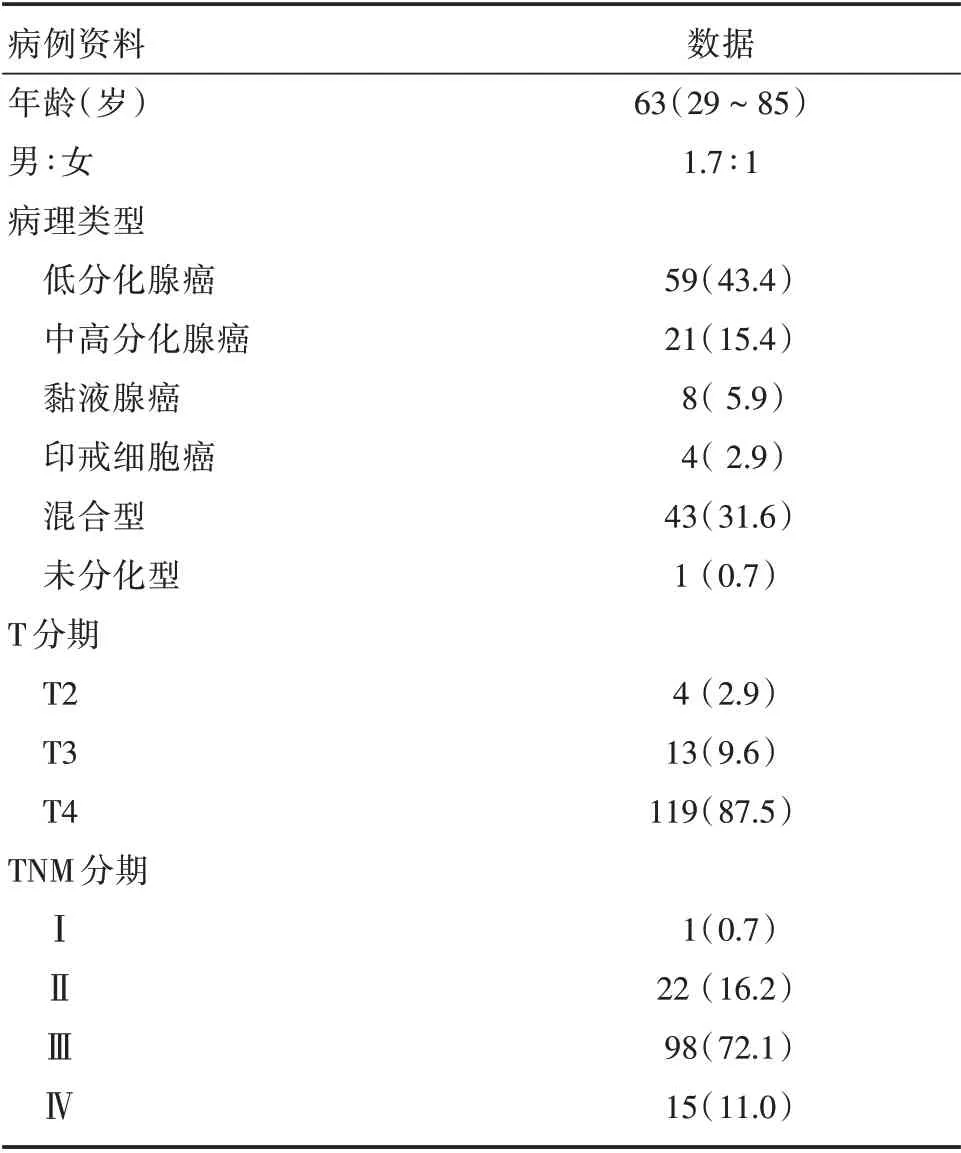
表1 136 例Borrmann Ⅳ型胃癌的临床病理资料Tab.1 Clinicopathological data of 136 cases of Borrmann type Ⅳgastric cancer例(%)
2.2 肿瘤原发病灶的MDCT增强表现在MDCT图像分析中,所有病灶表现为胃癌病变区域局灶性或广泛性胃壁增厚,肿瘤的平均长度为(7.5±2.2)cm,平均最大厚度为(1.8±0.5)cm。增强扫描动脉期96/136 例呈现分层强化的模式,静脉期123/136 例呈现分层强化的模式(图1、2),在86 例进行平衡期扫描的病例中,有40 例呈现分层强化的模式,46 例无明显分层强化。增强各期肿瘤内外层强化程度差异均有统计学意义(P<0.01,表3)。大多数病灶动脉期(内层中度强化、外层轻度强化)与静脉期(内层明显强化、外层中度强化)均呈现为分层强化的模式。在增强各期CT值得测量中,动脉期内层(66.2±16.7)Hu 的平均CT 值高于外层(47.3±10.1)Hu,差异有统计学意义(P<0.01),静脉期内层(99.6±19.8)Hu 的平均CT 值高于外层(63.1±15.2)Hu,差异有统计学意义(P<0.01,表4)。

表2 Borrmann Ⅳ型胃癌的CT 征象Tab.2 Imaging signs of Borrmann type Ⅳgastric cancer例(%)
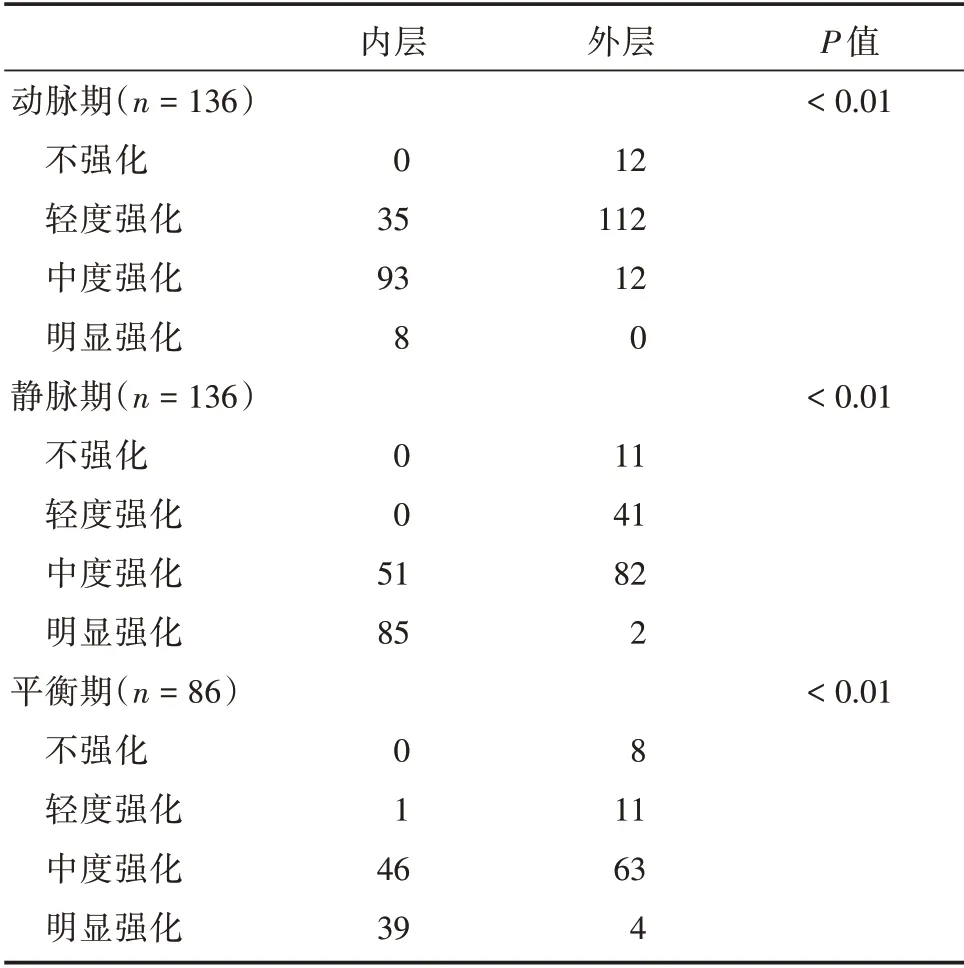
表3 增强各期肿瘤内外层强化程度Tab.3 The degree of enhancement of the inner and outer layers of tumors at various phases例
2.3 Logistic 回归分析结果选择性别、T 分期、TNM 分期及病理类型作为协变量,MDCT 是否出现分层强化作为因变量进行二元Logistic 回归,结果显示未分化型胃癌相对于分化型胃癌,出现分层强化的概率增加(P=0.046,表5)。
3 讨论

图1 女,60 岁,Borrmann Ⅳ胃癌,病理类型为低分化腺癌Fig.1 Female,60 years old,Borrmann Ⅳgastric cancer,poorly differentiated adenocarcinoma

图2 男,49 岁,Borrmann Ⅳ胃癌,病理类型为黏液腺癌Fig.2 Male,49 years old,Borrmann Ⅳgastric cancer,mucinous adenocarcinoma.
表4 增强各期肿瘤内外层CT 值统计学比较Tab.4 Statistical comparison of enhanced CT values of inner and outer tumor layers±s
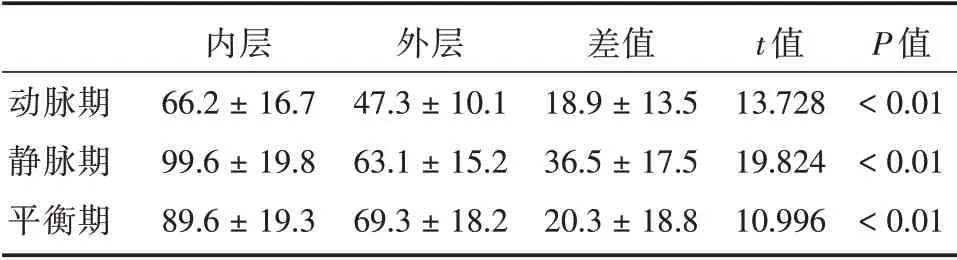
表4 增强各期肿瘤内外层CT 值统计学比较Tab.4 Statistical comparison of enhanced CT values of inner and outer tumor layers±s
动脉期静脉期平衡期内层66.2±16.7 99.6±19.8 89.6±19.3外层47.3±10.1 63.1±15.2 69.3±18.2差值18.9±13.5 36.5±17.5 20.3±18.8 t 值13.728 19.824 10.996 P 值<0.01<0.01<0.01

表5 MDCT 强化方式的二元Logistics 回归分析Tab.5 The binary Logistic regression analysis of the enhancement mode on MDCT
BORRMANN[13]于1926年提出将进展期胃癌按大体形态可分为4 型(Borrmann Ⅰ、Ⅱ、Ⅲ、Ⅳ)。BorrmannⅠ(息肉型):肿瘤呈息肉状,表面可有浅溃疡,多凸向腔内生长,切面界限较清楚;BorrmannⅡ(溃疡型):溃疡较深,边缘隆起,病灶较局限,对周围浸润程度轻,切面界限较清楚;BorrmannⅢ(浸润溃疡型):溃疡面较大且深,边缘不清,对周围浸润程度明显,切面界限不清;Borrmann Ⅳ(弥漫浸润型):肿瘤细胞在胃壁内呈弥漫浸润性生长,浸润处胃壁增厚僵硬,皱襞消失,粘膜浅平,表面可有浅溃疡;若病灶累及全胃,则形成“皮革胃”[9]。
Borrmann Ⅳ型胃癌的发病率约占所有进展期胃癌的10%~20%[14],OTSUJI 等[15]报道,该型患者5年总体生存率为21.4%,预后与其他分型相比最差,采取全胃手术切除及长期术后化疗可改善预后[16]。这是由于Borrmann Ⅳ型胃癌在诊断时往往肿瘤已处于进展期,TNM 分期偏晚,并且易于出现淋巴结转移和浆膜侵犯而造成腹腔种植转移[17]。胃癌传统的诊断方法为胃肠钡餐及胃镜检查,这两种方法在诊断Borrmann Ⅳ型胃癌时的局限性主要为:(1)主要累及黏膜下层,黏膜面无明显的溃疡和肿块[18];(2)不能反映黏膜下层、肌层、浆膜层及胃腔外的病变,无法判断肿瘤对胃壁的浸润深度、邻近组织器官的受侵情况、周围淋巴结转移情况及远处脏器转移等[19]。因此,在胃镜已经成为诊断胃癌的主要方法的当下,Borrmann Ⅳ型胃癌的胃镜下黏膜病理活检假阴性率却甚高。MDCT 的螺旋多期扫描可以观察病变的早期强化和(或)门脉期、平衡期的延迟强化,有助于发现病变的特征性的强化方式[20]。
本研究结果表明,136 例Borrmann Ⅳ型胃癌患者中有123 例在MDCT 强化达峰值期出现了分层强化,表现为明显强化的内层及中度强化的外层,且在平衡期强化程度有所下降。出现该种强化方式的原因,可能与诸多组织病理学因素相关,包括肿瘤细胞的分化程度、浸润模式及肿瘤内基质。首先,肿瘤内基质可能是影响Borrmann Ⅳ型胃癌强化方式的最重要的因素之一[21]。肿瘤内基质的纤维成分有成熟与未成熟之分,成熟的纤维基质主要由致密的胶原蛋白纤维组成,只含有少量细胞和血管;而未成熟的纤维基质包含丰富的成纤维细胞和新生血管。因而,在门脉期增强扫描中,含未成熟纤维化基质的肿瘤强化程度更明显。其次,Borrmann Ⅳ型胃癌具有沿着黏膜下层独特的浸润性生长模式,可无明显的黏膜肿块或溃疡形成,癌细胞通常广泛分散于纤维基质内,并且保留黏膜层、与黏膜下层的分层[18]。再者,本次实验结果显示不同病理类型的Borrmann Ⅳ型胃癌在影像学上趋向于不同的表现形式(如图例的低分化腺癌与黏液腺癌),主要与组织细胞特征、分化程度有关[22]。
本研究中,未分化型胃癌较分化型胃癌MDCT图像出现分层强化的概率增加,提示未分化型胃癌更容易出现分层强化的特征。可能是由于未分化型胃癌肿瘤内基质中未成熟的纤维组织比例较大,而癌细胞通常广泛分散于纤维基质内,并且保留黏膜层、与黏膜下层的分层,导致分层强化的现象。其中,黏液腺癌和和印戒细胞癌的影像表现在未分化癌中具有代表性,分层强化的病理基础是由于肿瘤中大量黏液基质的不强化或弱强化。
Borrmann Ⅳ型胃癌的诊断需与其他可导致胃壁弥漫性增厚的其他疾病进行鉴别[23]:(1)弥漫化脓性胃炎。胃壁弥漫性增厚及黏膜下水肿征是其主要影像表现,但其胃壁增厚程度不及Borrmann Ⅳ型胃癌,且增强后黏膜下水肿带无明显强化,综合临床病史有助于诊断。(2)胃淋巴瘤。胃淋巴瘤是原发于胃黏膜固有层和黏膜下层淋巴滤泡细胞的实性肿瘤,细胞排列密实,血供不丰富,强化程度明显不及Borrmann Ⅳ型胃癌;其他的CT表现还包括:胃壁明显弥漫性增厚,不伴胃腔狭窄,密度较为均匀,全身其他淋巴结肿大常见[24]。
综上所述,Borrmann Ⅳ型胃癌在多期增强CT扫描中具有一定特点:(1)倾向于呈现分层强化的模式;(2)自动脉期至平衡期,增厚的胃壁呈由内向外透壁性强化。
