lncRNA SNHG14通过miR-217-5p/FHIT分子轴抑制膀胱癌细胞的增殖和侵袭能力
2020-08-08鲁帅奇杨凌博秦帅锋张寒孙建涛
鲁帅奇 杨凌博 秦帅锋 张寒 孙建涛
郑州大学附属洛阳中心医院泌尿外科(河南洛阳471009)
膀胱癌是最常见的泌尿系统肿瘤,其恶性程度较高,具有易转移、易复发的特点[1]。传统的治疗如手术治疗、化疗等在近十几年有了较大的发展,然而膀胱癌患者整体的预后仍然较差[2]。基因水平的靶向治疗是膀胱癌研究的重要方向。长链非编码RNA(long-chain non-coding RNA,lncRNA)是一类长度大于200 个核苷酸的单链RNA 分子,由于缺少有效的开放阅读框或包含高密度的终止子,不具有编码蛋白质的功能,长期以来被认为是没有生物学功能的转录副产物[3]。研究[4]表明,lncRNA 可在表观遗传调控、转录调控和转录后调控等多层次调控基因的表达。越来越多的lncRNA 被证实在膀胱癌发生、发展中具有重要调控作用,lncRNA 已成为膀胱癌研究领域新的热点[1]。lncRNA SNHG14 是一个新发现的lncRNA。有研究[5]表明,SNHG14 在恶性神经胶质瘤组织和细胞株中的表达明显降低,高表达SNHG14 可明显抑制神经胶质瘤细胞的增殖和侵袭能力,在神经胶质瘤中发挥抑癌基因作用。SNHG14 在膀胱癌中的表达及作用机制尚不明确。本研究旨在探究SNHG14 在膀胱癌组织和细胞株中的表达,观察高表达SNHG14 对膀胱癌细胞增殖和侵袭能力的影响及其分子作用机制,以期为膀胱癌的基因靶向治疗提供新的思路。
1 材料与方法
1.1 临床标本选取本院泌尿外科于2016年11月至2019年2月行膀胱癌根治性手术切除的癌组织和相应的癌旁组织75 例,于液氮中冷冻保存,标本均经本院两名以上病理科专家确诊。患者平均年龄(54.43±8.32)岁,术前均未行放化疗。本研究经本院伦理委员会同意且患者均签署知情同意书。
1.2 细胞与主要试剂正常膀胱上皮细胞(SVHUC-1)和膀胱癌细胞株(J82、T24、5637、BIU-87)购自中国典型培养物保藏中心。DMEM/F12 培养基、RPMI 1640培养基和胎牛血清购自美国Hyclone公司。SNHG14高表达质粒和阴性对照质粒购自苏州吉玛基因股份有限公司。Transwell 小室购自美国康宁公司。转染试剂LipofectamineTM3000购自美国Invitrogen 公司。Matrigel 基质胶购自美国BD 公司。荧光实时定量PCR(qPCR)试剂盒购自天根生化科技有限公司。二抗购自武汉博士德生物有限公司。噻唑蓝(methyl thiazol tetrazolium,MTT)试剂盒和二甲基亚砜购自南京凯基生物科技发展有限公司。一抗购自美国Cell Signaling Technology 公司。ECL 显影液购自美国Thermo 公司。
1.3 细胞培养和质粒转染J82、T24、5637、BIU-87细胞生长于含10%胎牛血清的RPMI-1640 培养基,SV-HUC-1生长于含10%胎牛血清的DMEM/F12培养基,在37 ℃、5%CO2的细胞培养箱中培养。以对数生长期的BIU-87 细胞为对象,利用LipofectamineTM3000 转染试剂,分别转染阴性对照质粒和SNHG14高表达质粒,定义为对照组和实验组。转染细胞24 h 后,更换新鲜的RPMI-1640 培养基。
1.4 RNA 提取和荧光实时定量PCR提取75 例膀胱癌组织和细胞株的总RNA,采用超微量分光光度计检测每个样品在260 nm 和280 nm 波长处的分光度值,将RNA(二者比值在1.8~2.0 之间)逆转录为cDNA。根据试剂盒说明书配制qPCR 反应体系。以U6 为内参检测miR-217-5p 的表达,以GAPDH 为内参检测SNHG14 和FHIT mRNA 的表达。SNHG14 上游引物为5′-CGTTGTCGAAAGCTAAAAGGA-3′,下游引物为5′-TGTTTCCATCTCACCAAATGC-3′;miR-217-5p 上游引物为5′-GGATGACGTAGTCCTTGA-3′,下游引物为5′-CAGTGCGTGTCGTGGAGT-3′;GAPDH 上游引物为5′-ACAACTTTGGTATCGTGGAAGG-3′,下游引物为5′-GCCATCACGCCACAGTTTC-3′;FHIT 上游引物为5′-ATCTCATCAAGCCCTCTGTAGT-3′,下游引物为5′-GGACGCAGGTCATGGAAGC-3′;U6 上游引物为5′-CTCGCTTCGGCAGCACA-3′,下游引物为5′-AACGCTTCACGAATTTGCGT-3′。qPCR参数为95 ℃预变性5 min,62 ℃25 s,72 ℃25 s,35 个循环,得到Ct 值。获得的Ct 值采用2-ΔΔCt方法计算基因表达量。
1.5 MTT 检测BIU-87 细胞增殖将转染后的BIU-87 细胞胰酶消化后接种于96 孔板,37 ℃、5%CO2培养箱培养。分别于接种后的第1、2、3、4、5天,每孔加入15 μL 浓度为5 g/L 的MTT 溶液,继续培养4 h,每孔加二甲基亚砜200 μL,振荡15 min。以空白孔调零,酶标仪测定每组细胞在450 nm 波长处的光密度(OD)值。
1.6 Matrigel 侵袭实验检测BIU-87 细胞侵袭将转染后的BIU-87 细胞胰酶消化后接种于预铺Matrigel 胶的Transwell 上室,每组均设4 个复孔。加 入600 μL 含10%FBS 的RPMI-1640 培养基至Transwell 下室。继续培养24 h 后,取出Transwell上室,采用多聚甲醛室温下固定10 min,采用0.1%结晶紫染液室温下染色10 min,采用棉签轻轻擦去残留细胞。高倍显微镜下拍照、计数,进入下室的细胞量代表细胞侵袭情况。
1.7 生物信息学技术预测SNHG14 作用的分子机制采用LncBase Predicted v.2 软件预测SNHG14可互补结合的miRNA,采用miRTarBase 软件预测miRNA 可互补结合的基因。
1.8 Western Blot实验检测FHIT蛋白的表达量将转染后的BIU-87 细胞胰酶消化、离心收集后,采用细胞裂解液提取总蛋白。检测蛋白浓度后根据其浓度调节上样量,于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,湿转法转移到NC 膜。将膜置于5%脱脂牛奶封闭,进一步置于一抗FHIT(1∶1 500稀释)、PI3K(1∶1 000 稀释)、AKT(1∶1 500 稀释)、p-AKT(1∶2 000)、mTOR(1∶2 000)及α-Tubulin(1∶500)在4 ℃下孵育过夜。洗膜后在二抗中孵育2 h。滴加ECL 显影液显影,α-Tubulin 为内参。
1.9 统计学方法应用SPSS 18.0 统计软件进行分析,计量数据均采用均数±标准差表示,组间比较采用t检验进行分析,P<0.05 为差异有统计学意义。
2 结果
2.1 SNHG14 在膀胱癌组织和细胞株中低表达qRT-PCR 检测结果显示,SNHG14 在75 例膀胱癌组织中的表达量与癌旁组织相比明显下降[(1.16±0.32)vs.(5.07±0.77),P=0.003],见图1;与正常膀胱上皮细胞相比,SNHG14在膀胱癌细胞株(J82、T24、5637、BIU-87)中的表达量明显下降(均P<0.001),其中在BIU-87 细胞中表达最低,见图2。

图1 SNHG14 在膀胱癌组织和癌旁组织中的表达量Fig.1 Expression level of SNHG14 in bladder cancer and adjacent tissues
2.2 转染SNHG14 表达质粒促进BIU-87 细胞中SNHG14 表达转染SNHG14 表达质粒后48 h,qRT-PCR 检测结果显示,实验组BIU-87 细胞中SNHG14 表达量与对照组相比明显增加[(12.65±1.46)vs.(1.00±0.05),P<0.001]。
2.3 高表达SNHG14 抑制BIU-87 细胞的增殖MTT检测结果显示,在第3、4、5天,高表达SNHG14的实验组BIU-87细胞OD值明显低于对照组(P=0.040、0.023、0.010),表明高表达SNHG14 可抑制BIU-87细胞的增殖能力。见图3。
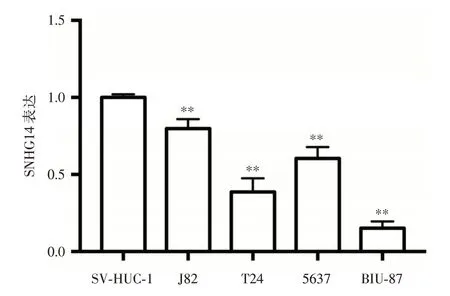
图2 SNHG14 在膀胱癌细胞株和正常膀胱上皮细胞中的表达量Fig.2 Expression level of SNHG14 in bladder cancer cell lines and normal bladder epithelial cell

图3 高表达SNHG14 对BIU-87 细胞增殖能力的影响Fig.3 Effect of over expression SNHG14 on the proliferation of BIU-87 cells
2.4 高表达SNHG14 明显抑制BIU-87 细胞的侵袭Matrigel侵袭实验结果显示,实验组BIU-87细胞穿过底膜的细胞数明显低于对照组[(85.03±10.41)vs.(26.37±7.69),P=0.004],表明高表达SNHG14可抑制BIU-87 细胞的侵袭能力,见图4。
2.5 生物信息学软件预测SNHG14 作用的分子机制采用LncBase Predicted v.2 软件预测显示,SNHG14 可互补结合miR-217-5p;miRTarBase 软件预测显示,miR-217-5p 可互补结合FHIT mRNA,见图5。
2.6 高表达SNHG14对BIU-87细胞中miR-217-5p和FHIT mRNA 表达的影响qRT-PCR 检测结果显示,实验组BIU-87细胞中miR-217-5p mRNA表达量明显低于对照组[(0.19±0.02)vs.(1.01±0.07),P<0.001],FHIT mRNA 表达量明显高于对照组[(5.71±0.64)vs.(1.00±0.03),P<0.001],表明高表达SNHG14 可下调miR-217-5p 的表达,促进FHIT mRNA 的表达。

图4 高表达SNHG14 对BIU-87 细胞侵袭能力的影响Fig.4 Effect of overexpression SNHG14 on the invasion of BIU-87 cells
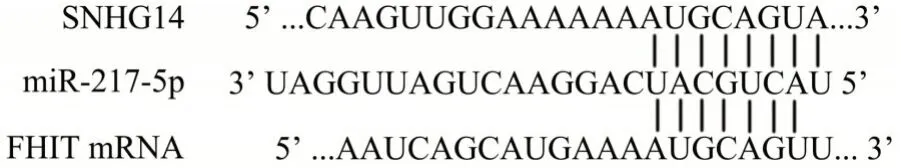
图5 生物信息学技术预测SNHG14 作用机制Fig.5 Bioinformatics technology predicts the mechanism of action of SNHG14
2.7 高表达SNHG14 对FHIT 蛋白表达的影响Western Blot 检测结果显示,高表达SNHG14 后,FHIT 蛋白表达量增加,PI3K/AKT 信号通路蛋白如PI3K、p-AKT 及mTOR 蛋白表达降低,提示PI3K/AKT 信号通路被抑制,见图6。
3 讨论
随着新一代测序技术的发展,lncRNA 已成为近年来非编码RNA 研究领域的热点[6]。lncRNA可通过多种方式调控基因的表达,广泛参与原癌基因或抑癌基因的上调或下调,在细胞分化、增殖、代谢、凋亡、衰老等各种生理病理活动中均具有非常重要的调控功能[7]。lncRNA 在恶性肿瘤中的差异表达和分子作用机制研究逐渐深入,越来越多的lncRNA 被发现与肿瘤的发生、发展密切相关[8]。已有一些lncRNA如ITGB1、UCA1、DUXAP10被证实在膀胱癌中发挥作用,可明显影响膀胱癌细胞的增殖、迁移、侵袭、耐药性等恶性生物学行为,且与膀胱癌的早期诊断、复发、转移和预后判断具有相关性[9-11]。SNHG14 是一个新发现的具有抑癌基因功能的lncRNA,可通过调控miRNA 的表达,抑制肿瘤细胞的增殖和侵袭能力。本研究结果显示,SNHG14 在膀胱癌组织和细胞株中表达量均明显降低,表明SNHG14 可能在膀胱癌的发生、发展中发挥抑癌作用[5]。本研究进一步通过MTT法和Matrigel 侵袭实验发现,高表达SNHG14 可明显抑制膀胱癌细胞增殖和侵袭能力。

图6 高表达SNHG14 对BIU-87 细胞FHIT 相关蛋白表达的影响Fig.6 Effect of high-expressed SNHG14 on the expression of FHIT protein and related proteins in BIU-87 cells
lncRNA 在肿瘤中作用机制之一是“分子海绵”作用,即通过竞争性结合miRNA 并下调miRNA 的表达,干扰miRNA 对其靶基因的抑制作用[12]。生物信息技术预测显示,SNHG14 可互补结合miR-217-5p,miR-217-5p 可互补结合脆性组氨酸三联体(fragile histidine teiad,FHIT)。miR-217-5p在皮肤鳞状细胞癌和胶质母细胞瘤组织中明显高表达,正向调控肿瘤的发生、发展,促进肿瘤细胞的生长和转移,发挥明显的原癌基因作用[13-14]。本研究结果显示,高表达SNHG14 后,膀胱癌细胞中miR-217-5p 的表达明显降低,SNHG14 可能通过“分子海绵”作用下调miR-217-5p 的表达。FHIT 基因位于染色体3q14.2,由147 个氨基酸残基组成,是近年来新发现的抑癌基因。FHIT 在胃癌、胰腺癌、非小细胞肺癌等恶性肿瘤中的表达明显降低,FHIT 通过抑制PI3K/AKT 信号通路转导,可显著抑制肿瘤细胞的增殖、迁移和侵袭,其表达水平与肿瘤患者的预后明显相关[15-18]。FHIT 在膀胱癌组织和细胞株中呈低表达,且FHIT 表达水平与膀胱癌的转移、分期、分级相关,FHIT 的表达水平越高,患者生存期越长[19]。本研究结果显示,SNHG14 抑制miR-217-5p 的表达后,FHIT 基因的表达明显增加,表明SNHG14 可能通过靶向抑制miR-217-5p 的表达,促进FHIT 基因的表达。本研究进一步发现,BIU-87 细胞中FHIT 蛋白表达升高后,PI3K/AKT 信号转导通路蛋白PI3K、p-AKT 及mTOR 表达明显降低,提示PI3K/AKT 信号转导通路被抑制。
综上所述,本研究显示SNHG14在膀胱癌中表达明显降低,高表达SNHG14 可降低膀胱癌细胞的增殖和侵袭能力,其分子机制可能是抑制miR-217-5p 的表达后促进FHIT 基因的表达,从而进一步阻滞PI3K/AKT 信号通路。SNHG14 可能为膀胱癌的分子治疗提供新的靶点。
