克氏原螯虾源维氏气单胞菌的分离鉴定及组织病理学观察
2020-08-07胡瑞雪金玉立顾泽茂
胡 骞 胡瑞雪 金玉立 顾泽茂
(1.华中农业大学双水双绿研究院/水产学院,武汉 430070;2.湖北省水生动物病害防控工程技术研究中心,武汉 430070)
克氏原螯虾(Procambarus clarkii)俗称“小龙虾”,隶属于节肢动物门(Arthropoda),是我国重要的淡水养殖品种,深受消费者喜爱。我国是世界上最大的克氏原螯虾养殖国家,近几年我国克氏原螯虾养殖总产量不断增加,2017年全国总产量高达1.1297×109kg,养殖面积达8.0×105hm2[1]。随着我国养殖规模的不断扩大,克氏原螯虾的病害也呈现爆发趋势,给养殖业带来了较大的经济损失和环境污染,也威胁克氏原螯虾的质量安全。
气单胞菌属中的豚鼠气单胞菌(Aeromonas cavive)[2]、嗜水气单胞菌(Aeromonas hydrophila)[3]和维氏气单胞菌(Aeromonas veronii)[4,5]等细菌感染能引起克氏原螯虾的大量死亡。其中维氏气单胞菌(Aeromonas veronii)属于气单胞菌科气单胞菌属,是一种广泛存在于淡水、海水、淤泥和土壤中的条件致病菌,能引起人类肠胃炎、肺炎和伤口感染[6],也可感染多种水生动物,导致斑点叉尾鮰(Ictalurus punctatus)[7]、泥鳅(Paramisgurnus dabryanus)[8]、达氏鲟(Acipenser dabryanus)[9]、鲶(Silurus soldatovi)[10]等鱼类发病死亡,引起中华绒螯蟹(Eriocheir sinensis)[11]、凡纳滨对虾(Litopenaeus vannamei)[12]的无力死亡。
2016年5月,湖北省洪湖市、荆州市、潜江市及安徽省合肥市等地区养殖的克氏原螯虾陆续出现暴发性死亡。患病虾四肢无力,反应迟钝,应激能力较弱,伏于池塘边沿或水草后死亡。为明确该病病原,本研究通过形态特征观察、生理生化鉴定,结合16S rDNA和gyrB序列分析测定和系统发育分析对从患病虾中分离到的病原菌进行鉴定,观察回归感染后病虾肝胰腺、肠道和心脏的病理变化,并检测了药物敏感性,以期为该病的防控和基础研究提供参考依据。
1 材料与方法
1.1 试验虾
患病克氏原螯虾取自湖北省潜江市某基地,体长为(7.0±1.0) cm。供试健康克氏原螯虾购自潜江市农贸市场,平均体长为(8.0±0.7) cm。
1.2 主要试剂
脑心浸液培养基(BHI)购自青岛高科园海博生物技术有限公司,细菌微量生化管、药敏纸片均购自杭州微生物试剂有限公司,细菌基因组DNA提取试剂盒购自康为世纪生物科技有限公司。
1.3 致病菌的分离与回归感染
取典型患病的克氏原螯虾,用75%酒精对其体表进行消毒,无菌操作取其肝胰腺组织,划线接种于BHI琼脂平板,28℃恒温培养24h,随机挑取3株优势菌落,进一步划线纯化培养。将纯化的菌株用BHI培养基28℃过夜摇匀培养,加终浓度15%的甘油,-80℃冰箱保存备用。
将500只健康克氏原螯虾运至实验室暂养,水温为(24±1)℃,日换水量约30%,做好水草躲避场所,及时充氧清污并定期投喂人工配合饲料。暂养10d后,取400尾健康克氏原螯虾随机分成4组,3个实验组和1个对照组,每组三个平行,每个平行20尾虾。将上述分离纯化的菌株过夜培养用于人工感染实验,血球计数板测定菌液浓度,用无菌生理盐水调节菌悬液浓度为1.0×106、1.0×107和1.0×108CFU/mL。实验组分别在虾的第三步足基部关节软膜处注射0.1 mL不同浓度的菌液,对照组注射相同体积的无菌生理盐水。连续观察虾的摄食、活动及发病情况,记录每组虾的死亡数量,使用改良寇氏法计算LD50,对濒死病虾进行细菌再分离和鉴定。
1.4 致病菌的鉴定
生理生化鉴定 参照《伯杰氏细菌鉴定手册》[13]和《常见细菌系统鉴定手册》[14],利用微量细菌生化鉴定管对分离株的生理生化指标进行测定。
PCR鉴定参照TIANGEN细菌基因组DNA提取试剂盒使用说明书提取分离菌株的基因组DNA,以提取的的DNA为模板,用正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)对细菌的16S rDNA进行扩增。PCR的扩增条件为: 94℃预变性4min;94℃变性30s,55℃退火30s,72℃延伸1min,共30个循环;72℃延伸6min;16℃结束反应程序。同时,采用通用引物UP-1和UP-1S对模板基因组DNA的gyrB基因进行扩增[15],扩增条件为: 94℃预变性4min;94℃变性1min,60℃退火1min,72℃延伸2min,共30个循环;72℃延伸6min;16℃结束反应程序。PCR产物的纯化与测序委托奥科鼎盛生物科技有限公司完成,其中gyrB基因的测序引物为UP-2r和UP-2Sr[15]。所得序列通过NCBI的Blast进行同源性检索,GenBank下载相关序列,Muscle比对后,利用MEGA 7.0软件,选用NJ方法构建系统发育树。
1.5 克氏原螯虾的病理损伤研究
取健康虾100尾,随机分为2组,第一组60尾注射无菌生理盐水稀释的3×107CFU/mL浓度菌液;第二组40尾,注射生理盐水。无菌生理盐水稀释菌液浓度至3×107CFU/mL进行感染试验,正常组注射0.85%生理盐水,接种后第6h、12h、24h、48h和72h采样,每个时间点取3尾,采集肝胰腺、心脏、肠道等组织,4%多聚甲醛固定48h,经脱水、透明、浸蜡、石蜡包埋等步骤处理,切片厚度为4 μm,组织切片用苏木精-伊红(HE)染色,中性树脂封片后显微镜(Olympus CX21)观察拍照。
1.6 药物敏感性实验
将菌株悬液均匀涂布于BHI琼脂平板上,采用标准Kirby-Bauer纸片扩散法对其进行16种抗生素药物的敏感性检测,以抑菌圈直径作为判定指标,参照文献[16]确定致病菌株对药物的敏感程度。所用抗生素涉及喹诺酮类、四环素类、β-内酰胺类、氨基糖苷类、磺胺类和氯霉素类。
2 结果
2.1 致病菌的分离
从自然患病克氏原螯虾肝胰腺划线接种后,BHI固体培养基上长出大量色泽和形态均一的菌落,菌落呈圆形、不透明、灰白色,表面光滑、中央隆起、边缘整齐,直径为1—2 mm。从平板上随机挑取3个单菌落,对其16S rDNA序列进行扩增、测序,获得3条完全一致的序列,挑选其中一株为代表菌株,命名为QD160502。
从表1可以看出,克氏原螯虾人工注射QD160502后,在12h内开始出现死亡,1.0 ×108CFU/mL实验组虾在36h内全部死亡,当注射菌液浓度为1.0 ×107CFU/mL时,虾的死亡率在48h后高达90%,对照组不发病。使用改良寇氏法计算72hLD50值为2.98×106CFU/mL。人工感染的发病症状与自然发病症状相似,主要表现为螯足无力、行动迟缓。从人工感染后濒死虾的肝胰腺分离到的菌株与QD160502的形态特征、理化性质及16S rDNA、gyrB序列完全一致,证明为同一菌株。回归感染实验表明菌株QD160502为本次发病的病原菌,且对克氏原螯虾有着较强的致病性。
2.2 致病菌的鉴定
菌株QD160502的生理生化特性鉴定结果见表2,在35个特性中,除七叶苷水解阴性、精氨酸双水解酶阳性和水杨苷发酵阴性与维氏气单胞菌参考菌株有差异外,其他结果均一致,初步鉴定QD160502为维氏气单胞菌。
菌株QD160502的16S rDNA序列长度为1441 bp(GenBank登录号为: KX585901),gyrB序列长度为1143 bp(GenBank登录号: MN189983),在NCBI中进行Blast同源性检索,发现其16S rDNA序列与维氏气单胞菌的同源性最高(99.9%),gyrB序列与维氏气单胞菌的同源性最高(98.53%)。选取不同气单胞菌属的代表株16S rDNA序列构建系统发育树(图1、图2)。结果显示,QD160502与维氏气单胞菌聚为一支。

表 1 菌株QD160502对克氏原螯虾人工感染实验结果Tab.1 The mortality of Procambarus clarkii challenged with strain QD160502

表 2 菌株QD160502的理化特性Tab.2 Physiological and biochemical characteristics of strain QD160502
2.3 致病菌感染克氏原螯虾的动态病理学研究
正常肝小管形态完整,排列紧密(图版Ⅰ-1);6h后,肝小管结构保持完整,肝小管间出现少量嗜伊红物质(图版Ⅰ-2);12h后,分泌细胞(B细胞)中出现内含棕色颗粒的转运小泡(图版Ⅰ-3);24h后,含棕色颗粒的转运小泡数目增加,肝小管间出现炎性细胞浸润(图版Ⅰ-4);48h后,储存细胞(R细胞)与分泌细胞(B细胞)大量解体、空泡化(图版Ⅰ-5);72h后,肝小管上皮细胞坏死,可见破裂组织落入管腔(图版Ⅰ-6)。
正常肠道结构形态完整,由外向内分别为外膜层、肌肉层、结缔组织层、上皮层、几丁质层(图版Ⅱ-1);在本实验中,观察到肠道组织从攻毒24h之后开始出现明显的病理变化,攻毒24h后肠道结缔组织萎缩,柱状上皮组织与结缔组织剥离(图版Ⅱ-2);48h后皱嵴减少,组织间存在大量裂隙(图版Ⅱ-3);72h后柱状上皮组织损伤和坏死,组织间存在大量裂隙,可见外膜层与肌肉层分离(图版Ⅱ-4)。
正常心脏结构形态完整;24h后,心脏出现空泡样扩张(图版Ⅲ-2);48h后,心肌出现大量空泡样扩张(图版Ⅲ-3);72h后,心脏内出现透明细胞聚集(图版Ⅲ-4)。

图2 基于QD160502 gyrB序列构建的气单胞菌的NJ树Fig.2 Phylogenetic NJ tree based on QD160502 gyrB sequence
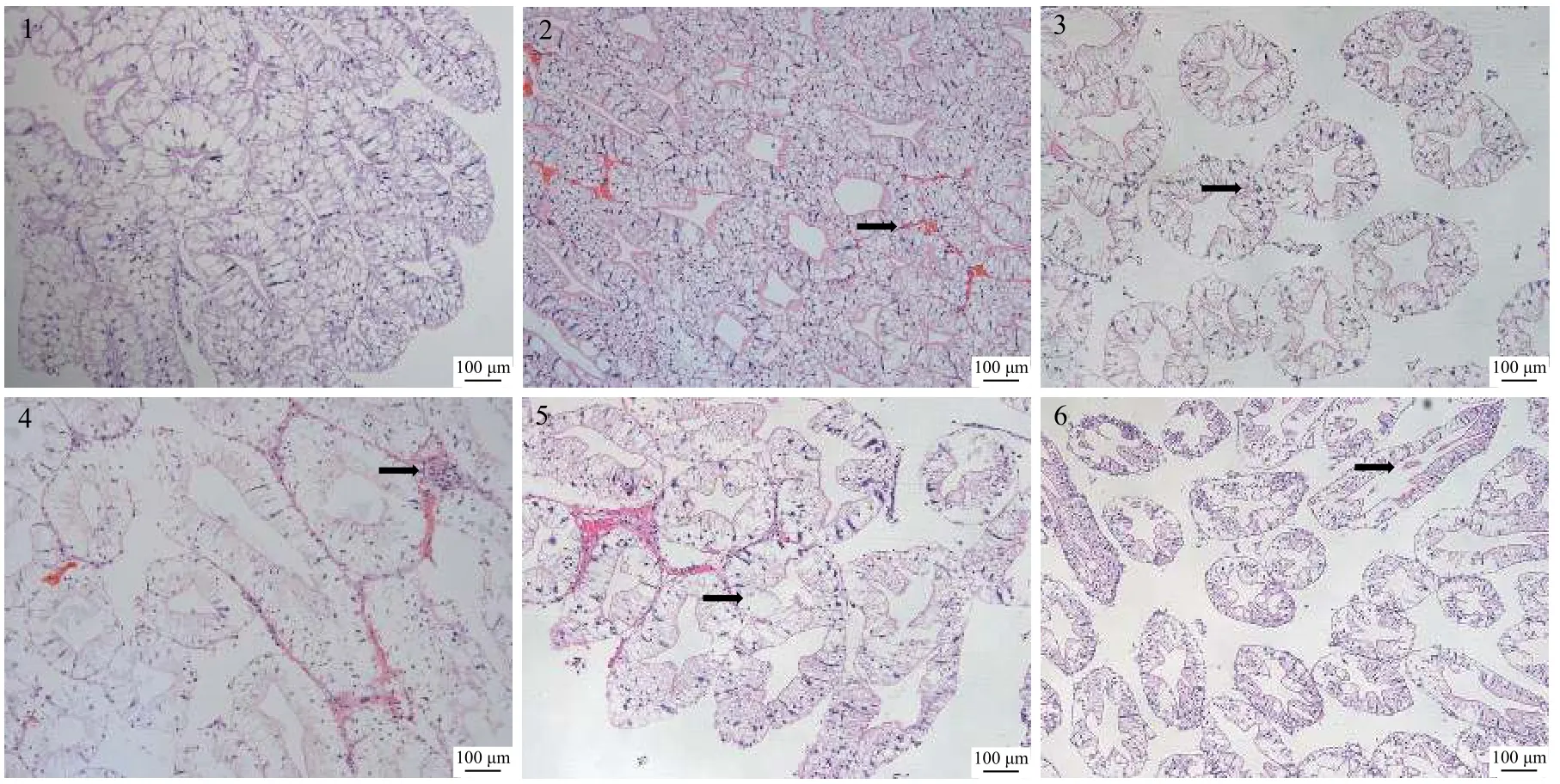
图版 I 注射攻毒后克氏原螯虾肝胰腺组织结构Plate I Hepatopancreas histopathology after QD160502 challenge
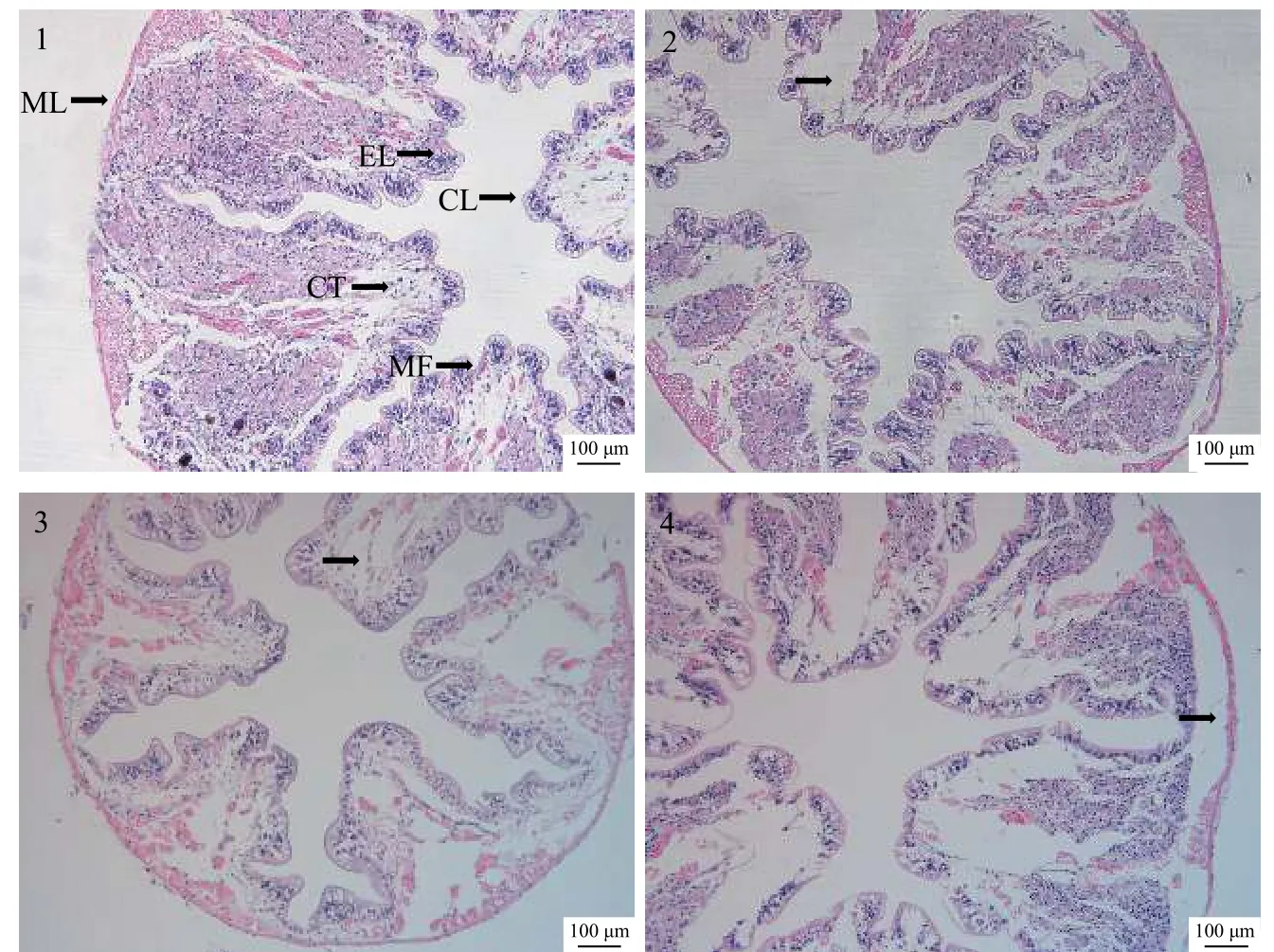
图版 Ⅱ 注射攻毒后克氏原螯虾中肠组织结构Plate Ⅱ Midgut histopathology after QD160502 challenge
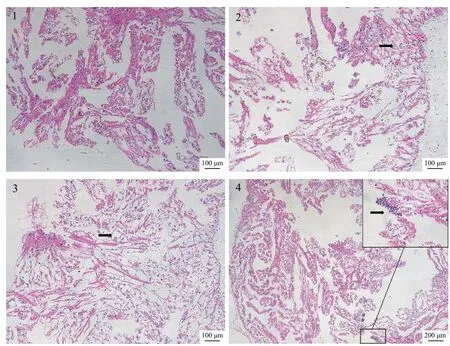
图版 Ⅲ 注射攻毒后克氏原螯虾心脏组织结构Plate Ⅲ Histopathology of heart after QD160502 challenge
2.4 致病菌的药敏性
菌株QD160502对16种抗生素的药敏实验结果见表3。该菌对恩诺沙星、诺氟沙星、氧氟沙星、左氧氟沙星、四环素、强力霉素、复方新诺明高度敏感;对头孢氨苄、新霉素、庆大霉素、磺胺甲基异恶唑、氟苯尼考中度敏感;对青霉素、阿莫西林、链霉素、卡那霉素耐药。
3 讨论
维氏气单胞菌作为条件性致病菌在水体环境中广泛存在,在夏、秋两季其繁殖最快,近几年维氏气单胞菌引起的疾病暴发病例越来越多,给水产养殖业造成了巨大经济损失[17]。本研究从患病克氏原螯虾肝胰腺分离的优势菌株QD160502,经细菌形态学及生理生化指标结果初步鉴定为维氏气单胞菌。分子鉴定发现分离菌株的16S rDNA序列和gyrB序列与NCBI中收录的维氏气单胞菌最为接近,系统发育分析结果显示QD160502与维氏气单胞菌聚为一支,结合分离株的形态学特征及生理生化特性进一步鉴定该分离株为维氏气单胞菌。维氏气单胞菌感染克氏原螯虾已有陆续报道,2016年姜光明等[4]从江苏一中华绒螯蟹和克氏原螯虾混养池中患菌血症的虾上分离到了有强致病性的维氏气单胞菌和弗氏柠檬酸杆的混合感染,2018年彭博文等[5]报道从荆州某养殖场患病克氏原螯虾上分离出致病性维氏气单胞菌,上述两起报道中病害的暴发时间分别为6月与4月下旬,而本研究中病害暴发于5月,4月下旬至6月是克氏原螯虾养殖与出售的关键时期,此时期水温与部分运动性嗜温气单胞菌物种,如嗜水气单胞菌和维氏气单胞菌的最适温度区间相重合[13],因此,维氏气单胞菌对克氏原螯虾的潜在危害性足够引起相关学者和养殖者的注意。
本研究通过组织病理学观察发现随着感染状态的持续,病虾组织会出现不同程度的病理损伤。在注射24h内心脏和肠道并未出现明显病理变化,肝胰腺结缔组织间出现了少量嗜伊红物质,肝小管分泌细胞内出现含有棕色颗粒的转运小泡。在注射接种24后,病虾肝胰腺和肠道组织出现明显的病理特征,表现为肝小管内储存细胞(R细胞)与分泌细胞(B细胞)大量解体和空泡化,肠道柱状上皮细胞以及结缔组织的坏死、肠嵴减少。王权等[18]和丁正峰等[19]在克氏原螯虾的药物急性毒理研究中都观察到了类似的含颗粒小泡,也有研究指出环境的胁迫如低pH[20]和低盐度[21]也会引起虾蟹肝胰腺内分泌细胞中转运泡和空泡增多,王权等[18]推测该颗粒可能是一种富锌转运泡,与克氏原螯虾对重金属的解毒功能有关,而丁正峰等[19]推测该颗粒是虾在受到有害物质的刺激时,出现黑色素的沉积症状。储存细胞(R细胞)与分泌细胞(B细胞)分别具有消化吸收营养物质和储藏营养物质的功能[21],我们推测转运泡增加是机体在感染胁迫下营养消耗增加引起。肝胰腺和肠道是克氏原螯虾重要的营养消化和吸收器官,细胞坏死和空泡变性影响了肠道和肝胰腺的结构功能的完整性,感染虾表现的摄食减少病症也加重克氏原螯虾面临的饥饿胁迫[22,23],降低病虾对疾病和环境应激的抵抗能力,进一步诱发克氏原螯虾的死亡。此外,心肌细胞空泡样扩张和大量血细胞的聚集,可能引起克氏原螯虾心脏的收缩舒张异常,导致心律衰竭与血淋巴循环障碍[19],这可能是克氏原螯虾死亡的另一重要原因。
目前对水产动物细菌性疾病的控制仍主要依靠抗菌药物,但使用渔用抗生素应该科学而谨慎,避免因抗生素滥用或错用所导致的耐药性产生,环境污染和抗生素残留问题。本研究在进行药物敏感性检测时所选用的抗生素回避了渔用禁药,包括目前水产常用抗生素类以及部分还未被开发成水产药物的抗生素,结果发现维氏气单胞菌对喹诺酮类和四环素类中的药物都敏感,而对氨基糖苷类的药物不敏感。在进行疾病防治时,应着重注意池塘环境改良与维护,精准用药,尽可能地减轻对环境的污染。

表 3 菌株QD160502的药物敏感试验结果Tab.3 Antibiotics sensitivities of the strain QD160502
