黄蜀葵和秋葵不同部位黄酮类成分含量测定方法研究
2020-08-06李婧刘玉翠高宇丹范如玉肖井雷长春中医药大学药学院长春307长春中医药大学附属医院长春300
★ 李婧 刘玉翠 高宇丹 范如玉 肖井雷*(.长春中医药大学药学院 长春 307;.长春中医药大学附属医院 长春 300)
黄蜀葵Abelmoschus manihot(L.) Medic.和秋葵Abelmoschus esculentu(L.)Moench均为锦葵科秋葵属一年生或多年生草本植物,黄蜀葵花具有清利湿热、消肿解毒的作用[1]。而黄蜀葵种子具有清热解毒、凉血消肿的功效,可用于淋证、水肿、便秘、乳汁不通、痈肿、跌打损伤的治疗,为“催生及利小便之要药”[2]。国外研究种子油有多种医疗保健作用,但国内对其开发利用报道较少[3]。秋葵是一种保健蔬菜,其中含有丰富的蛋白质、不饱和脂肪酸、游离氨基酸、矿物质、维生素、生物碱等多种生物活性成分[4-5]。具有抗疲劳、健胃保肝、能减少肺损伤、提高机体免疫力、抗癌作用、利尿、增强血管扩张力、保护心脏等保健功能[6]。
据报道黄蜀葵和秋葵中主要含有黄酮类成分,且部分成分尚未建立适宜的质量评价方法。本实验对黄蜀葵花、种子,秋葵花、种子、果实中金丝桃苷、杨梅素、槲皮素的含量测定方法进行了研究,为黄蜀葵、秋葵的质量控制标准研究提供了理论依据。
1 材料
1.1 仪器 岛津LC-2030高效液相色谱仪(岛津企业管理中国有限公司);FA1004B十万分之一电子天平(上海佑科仪器仪表有限公司);JA2603B万分之一天平(上海天美天平仪器有限公司);KQ-500E型超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药 金丝桃苷对照品(购于中国食品药品检定研究院,CAS:48236-0);槲皮素对照品(北京普天同创生物科技有限公司,CAS:117-39-5);杨梅素(北京普天同创生物科技有限公司,CAS:529-44-2)。甲醇(分析纯,北京化工厂);乙腈(色谱纯,Fisher公司);磷酸(分析纯,天津市福晨化工试剂厂);水为纯净水。
1.3 药材 样品采自长春中医药大学七星百草园。经长春中医药大学肖井雷副教授鉴定:黄蜀葵花、种子为锦葵科黄蜀葵Abelmoschus manihot(L.)Medic.的干燥花和种子;秋葵花、种子、果实为锦葵科秋葵Abelmoschus esculentu(L.) Moench的干燥花、种子和果实。
2 方法与结果
2.1 色谱条件的优化
2.1.1 流速 在色谱柱Inertsil® ODS-3(4.6 mm×250 mm,5 µm)、柱温30℃条件下,考察了不同流速(0.8、1.0、1.2 mL/min)对黄酮类成分分离的影响。结果表明,流速为1.0 mL/min时,系统压力适中,灵敏度高,分离度好。故该方法确定流速为1.0 mL/min。
2.1.2 流动相 在色谱柱Inertsil® ODS-3(4.6 mm×250 mm,5 µm)、柱温30℃、流速为1.0 mL/min条件下,考察了不同梯度的乙腈-0.4%磷酸溶液(23∶77、25∶75、28∶72、30∶70)对黄酮类成分分离的影响。结果表明,黄蜀葵花采用乙腈-0.4%磷酸溶液(28∶72)洗脱,而黄蜀葵种子、秋葵采用乙腈-0.4%磷酸溶液梯度洗脱(0~30 min 23∶77;30~35 min 27:73)
上述研究确定黄蜀葵花的色谱条件(Ⅰ)为:色谱柱Inertsil® ODS-3(4.6 mm×250 mm,5 µm);流动相乙腈-0.4%磷酸溶液(28∶72);检测波长360nm;流速1.0mL/min;柱温30 ℃;进样量4 µL。黄蜀葵种子、秋葵的色谱条件(Ⅱ)为:色谱柱Inertsil® ODS-3(4.6 mm×250 mm,5 μm);流动相乙腈-0.4%磷酸溶液;梯度洗脱(0~30 min 23∶77;30~35 min 27∶73)流速1.0 mL/min;检测波长360 nm;柱温30℃ ;进样量 10 μL。
2.2 混合对照品的制备 精密称定金丝桃苷、杨梅素、槲皮素对照品适量,分别加甲醇制成每1 mL含0.1 mg、0.05 mg、0.05 mg的混合溶液(Ⅰ),含0.07 mg、0.03 mg、0.002 5 mg的混合溶液(Ⅱ),即得。
2.3 供试品溶液的制备 精密称取供试品各1.000 g,置于50 mL具塞锥形瓶中,精密加入甲醇25 mL,称定重量,超声处理30 min(250 W,30 KHz),放冷,称重,用甲醇补足减失重量并摇匀,滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 线性关系考察 取混合对照品溶液Ⅰ4,8,12,16,20 μL,按色谱条件Ⅰ进样,以进样量(μg)为横坐标,峰面积(A)为纵坐标绘制标准曲线,计算回归方程。金丝桃苷,杨梅素、槲皮素的回归方程分别为Y=266 476X+86 820,Y=13 210X+1 146.9,Y=18 188X-1 296.1;相关系数r分别为0.999 8、0.999 9、0.999 9 ;线性范围分别为 0.4~2.0 µg,0.2 ~1.0 µg,0.2~1.0 µg。
取混合对照品溶液Ⅱ2,4,6,8,10 μL,按色谱条件Ⅱ进样,以进样量(μg)为横坐标,峰面积(A)为纵坐标绘制标准曲线,计算回归方程。金丝桃苷,杨梅素、槲皮素的回归方程分别为Y=211 710X-371.4,Y=140 332X+4 841.3,Y=10 708X-1 173.4;相关系数r分别为0.999 7、0.999 6、0.999 5;线性范围分别为 0.14~0.7 µg,0.06~0.3 µg,0.005~0.025 µg。
2.4.2 精密度实验 精密吸取混合对照品Ⅰ4 μL,连续进样6次,记录峰面积。计算金丝桃苷、杨梅素、槲皮素RSD分别为1.05%,1.16%,1.13%(n=6),表明仪器精密度良好。
2.4.3 稳定性试验 精密吸取黄蜀葵花供试品4 μL,室温下分别放置0,2,4,8,12,24 h后进样测定,记录峰面积。计算黄蜀葵花中金丝桃苷、杨梅素、槲皮素的RSD(n=6)分别为1.7%、1.5%、1.1%,表明该供试品溶液在24 h内稳定。
2.4.5 重复性试验 精密称取1.000 g黄蜀葵花干燥粉末6份,按照2.3项下方法制备供试品溶液,按色谱条件Ⅰ下方法测定峰面积,计算金丝桃苷、杨梅素、槲皮素的RSD(n=6)分别为1.6%、1.7%、1.9%,,结果表明该方法重复性良好。
2.4.4 加样回收率试验 精密称取黄蜀葵花供试品粉末6份,分别精密加入一定量3种对照品,按照2.3项下方法制备供试品溶液,按色谱条件Ⅰ下方法测定峰面积,计算各成分的加样回收率及RSD。结果金丝桃苷、杨梅素和槲皮素的平均回收率分别为101.36%、97.89%和99.63%,RSD分别为1.39%、1.18%和1.54%,表明该方法加样回收实验结果良好。
2.5 样品测定 分别精密吸取各供试品溶液Ⅰ(4 μL)、Ⅱ(10 μL),注入高效液相色谱仪,测定各成分含量。HPLC图见图1。
测定结果显示,金丝桃苷含量:黄蜀葵花(12.7 mg/g)>秋葵花(0.052 6 mg/g)>黄蜀葵种子(0.005 2 mg/g)>秋葵果实(0.004 1 mg/g)>秋葵种子(0.002 5 mg/g);杨梅素含量:仅存于黄蜀葵花中(0.41 mg/g);槲皮素含量:黄蜀葵花(0.197 mg/g)>秋葵花(0.015 mg/g)>黄蜀葵种子(0.007 2mg/g)>秋葵种子(0.005 1 mg/g)。本研究表明三种黄酮类成分在黄蜀葵和秋葵不同部位的含量存在明显差异,以花中三种成分含量最多,其次是种子,最后为果实。本次研究为黄蜀葵和秋葵高效资源化分析利用提供了依据。
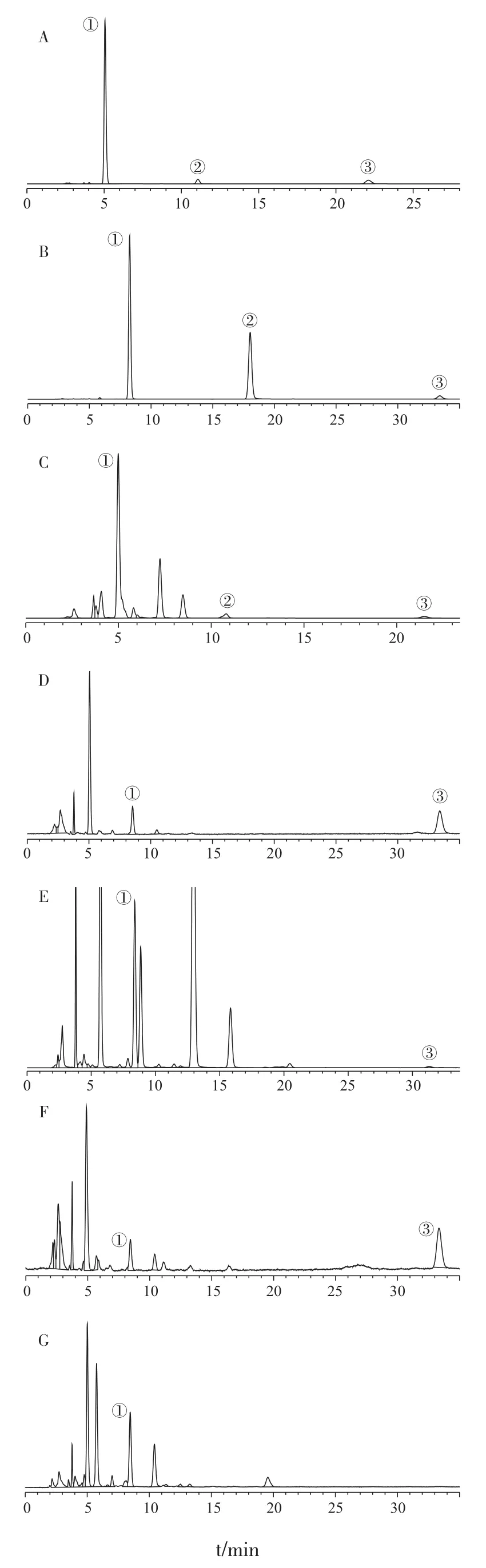
图1 各样品溶液HPLC图
3 小结与讨论
(1)本方法首先参照2015版《中国药典》中测定金丝桃苷含量的色谱条件进行三种成分的洗脱,即乙腈-0.1%磷酸溶液(15∶85),结果显示金丝桃苷的峰且出峰时间在42min左右,杨梅素出峰时间在60 min左右,出峰时间过长[7-8]。进而更改流动相比例为乙腈-0.1%磷酸溶液20∶80,出峰时间虽缩短但拖尾严重;为消除拖尾现象又将0.1%的磷酸溶液改成0.4%磷酸溶液,并依次用不同比例的乙腈-0.4%磷酸溶液摸索出最佳色谱条件。
(2)采用HPLC法单独测定金丝桃苷、槲皮素、杨梅素含量的报道较多[9-11],但同时测定黄蜀葵和秋葵中三种成分含量的方法却未见报道,本文通过优化色谱条件,建立了同时测定金丝桃苷、槲皮素、杨梅素含量的方法,且该法结果准确,灵敏度高,重现性好,能够对黄蜀葵和秋葵不同部位中金丝桃苷、杨梅素、槲皮素的含量进行定量分析,为其质量评价提供了依据。
