沉默重组蛋白2对NCI-H1688细胞的抑制作用及其Wnt/β连环蛋白信号通路机制
2020-08-06潘殿柱马艳梅
陈 艳,潘殿柱,刘 忠,马艳梅,张 岚
(锦州医科大学附属第一医院呼吸科,辽宁 锦州 121000)
T细胞淋巴瘤常见重排蛋白(frequently rearranged in advanced T-cell lymphomas,Frat)最早作为T细胞淋巴瘤原癌基因被发现,后来证实Frat为Wnt信号通路的重要组成部分。Frat包括Frat1和Frat2,研究[1-2]证实:Frat1通过Wnt信号通路在多种恶性肿瘤中发挥作用。张勇等[3]研究发现:Frat1在非小细胞肺癌组织中异常表达,其表达水平与肺癌细胞的侵袭和迁移等关系密切。Frat2也是Wnt信号通路的正向调节因子,但Frat2在肺癌中的作用尚不清楚。Wnt信号通路在小细胞肺癌细胞的增殖中发挥重要作用[4-5],而Frat2主要通过Wnt信号通路发挥作用,故本研究对NCI-H1688细胞中Frat2的表达及沉默Frat2对NCI-H1688细胞增殖及Wnt信号通路的影响进行研究,探讨Frat2对小细胞肺癌的可能作用机制。XAV939为 Wnt/β连环蛋白(β-catenin)信号通路抑制剂,可抑制 Wnt/β-catenin的调节转录,本研究同时对NCI-H1688细胞给予XAV939处理,进一步验证Frat2对小细胞肺癌的作用是否与 Wnt/β-catenin信号通路有关。
1 材料与方法
1.1 细胞、主要试剂和仪器人小细胞肺癌NCI-H1688细胞和正常支气管上皮样细胞HBE细胞(中国科学院上海细胞库)。Frat2-siRNA慢病毒及阴性对照慢病毒(上海吉凯基因构建制备),逆转录(reverse transcription,RT)试剂盒、TRIzol试剂、聚合酶链反应(polymerase chain reaction,PCR)试剂盒和ECL化学发光试剂盒(美国BPB公司),Wnt信号通路抑制剂XAV939、胰蛋白酶、MTT试剂和DMEM培养基(美国Sigma公司),鼠抗人Frat2单克隆抗体(货号:SC-100437)、鼠抗人增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体(货号:SC-103214)、鼠抗人c-myc单克隆抗体(货号:SC-100801)、鼠抗人细胞周期蛋白D1(Cyclin D1)单克隆抗体(货号:SC-100025)、鼠抗人β-catenin单克隆抗体(货号:SC-100183)和鼠抗人磷酸化糖原合成酶激酶3(phosphorylated glycogen synthase kinase 3,pGSK-3β)单克隆抗体(货号:SC-10427)(美国Invitrogen公司)。PCR扩增仪(美国Gibco公司),流式细胞仪和酶标仪(美国Bio-Rad公司)。
1.2 Western blotting法检测NCI-H1688细胞和HBE细胞中Frat2蛋白表达水平取生长良好的NCI-H1688细胞和HBE细胞,加入蛋白裂解液裂解后, 12 000 r·min-1离心10 min,取上清液采用BCA法测定蛋白浓度,在SDS-PAGE凝胶中加入30 μg蛋白样品,电泳、转膜,加入封闭液封闭2 h,加入一抗:兔抗人Frat2单克隆抗体(1∶200)过夜孵育,加入含辣根过氧化物酶标记的二抗孵育1 h,ECL发光。以β-actin为内参,实验重复7次,采用凝胶电泳成像仪采集图像,Quantity One软件分析蛋白条带灰度值。Frat2蛋白表达水平以Frat2条带灰度值/β-actin条带灰度值比值表示。
1.3 逆转录实时荧光定量聚合酶链反应(Real-Time RT-qPCR)法检测NCI-H1688细胞和HBE细胞中Frat2 mRNA表达水平取生长良好的NCI-H1688细胞和HBE细胞加入TRIzol裂解液充分裂解,加入氯仿震荡15 s、静止3 min,2 000 r·min-1离心10 min,吸取上层水相溶液、异丙醇沉淀,乙醇洗涤,提取总RNA,逆转录为cDNA,进行Real-Time RT-qPCR,以GAPDH为内参。反应条件:95℃预变性60 s,60℃变性30 s,60℃退火30 s,共42个循环。引物序列:Frat2,上游5′-GTGGCTTCTCACCGAATCCAG-3′,下游5′-AGTGACTGAGTCCGGTCCG-3′,扩增长度325 bp;GAPDH,上游5′-GAAGTGAAGGTCGGAGTCA-3′,下游5′-TTCACACCCATGACGAACAT-3′,扩增长度402 bp。每组实验重复7次,以2-ΔΔCt法计算Frat2 mRNA表达水平。
1.4 细胞分组和慢病毒转染将NCI-H1688细胞随机分为空白对照组、阴性对照组、Frat2-siRNA组和Frat2-siRNA+XAV组。空白对照组细胞不转染,阴性对照组细胞转染阴性对照慢病毒,Frat2-siRNA组细胞转染Frat2-siRNA慢病毒,Frat2-siRNA+XAV组细胞转染Frat2-siRNA慢病毒并同时加入4 μmol·L-1的Wnt信号通路抑制剂XAV939处理[5]。具体步骤:将各组NCI-H1688细胞洗涤,以5×104个/孔接种至6孔板中,吸出培养液上清后加入适量病毒液,使感染复数(MOI)为20,培养12 h,显微镜下观察各组细胞生长情况,转染4 d后检测转染效率,转染效率高于90%时用于实验。
1.5 转染效果测定取上述稳定转染的各组NCI-H1688细胞,采用Western blotting法和Real-Time RT-qPCR法测定各组NCI-H1688细胞中Frat2蛋白和mRNA表达水平,具体步骤同“1.2”和“1.3”。
1.6 MTT法检测各组NCI-H1688细胞增殖活性将上述各组转染后细胞接种到96孔板中,每孔1×104个细胞,培养24、48和72 h时分别在每孔细胞中加入20 μL MTT溶液,继续培养4 h,吸取培养液上清液,加入150 μL二甲基亚砜,震荡反应10 min,用酶联免疫检测仪测定490 nm波长处吸光度(A)值,代表细胞增殖活性,每组实验重复7次。
1.7 流式细胞术检测各组不同细胞周期细胞百分率取上述转染后各组NCI-H1688细胞,2 000 r·min-1离心10 min,弃去上清液,加入PBS液,调整细胞浓度为5×105mL-1,加入乙醇固定12 h,加入PBS液重悬细胞,加入碘化丙啶染色液孵育30 min,采用流式细胞仪检测各组不同细胞周期NCI-H1688细胞百分率,每组实验重复7次。
1.8 Western blotting法检测各组NCI-H1688细胞中PCNA、c-myc、Cyclin D1、β-catenin和pGSK-3β蛋白表达水平取各组转染后NCI-H1688细胞,采用Western blotting法测定各蛋白浓度,一抗分别为兔抗人PCNA单克隆抗体、兔抗人c-myc单克隆抗体、兔抗人Cyclin D1单克隆抗体、兔抗人β-catenin单克隆抗体和兔抗人pGSK-3β单克隆抗体。具体方法同“1.2”。
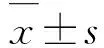
2 结 果
2.1 NCI-H1688细胞和HBE细胞中Frat2蛋白和mRNA表达水平NCI-H1688细胞中Frat2蛋白和mRNA表达水平明显高于HBE细胞(P<0.01)。见表1和图1。
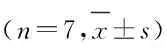
表1 NCI-H1688细胞和HBE细胞中Frat2蛋白和mRNA表达水平

Lane 1:NCI-H1688 cells;Lane 2:HBE cells.
2.2 Frat2-siRNA转染效果与空白对照组和阴性对照组比较,Frat2-siRNA组NCI-H1688细胞中Frat2蛋白和mRNA表达水平明显升高(P<0.05);与空白对照组比较,阴性对照组NCI-H1688细胞中Frat2蛋白和mRNA表达水平差异无统计学意义(P>0.05)。见表2和图2。
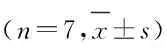
表2 各组NCI-H1688细胞中Frat2蛋白和mRNA表达水平
2.3 各组NCI-H1688细胞增殖活性细胞培养24 h时,各组细胞增殖活性比较差异无统计学意义(P>0.05)。细胞培养48和72 h时,与空白对照组和阴性对照组比较,Frat2-siRNA组和Frat2-siRNA+XAV组细胞增殖活性降低(P<0.05);与Frat2-siRNA组比较,Frat2-siRNA+XAV组细胞增殖活性降低(P<0.05);与空白对照组比较,阴性对照组细胞增殖活性差异无统计学意义(P>0.05)。见表3。
2.4 各组不同细胞周期NCI-H1688细胞百分率与空白对照组和阴性对照组比较,Frat2-siRNA组和Frat2-siRNA+XAV组细胞中G0/G1期细胞百分率明显升高(P<0.05),S期和G2/M期细胞细胞百分率明显降低(P<0.05);与Frat2-siRNA组比较,Frat2-siRNA+XAV组细胞中G0/G1期细胞百分率升高(P<0.05),S期和G2/M期 细胞百分率降低(P<0.05);与空白对照组比较,阴性对照组不同周期细胞百分率差异无统计学意义(P>0.05)。见表4和图3。
2.5 各组NCI-H1688细胞中PCNA、c-myc和Cyclin D1蛋白表达水平与空白对照组和阴性对照组比较,Frat2-siRNA组和Frat2-siRNA+XAV组细胞中PCNA、c-myc和Cyclin D1蛋白表达水平明显降低(P<0.05);与Frat2-siRNA组比较,Frat2-siRNA+XAV组细胞中PCNA、c-myc和Cyclin D1蛋白表达水平进一步降低(P<0.05);与空白对照组比较,阴性对照组细胞中PCNA、c-myc 和Cyclin D1蛋白表达水平差异无统计学意义(P>0.05)。见表5和图4。
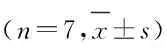
表3 各组NCI-H1688细胞增殖活性
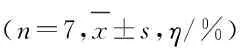
表4 各组不同细胞周期NCI-H1688细胞百分率
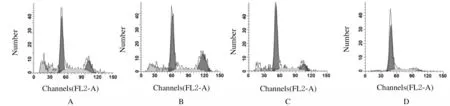
A: Blank control group;B: Negative control group; C:Frat2-siRNA group; D:Frat2-siRNA+XAV group.
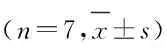
表5 各组NCI-H1688细胞中PCNA、c-myc和Cyclin D1蛋白表达水平

Lane 1:Blank control group;Lane 2:Negative control group; Lane 3:Frat2-siRNA group; Lane 4:Frat2-siRNA+XAV group.
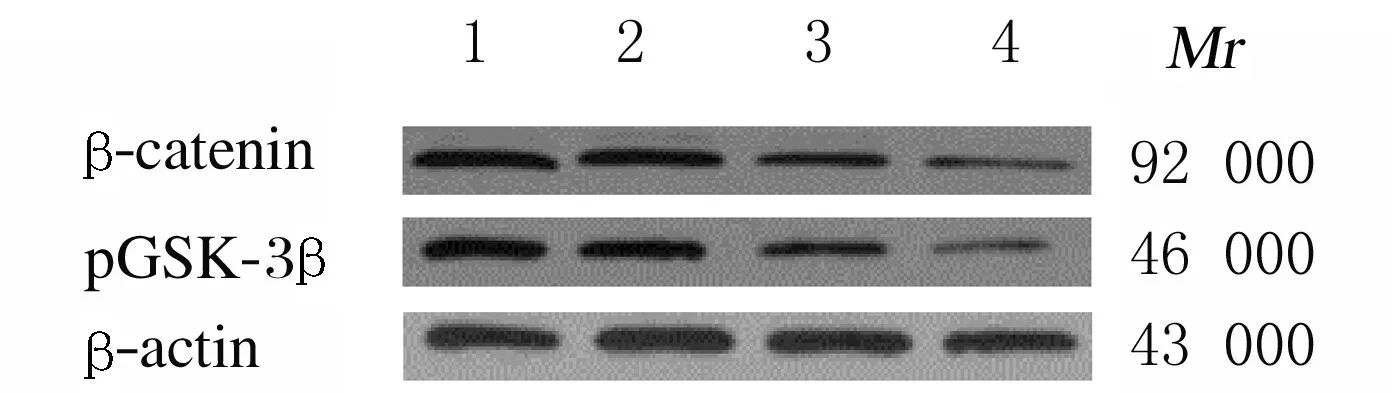
2.6 各组NCI-H1688细胞中β-catenin和pGSK-3β蛋白表达水平与空白对照组和阴性对照组比较,Frat2-siRNA组和Frat2-siRNA+XAV组细胞中β-catenin和pGSK-3β蛋白表达水平明显降低(P<0.05);与Frat2-siRNA组比较, Frat2-siRNA+XAV组细胞中β-catenin和pGSK-3β蛋白表达水平明显降低(P<0.05);与空白对照组比较,阴性对照组细胞中β-catenin和pGSK-3β蛋白表达水平差异无统计学意义(P>0.05)。见表6和图5。
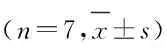
表6 各组NCI-H1688细胞中β-catenin和pGSK-3β蛋白表达水平
3 讨 论
小细胞肺癌虽占全部肺癌的比例较少,但其发展快,恶性程度高,在早期可发生远处转移,大部分患者确诊时已有血行或淋巴转移,自然病程比较短;小细胞肺癌虽对放化疗比较敏感,但大部分患者治疗后可出现复发和转移[6]。因此探讨小细胞肺癌的发生发展机制,对小细胞肺癌的诊断及治疗具有重要意义。Frat位于第10号染色体长臂上,其主要功能是与GSK3结合,抑制GSK3对β-catenin的磷酸化,在wnt信号转导通路中起正向调节作用。Frat包括Frat1和Frat2,Frat1由279个氨基酸构成,相对分子质量为29 000;Frat2由233个氨基酸构成,相对分子质量为24 000。Frat1和Frat2有77%的氨基酸构成相同,与GSK-3β结合区的氨基酸全部相同;Frat1和Frat2均为Wnt信号通路的正向调节因子[7]。目前关于Frat1在恶性肿瘤中作用的研究较多,如MiR-34a-3p靶向Frat1可改变脑膜瘤细胞的增殖和凋亡[8];Frat1过表达可调节结肠癌细胞的增殖[9];沉默Frat1可抑制SGC7901人胃腺癌细胞增殖[10];敲低Frat1可通过抑制肝细胞癌细胞中的Wnt /β-catenin信号通路抑制缺氧诱导的上皮-间质转化[11];沉默Frat1基因可通过下调β-catenin表达影响结肠癌HT-29细胞增殖和凋亡[12];Frat1参与了前列腺癌的发生发展过程[13]。关于Frat2的研究较少,STOOTHOFF 等[14]研究发现:Frat2与GSK-3β结合导致底物发生磷酸化从而发挥生物学效应。但Frat2在肺癌中的作用尚不清楚。本研究结果显示:沉默Frat2后NCI-H1688细胞中Frat2表达水平降低,NCI-H1688细胞增殖活性降低,表明Frat2可能参与小细胞肺癌的发生发展过程。
Lane 1:Blank control group;Lane 2:Negative control group; Lane 3:Frat2-siRNA group; Lane 4:Frat2-siRNA+XAV group.
PCNA是DNA复制过程中所必需的蛋白,相对分子质量为36 000,在细胞核中合成,在G0/G1期细胞中表达不明显,在G1晚期细胞中表达水平增加,S期细胞中表达水平达高峰,G2/M期细胞中表达水平明显降低,与DNA的变化一致,是细胞增殖状态的标志物之一[15-16]。c-myc为myc家族成员,既是一种可易位基因,也是一种可调节基因,可使细胞获得永生化功能,使细胞无限增殖,促进细胞分裂,可决定细胞周期能否从G0/G1期向S期过渡,是一种细胞恶性的标志物之一,与恶性肿瘤细胞的恶性增殖关系密切[17-18]。Cyclin D1为G1/S期特异性周期蛋白D1,属于高度保守的细胞周期家族成员之一,主要功能为促进细胞增殖,其作用在于作为细胞周期蛋白依赖性激酶的调控者,结合并激活G1期细胞特有的周期蛋白依赖性激酶CDK4,磷酸化G1期周期抑制蛋白,使其从所结合的E2F上解离,推动细胞周期从G1期进入S期[19-20]。本研究结果显示:沉默Frat2后NCI-H1688细胞中PCNA、c-myc和Cyclin D1蛋白表达水平降低,表明沉默Frat2可通过阻止G1期细胞向S期过渡进而抑制NCI-H1688细胞的增殖。
Wnt信号通路在恶性肿瘤细胞增殖中发挥重要作用,在肺癌的发生发展中也发挥重要作用。β-catenin为Wnt信号通路的关键调控因子,Wnt信号通路在正常成熟细胞中处于关闭状态,在病理状态下,Wnt信号通路被激活,β-catenin去磷酸化,进入细胞核与T细胞因子(T cell factor,TCF)/淋巴增强因子(lymphoid enhancer factor,LEF)结合开启下游的PCNA、c-myc和Cyclin D1等靶基因的转录,从而抑制恶性肿瘤细胞的增殖[21-22]。pGSK-3β是Wnt通路的关键调节因子,通过影响β-catenin参与调控细胞增殖和凋亡;经典Wnt通路激活后抑制由GSK-3β和轴蛋白等组成的复合体中的GSK-3β磷酸化,避免β-catenin被泛素蛋白酶体识别及降解,并与TCF/LEF结合导致细胞增殖异常,从而促进恶性肿瘤发生发展[23-24]。Wnt/β-catenin信号通路在肺癌细胞的增殖中发挥重要作用,且位于Frat2和Frat1与GSK-3β结合区的氨基酸全部相同,Frat2也可与GSK-3β结合发挥作用,进而调节Wnt信号通路,因此推测Frat2可能通过Wnt/β-catenin信号通路影响小细胞肺癌细胞的增殖。本研究结果显示:沉默Frat2后NCI-H1688细胞中β-catenin和pGSK-3β蛋白表达水平降低;对NCI-H1688细胞给予Wnt信号通路抑制剂XAV939后,NCI-H1688细胞的增殖能力降低,细胞被阻止在G0/G1期,细胞中PCNA、c-myc、Cyclin D1、β-catenin和pGSK-3β蛋白水平降低,表明沉默Frat2及给予Wnt信号通路抑制剂处理均可抑制小细胞肺癌细胞增殖、阻止细胞周期进程、抑制Wnt/β-catenin信号通路激活。由此可见Frat2可能通过Wnt/β-catenin信号通路抑制NCI-H1688细胞增殖。
综上所述,Frat2在小细胞肺癌NCI-H1688细胞中高表达,沉默Frat2可通过Wnt/β-catenin信号通路抑制NCI-H1688细胞增殖。Frat2有望成为小细胞肺癌治疗的潜在靶点。
