以氢化锂或氢化镁为电动汽车能源的经济可行性分析*
2020-08-05郭洪范
鲁 东,郭洪范
(1.宁夏东方钽业股份有限公司,宁夏 石嘴山 753000;2.沈阳化工大学化学工程学院,辽宁 沈阳 110142)
新能源汽车的发展方向分为混合动力和纯电模式两种。但锂离子电池目前由于受能量密度、循环次数等所限,以及回收率低等缺陷,使得锂离子电池综合成本高、续航能力有限,无法大规模推广。氢能作为一种清洁、高效、安全、可再生的二次能源,具有无污染、燃烧值高、来源广泛的优势。氢可通过一次能源、二次能源及工业领域等多种途径获取,能广泛应用于工业、建筑、交通和电力行业,是未来构建以清洁能源为主的多元能源供给系统的重要载体。
中国发展氢能的优势在于具有良好的制氢基础与大规模的应用市场。我国现有工业制氢产能已达到2.5×107t/a。2018年中国弃风、弃光、弃水总电量约为1.0229×1011kW·h,国内化工行业还存在部分无法循环利用的副产氢,均可作为大规模的氢源。同时,中国拥有全世界最大的能源汽车消费市场,除民用车外,矿山港口重型车、物流车、重柴油车、轨道交通、船舶及岸电设施,甚至航空器,这些都是未来氢能革新应用的方向,中国已具备大规模氢能利用的供氢条件与市场空间。
目前,氢能源汽车的氢源主要来源于压缩氢气,但储氢压力高达35~70 MPa[1],具有安全隐患高的缺点。水制氢气也是目前研发的热点。
氢化锂、氢化镁和硼氢化锂等是重要的储氢材料,可作为汽车潜在的动力氢源原料。氢化锂常温下较为稳定,与水反应迅速,生成的氢氧化锂可与盐酸反应,生成氯化锂,氯化锂电解生成金属锂和氯气,氯气与氢气反应生成氯化氢,金属锂与氢气反应生成氢化锂,这样形成了一个闭路循环。氢化镁与氢化锂性质相同,也可以形成闭路循环。
本文主要论述氢化锂及氢化镁在循环过程中的能量消耗问题,为其作为汽车的动力发展提供理论依据。
1 氢化锂(镁)和金属锂(镁)的性质及制备
氢化锂(LiH)为锂的氢化物,相对分子质量为7.95,密度为0.82 g/cm3,熔点很高,为680 ℃,且对热稳定,沸点为850 ℃。氢化锂属于类盐氢化物,无色晶体,一般由于带有杂质而呈灰色,不溶于苯、甲苯,溶于醚,具有氢密度高和质量密度低的双重优点,因可作为潜在的固体储氢材料而备受关注,甚至可直接用作火箭推进剂。
氢化锂可由熔融锂与氢化合而得,其化学反应方程式为
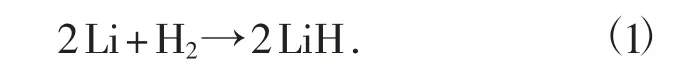
制备氢化锂的具体步骤为:在干燥箱中把金属锂放入由不锈钢制成反应管中,加盖并抽真空,在1 个标准大气压和725 ℃环境条件下通入氢气,保持15 h 后,然后在保持通氢的情况下冷却至室温,从干燥箱中取出产物,装入氮封的瓶里,保存于暗处。由纯净的金属锂和纯净的氢气可以制得纯度为99.8%的氢化锂。
熔盐电解法是金属锂的传统制备技术[2],目前90%以上的金属锂通过这种方法制备。工业上采用石墨阳极和低碳钢阴极,以熔融的LiCl-KCl 为电解质,在直流电作用下,阳极产生氯气,阴极产生锂。其中KCl 为支持撑电解质,起稳定和降低熔点的作用。
以氯化镁为原料,采用电解方法制得金属镁,工艺较为成熟,此处不再详述。
氢化镁(MgH2)为灰白色粉末,单一轻金属氢化物,常温常压下稳定性较高,密度为1.45 g/cm3,储氢量为7.6%,远高于镁基储氢合金氢化物和其他金属氢化物。
氢化镁的制备需要在一定的压强下由金属镁与氢气反应完成,金属镁的表面氧化膜会影响产品收率,制备条件较为苛刻。
2 以氢化锂或氢化镁为能源的电动汽车原理设计
图1 为以镁或锂为储氢材料汽车的工艺循环图,设计原理是使用氢化锂或氢化镁为氢源,为燃料电池或内燃机提供氢能。生成的氢氧化锂或氢氧化镁与盐酸反应生成氯化锂或氯化镁,过滤、烘干。然后将其加入至电解槽中进行电解,生成氯气、金属锂或镁。金属锂或镁与氢气反应,生成氢化锂或氢化镁。氯气与氢气反应生产氯化氢后制备盐酸。整个系统达到闭路循环,最终产物为水。
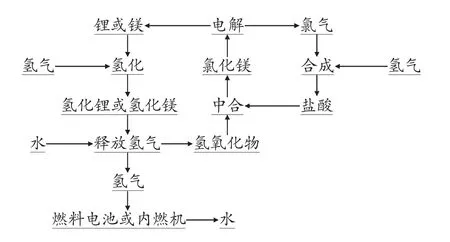
图1 以镁或锂为储氢材料汽车的工艺循环图
2.1 以氢化锂为氢源计算
2.1.1 燃料电池为动力
以车载50 kg 氢化锂作为基准,理论上可提供氢气约12.5 kg。以日本丰田FCHV-adv 汽车为例[3],该汽车储气罐容积为156 L,氢气的充填压力约为700 个大气压(70 MPa),质量为9.75 kg。该车充一次氢气可续航700 km,最大续航里程为830 km。所以以氢化锂为能源的汽车理论上可提供汽车行驶的里程约900 km,最大续航里程为1060 km。
50 kg 的氢化锂制备氢气,可以生成150.75 kg的氢氧化锂。回收时需要使用229.84 kg 氯化氢(即638.45 kg 的36%的盐酸),生成267.24 kg 的氯化锂。氢化锂制备氢气反应方程式为
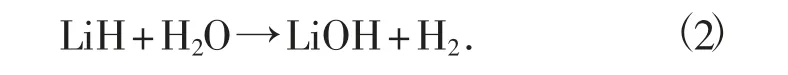
电解267.24kg 的氯化锂可生成约43.7 kg 的金属锂,产生约223.54 kg 的氯气,见电极反应方程(3)和方程(4)。利用氯气制备氯化氢需要氢气6.297 kg,可生成229.84 kg 氯化氢,即36%的盐酸638.45 kg。电极反应方程式分别为
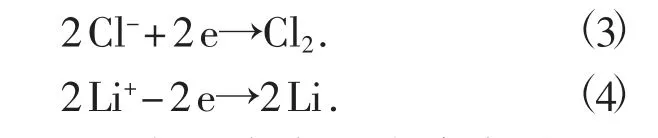
将43.7 kg 的金属锂加入氢气,制备氢化锂,需要6.297 kg 氢气。由于氢化锂制备过程中需要升温、加热,但氢化锂的制备过程本身也是放热过程,结合本系统内的其他反应过程也均为放热反应,可以提供这个反应所需的高温条件,因此在计算时可以忽略[4-8]。
2.1.2 内燃机为动力
孙柏刚等[7]计算了氢内燃机车的成本。经过计算,该汽车百公里可消耗氢气16.85 m3。以50 kg氢化锂可以产生氢气12.5 kg 计算,理论上可以行驶830.86 km。
2.2 以氢化镁为氢源计算
2.2.1 燃料电池为动力
以车载100 kg 氢化镁小型汽车作基准,理论上可提供氢气约15.2 kg,可供汽车行驶约1091 km,最大续航里程为1295 km。
用100 kg 氢化镁制备氢气,可生成221.67 kg的氢氧化镁,见方程式(5)。
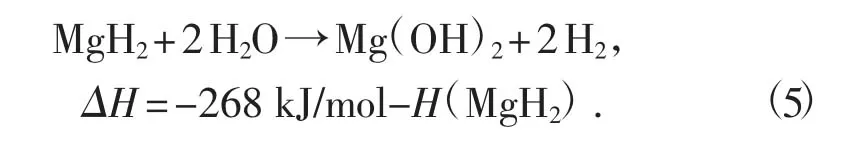
回收时需要使用277.57 kg 氯化氢,生成36%的盐酸约771 kg,氯化镁362.35 kg。
电解362.35 kg 的氯化镁可生成约92.40 kg 的金属镁,产生约269.95 kg 的氯气,见方程式(6)和(7)。利用氯气制备氯化氢需要氢气7.6 kg,生成277.57 kg 氯化氢,约771 kg 的36%的盐酸。
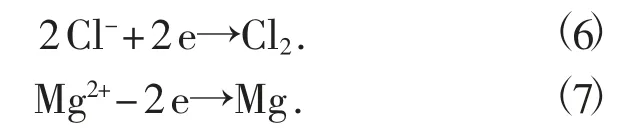
用92.40 kg 的金属镁加入氢气制备氢化镁,需要7.6 kg 氢气。与氢化锂的制备过程类似,氢化镁制备过程中同样需要高温、加热。结合本系统内的其他放热反应,也可以满足这个反应的高温条件,因此在计算时可以忽略。
2.2.2 内燃机为动力
孙柏刚等[7]计算了氢内燃机车的成本。经过计算,汽车的百公里气耗为16.85 m3。以氢化镁为能源,理论上可产生氢气15.2 kg 计算,可供汽车行驶约1010 km。
3 以氢化锂或氢化镁为能源的成本计算
3.1 氢化锂为氢源计算
电解267.24 kg 的氯化锂可生成约43.7 kg 的金属锂,而生产每千克金属锂用电量约38.62 kW·h[4],故需用电1687.7 kW·h。
据陈俏俏[5]的计算,制备1 kg 氢气约需9.933~12.564 元。工业用电平均价格约为0.3 元/kW·h。计算可得生产50 kg 氢化锂所需氢气的成本约为126~150 元,电力成本约为506 元,合计为632~656 元。以行驶900 km 计算,汽车行驶每百千米的能源成本约为70.2~72 元,内燃机汽车行驶每百千米的能源成本约为76.1~78 元。
以氢化锂为氢源,工业化生产势必需要大量的锂资源。目前中国汽车保有量为2.4 亿辆,如果每辆汽车都采用氢化锂为氢源,以每辆汽车平均使用100 kg 金属锂计算,大概需要2400 万t 金属锂,这个量约是目前整个锂资源探明储量的60%。世界范围汽车保有量更大,严重超过了锂资源的总量。
3.2 氢化镁为氢源计算
由于没有制备氢化镁的热力学数据,因此没有计算氢化镁的能源消耗。但其消耗的能源可以使用电解氯化镁,或氢气与氯气反应时放出的热量进行补偿。
生产每千克金属镁需要综合能耗3.63 kg 标煤[6]。电解362.35 kg 的氯化镁生成约92.40 kg 的金属镁,需要使用335.4 kg 标煤。以标煤400 元/t 计算,价值约134.2 元。
根据上述计算,以制备1 kg 氢气需花费9.933~12.564 元为依据,生产100 kg 氢化镁的氢气成本约151~191 元,煤炭成本约134.2 元,合计总成本约为285.2~325.2 元。以氢化镁为能源的汽车,理论上可产生氢气15.2 kg。这些氢气可提供燃料电池汽车行驶约1091 km,最大续航里程为1295 km。行驶每百千米的能源成本约25~26 元。内燃机汽车行驶每百千米的能源成本约24~25 元。
4 结论
本文根据化学反应方程式进行理想计算,忽略转化率及部分能耗损失,部分反应释放的能量作为其他反应的热量来源,例如金属氢化时可以放出热量[8],得到如下结论。
1)以氢化锂或氢化镁为氢源并作为燃料电池的能源,整个系统可以做到绿色循环。同样的材料也可以是氢密度较低的氢化钠、氢化钙和氢化钾。
2)工业化成本较高,主要成本来源于电解氯化锂或氯化镁时所耗费的电能。如果采用氢气直接还原氯化锂制备金属锂,成本可能会降低。
3)以氢化锂作为氢源需要大量锂资源,但锂资源有限,如果大量推广,存在锂资源短缺问题。
4)以氢化镁为储氢原料为燃料汽车提供氢源,理想计算,可以实现绿色循环,并且单位公里能耗较低。但氢化镁的制备较为困难,转化率及能耗需要继续改善。
5)氢化物与水反应生成氢气的转化率在本文中以100%计算,实际过程中转化率可能较低,但这不应作为氢化物不能作为汽车能源的主要问题。随着技术的不断进步,新的技术可能会攻破这一问题,未来可考虑将氢化物做成多孔状或溶解在惰性溶剂中与水反应,以增加转化率。可以考虑将不同的氢化物混合后进行反应,以调整反应速度。
