RNAi下调CCT8抑制非小细胞肺癌A549细胞转移潜能
2020-08-05朱迎伟褚旭邱家勇孙瑜霞毛毅敏
朱迎伟 褚旭 邱家勇 孙瑜霞 毛毅敏
肺癌大多数起源于支气管黏膜上皮,是最为常见的肺组织原发恶性肿瘤,肺癌中有80%的患者属于非小细胞肺癌,研究非小细胞肺癌发生机制对于靶向基因治疗肺癌具有重要意义[1]。含有TCP1伴侣蛋白亚基8(Chaperonin containing TCP1,subunit 8,CCT8)是一种在生命体内存在的分子伴侣,参与DNA复制、多肽折叠、细胞信号转导、蛋白降解等过程,CCT8属于Ⅱ型伴侣素,参与肿瘤进展[2]。研究报道显示,CCT8在肿瘤中表达上调,并且其表达改变与肿瘤患者的预后、转移等有关[3]。在胶质瘤中的研究表明,CCT8在胶质瘤中高表达与胶质瘤分级有关,沉默CCT8可以有效抑制胶质瘤细胞的增殖和侵袭[4]。以前的研究报道显示,CCT8在非小细胞肺癌组织中高表达,并且其表达水平同肺癌患者淋巴结转移、预后、组织学分级等有关[5]。目前对于CCT8对非小细胞肺癌细胞侵袭、迁移和上皮间质转化(Epithelial-mesenchymal transition,EMT)的作用还不明确。本次实验以非小细胞肺癌A549细胞作为体外实验对象,探讨下调CCT8对细胞增殖和恶性转移潜能的影响,以期为寻找有效的靶基因治疗肺癌提供资料。
1 材料与方法
1.1 材料
非小细胞肺癌A549细胞购自上海信裕生物科技有限公司;Lipofectamine 2000、RNA提取试剂盒、反转录试剂盒、荧光定量PCR试剂盒购自美国Invitrogen;蛋白提取试剂盒、二辛可宁酸(BCA)试剂盒、十二烷基硫酸钠,钠盐-聚丙烯酰胺凝胶电泳(dodecyl sulfate,sodium salt-Polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒、四甲基偶氮唑盐(MTT)试剂盒购自上海碧云天生物技术有限公司;Vimentin抗体和p-Akt抗体购自美国santacruze;CCT8抗体购自美国Proteintech;E-cadherin抗体、MMP-9抗体购自北京义翘神州科技有限公司;siRNA control、CCT8 siRNA由南京金斯瑞生物科技有限公司设计合成。
1.2 细胞转染
A549细胞分成3组,分别为Control、si-NC、si-CCT8组,si-NC、si-CCT8组分别为转染siRNA control、CCT8 siRNA的A549细胞,Control为不做转染的对照A549细胞。A549细胞转染方法按照转染试剂Lipofectamine 2000进行,步骤完全按照操作说明书标准流程操作。
1.3 Realtime PCR方法检测CCT8 siRNA对CCT8 mRNA表达影响
收集转染48 h以后的Control、si-NC、si-CCT8组细胞,用RNA提取试剂盒提取总RNA,用反转录试剂盒合成cDNA,按照试剂盒说明书操作进行PCR反应。按照2-ΔΔCT法分析CCT8水平。
1.4 Western blot方法检测CCT8 siRNA对CCT8蛋白表达影响
收集转染48 h以后的Control、si-NC、si-CCT8组细胞,按蛋白提取试剂盒提取总蛋白,以BCA方法定量。具体方法参考文献[2],CCT8蛋白水平=CCT8条带灰度值÷内参GAPDH灰度值
1.5 MTT检测检测CCT8 siRNA对细胞增殖影响
取Control、si-NC、si-CCT8组培养48 h的细胞。按照MTT试剂盒说明书进行检测细胞增殖。
1.6 Transwell小室检测CCT8 siRNA对细胞侵袭和迁移影响
用不含血清的培养液悬浮Control、si-NC、si-CCT8组细胞,按照参考文献[2]方法检测细胞侵袭和迁移数量。
1.7 Western blot检测CCT8 siRNA对MMP-9、Vimentin、E-cadherin和p-Akt蛋白表达影响
收集转染48 h以后的Control、si-NC、si-CCT8组细胞,按照1.4中方法检测蛋白表达变化,内参为GAPDH。
1.8 Akt信号激活剂对下调CCT8影响细胞增殖、迁移、侵袭和EMT的影响
取转染CCT8 siRNA后的A549细胞,以含有100 ng/mL的Akt激活剂IGF-1的细胞培养液培养,记为si-CCT8+IGF-1,以si-CCT8作为对照,分别按照1.4、1.5、1.6中的方法分别检测MMP-9、Vimentin、E-cadherin和p-Akt蛋白表达,细胞迁移和侵袭,细胞增殖。
1.9 统计分析
采用SPSS 21.0软件统计分析,计量资料用()表示,两组数据用独立样本t检验,多组比较用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 CCT8siRNA下调A549细胞中CCT8表达水平
与si-NC组相比,转染CCT8 siRNA后A549细胞中CCT8mRNA和蛋白水平均下降差异有统计学意义(P<0.05),见图1和表1。
2.2 下调CCT8对A549细胞增殖、侵袭、迁移影响
与si-NC组相比,转染CCT8 siRNA后A549细胞中细胞A值、侵袭数目和迁移数目均下降(P<0.05),见表2。
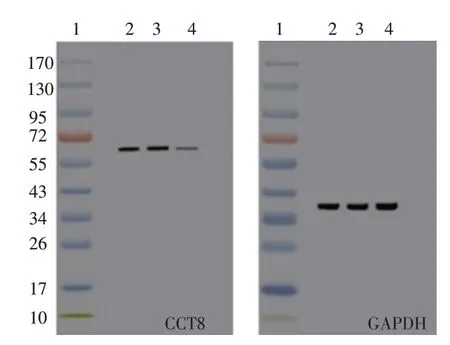
图1 Western blot检测CCT8 siRNA转染后A549细胞中CCT8蛋白水平Figure 1 Western blot analysis expressions of CCT8 protein in A549 cells transfected with CCT8 siRNA
表1 CCT8 siRNA转染后A549细胞中CCT8 mRNA和蛋白水平(±s)Table 1 Expressions of CCT8 mRNA and protein in A549 cells transfected with CCT8 siRNA(±s)
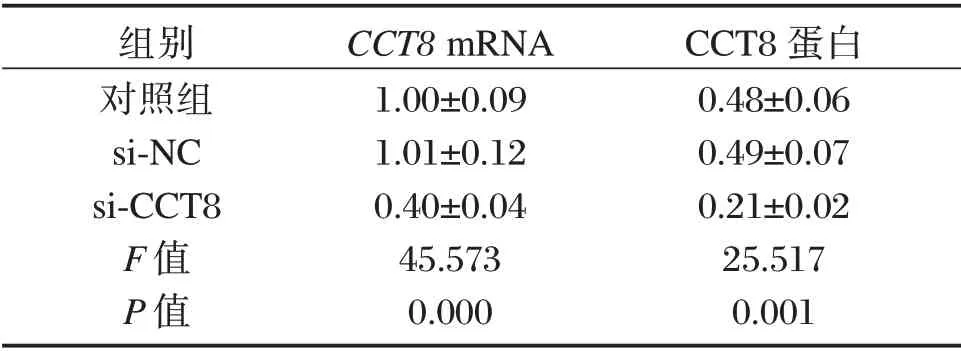
表1 CCT8 siRNA转染后A549细胞中CCT8 mRNA和蛋白水平(±s)Table 1 Expressions of CCT8 mRNA and protein in A549 cells transfected with CCT8 siRNA(±s)
组别对照组si-NC si-CCT8 F值P值CCT8 mRNA 1.00±0.09 1.01±0.12 0.40±0.04 45.573 0.000 CCT8蛋白0.48±0.06 0.49±0.07 0.21±0.02 25.517 0.001
表2 CCT8 siRNA转染后A549细胞A值、侵袭数目和迁移数目(±s)Table 2 A value,number of invasion and number of migration in A549 cells transfected with CCT8 siRNA(±s)

表2 CCT8 siRNA转染后A549细胞A值、侵袭数目和迁移数目(±s)Table 2 A value,number of invasion and number of migration in A549 cells transfected with CCT8 siRNA(±s)
组别对照组si-NC si-CCT8 F值P值A值0.51±0.06 0.50±0.04 0.21±0.03 42.836 0.000侵袭数目95.54±10.20 97.36±9.87 60.17±2.05 19.237 0.003迁移数目138.64±12.02 140.08±11.49 86.95±7.53 24.745 0.000
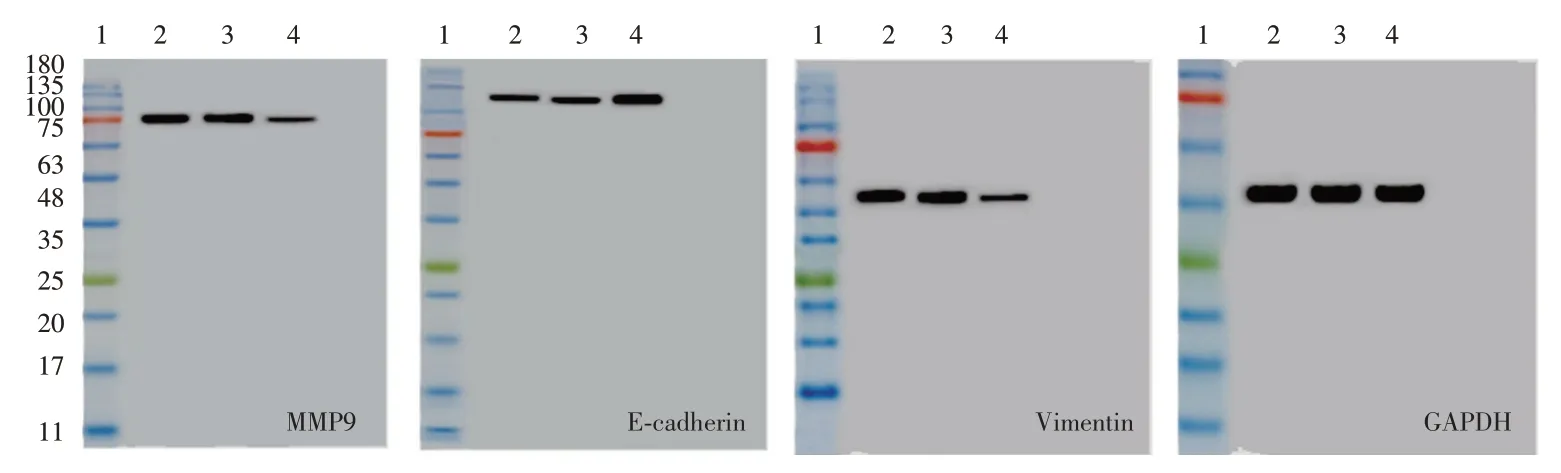
图2 Western blot检测CCT8 siRNA转染后A549细胞中MMP-9和Vimentin、E-cadherin蛋白水平Figure 2 Western blot analysis expressions of MMP-9,Vimentin and E-cadherin protein in A549 cells transfected with CCT8 siRNA
2.3 下调CCT8对A549细胞MMP-9蛋白和EMT相关蛋白表达影响
与si-NC组相比,转染CCT8 siRNA后A549细胞中MMP-9蛋白水平降低上皮标志蛋白E-cadherin水平升高,间质标志蛋白Vimentin P-kAT水平下降(P<0.05),表3和见图2。
表3 CCT8 siRNA转染后A549细胞中MMP-9和Vimentin、E-cadherin、p-Akt水平(±s)Table 3 Expressions of MMP-9,Vimentin and E-cadherin、p-Akt in A549 cells transfected with CCT8 siRNA(±s)
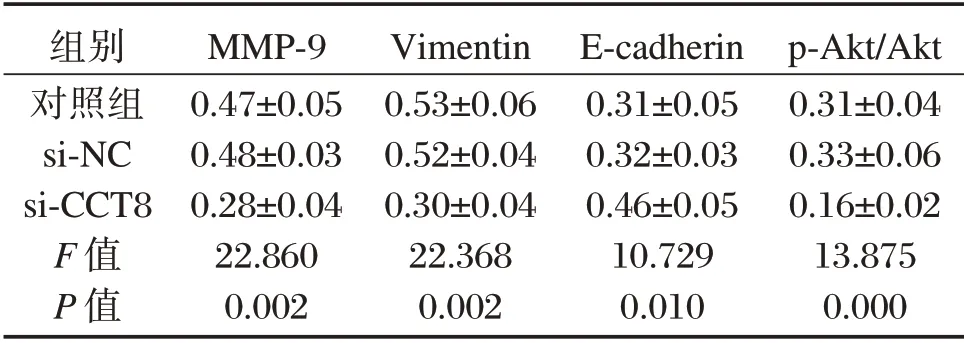
表3 CCT8 siRNA转染后A549细胞中MMP-9和Vimentin、E-cadherin、p-Akt水平(±s)Table 3 Expressions of MMP-9,Vimentin and E-cadherin、p-Akt in A549 cells transfected with CCT8 siRNA(±s)
注:与si-NC比较,a P<0.05。
组别对照组si-NC si-CCT8 F值P值MMP-9 0.47±0.05 0.48±0.03 0.28±0.04 22.860 0.002 Vimentin 0.53±0.06 0.52±0.04 0.30±0.04 22.368 0.002 E-cadherin 0.31±0.05 0.32±0.03 0.46±0.05 10.729 0.010 p-Akt/Akt 0.31±0.04 0.33±0.06 0.16±0.02 13.875 0.000
2.4 下调CCT8对A549细胞中Akt信号通路影响
与si-NC组相比,转染CCT8 siRNA后A549细胞中p-Akt蛋白水平降低(P<0.05),见图3。
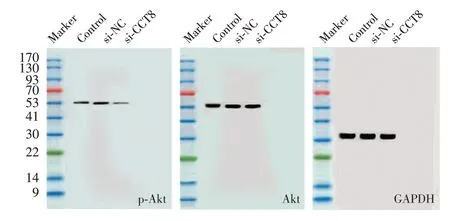
图3 Western blot检测CCT8 siRNA转染后A549细胞中p-Akt蛋白水平Figure 3 Western blot analysis expressions of p-Akt protein in A549 cells transfected with CCT8 siRNA
2.5 Akt信号激活剂对下调CCT8抑制A549细胞增殖、侵袭、迁移和EMT的逆转作用
Akt信号激活剂IGF-1处理CCT8 siRNA转染后的A549细胞,与si-CCT8组相比,si-CCT8+IGF-1组细胞MMP-9、Vimentin蛋白水平升高,E-cadherin蛋白水平降低,细胞A值、侵袭数目和迁移数目升高(P<0.05),见图4和表4。
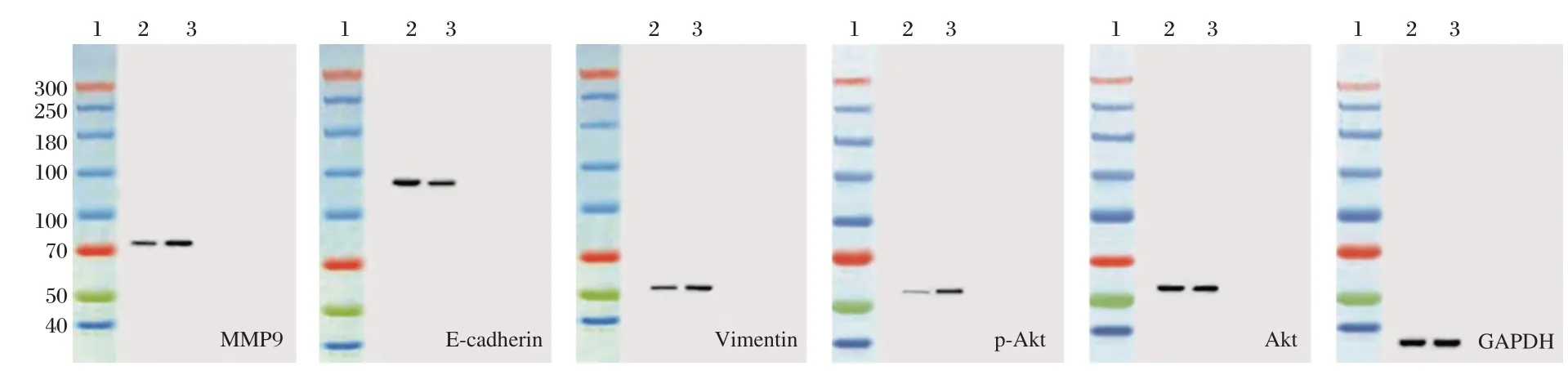
图4 Western blot检测Akt信号激活剂和CCT8 siRNA转染后A549细胞中p-Akt、E-cadherin、MMP-9、Vimentin蛋白水平Figure 4 Western blot analysis expressions of p-Akt,E-cadherin,MMP-9,Vimentin protein in A549 cells after Akt signaling activator and CCT8 siRNA transfection
表4 Akt信号激活剂和CCT8 siRNA转染后A549细胞A值、侵袭数目、迁移数目和p-Akt、E-cadherin、MMP-9、Vimentin蛋白水平(±s)Table 4 A value,invasion number,migration number and p-Akt,E-cadherin,MMP-9,Vimentin protein levels of A549 cells after Akt signaling activator and CCT8 siRNA transfection(±s)
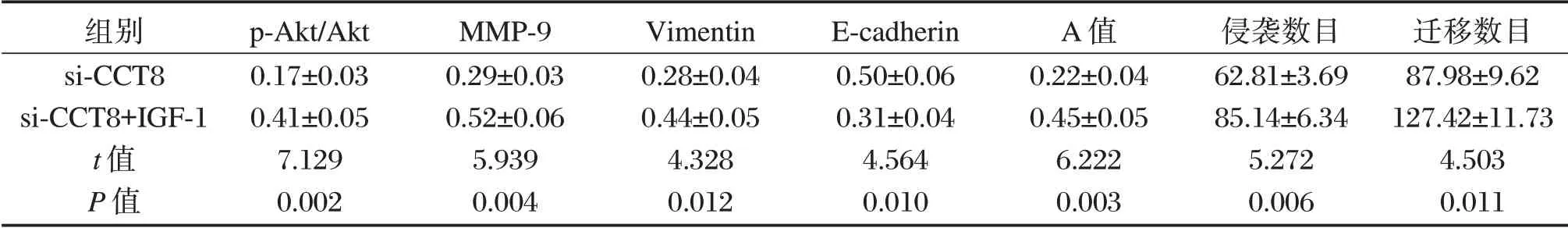
表4 Akt信号激活剂和CCT8 siRNA转染后A549细胞A值、侵袭数目、迁移数目和p-Akt、E-cadherin、MMP-9、Vimentin蛋白水平(±s)Table 4 A value,invasion number,migration number and p-Akt,E-cadherin,MMP-9,Vimentin protein levels of A549 cells after Akt signaling activator and CCT8 siRNA transfection(±s)
组别si-CCT8 si-CCT8+IGF-1 t值P值p-Akt/Akt 0.17±0.03 0.41±0.05 7.129 0.002 MMP-9 0.29±0.03 0.52±0.06 5.939 0.004 Vimentin 0.28±0.04 0.44±0.05 4.328 0.012 E-cadherin 0.50±0.06 0.31±0.04 4.564 0.010 A值0.22±0.04 0.45±0.05 6.222 0.003侵袭数目62.81±3.69 85.14±6.34 5.272 0.006迁移数目87.98±9.62 127.42±11.73 4.503 0.011
3 讨论
CCT8参与肿瘤进程,研究显示,CCT8在肝细胞癌中高表达,与预后不良有关,siRNA沉默CCT8抑制细胞增殖并阻断细胞进入S期[6]。在肝癌中发现下调CCT8可以降低肝癌细胞迁移和侵袭能力[7]。还有研究发现CCT8在淋巴结转移的食管鳞状细胞癌患者肿瘤组织中高表达,与患者预后不良和顺铂耐药性相关;敲低CCT8通过调节α-肌动蛋白和β-微管蛋白抑制食管鳞状细胞癌细胞的迁移和侵袭,促进细胞凋亡[8]。本实验表明,下调CCT8可以在体外抑制非小细胞肺癌细胞的增殖、迁移和侵袭,这与在肝癌、食管鳞状细胞癌中下调CCT8抑制癌细胞迁移和侵袭的作用相同。还有研究发现CCT8上调与成年大鼠创伤性脑损伤后神经细胞凋亡有关[9]。但本实验未研究CCT8对非小细胞肺癌细胞凋亡的影响。以上结果表明说明CCT8在癌症中可能作为一个肿瘤促进因子在起作用。本实验结果显示下调CCT8具有抑制非小细胞肺癌细胞恶性表型的作用,靶向抑制CCT8可能是有效抵抗非小细胞肺癌进展的途径。
基质金属蛋白酶9(Matrix metallo proteinase-9,MMP-9)是基质金属蛋白酶家族的成员,细胞外基质降解的关键酶[10]。而细胞外基质降解是肿瘤细胞转移的基础和前提条件[11]。有研究报道MMP-9在非小细胞肺癌中高表达,与肿瘤分期及淋巴结转移关系密切,且与癌细胞侵袭转移呈正相关[12]。还有研显示,非小细胞肺癌组织中E-钙黏蛋白(E-cadherin)低表达、波形蛋白(Vimentin)高表达,在肿瘤的侵袭和转移过程中起重要调控作用[13];E-cadherin和Vimentin是EMT水平改变的标志,EMT水平越高标志着肿瘤转移能力越强,有研究报道通过调节EMT可促进肺癌细胞侵袭和迁移能力[14]。本次实验结果表明,下调CCT8可以抑制MMP-9的表达,促进E-cadherin表达,并下调Vimentin表达水平。
综上,CCT8可能是非小细胞肺癌治疗的有效靶标,靶向抑制CCT8表达可以降低非小细胞肺癌细胞恶性增殖、迁移、侵袭和EMT,且CCT8作用机制与Akt信号有关。本实验结果为研究CCT8在肺癌中的作用机制提供了参考。在以后实验中会探讨CCT8具体的靶向结合位点和调控网络。
