体液免疫功能、血清sIL-6R水平和血沉的检测在儿童CA-MPP病情变化和疗效评估中的应用
2020-08-05陈建州吴云刚张辉
陈建州 吴云刚 张辉
在临床上,急性呼吸道感染疾病属于常见病、多发病,是全球儿童最常见的疾病之一,而肺炎支原体(mycoplasma pneumoniae,MP)则是引起儿童呼吸道感染的常见的病原体之一,被认为是引起社区获得性肺炎(community acquired pneumonia,CAP)的第3位病原体,其引起的支原体肺炎约占儿童社区获得性肺炎的10%~40%[1-4]。近年来,随着支原体肺炎在儿童当中的发病率有逐渐升高的趋势,越来越影响儿童的健康成长。感染支原体肺炎的儿童以顽固性剧烈咳嗽以及持续性或弛张性发热为主要表现,并且疾病具有易反复发作的特点,严重者可能因呼吸窘迫、中枢神经系统严重受累而引起死亡[5]。相关研究表明,在支原体肺炎的发病机制中,许多细胞因子都直接或者间接参与了免疫反应、炎性反应及免疫损伤,并且患儿发病后会存在不同的免疫功能紊乱情况[6]。血清sIL-6R是属于细胞因子家族当中的重要因子,在免疫调节中占有重要作用,而血沉在早期的炎性反应中会迅速升高,可作为反应炎症的敏感指标之一。研究支原体肺炎患儿体液免疫功能以及血清sIL-6R、血沉等相关指标对于早期评估病情具有重要意义。
1 资料与方法
1.1 一般资料
选取2018年1月至2019年6月本院收治的90例CA-MPP儿童作为研究对象,根据CPIS评分将研究对象分为两组,CPIS≥6分为CA-MPP重症组(n=46),CPIS<6分为CA-MPP普通组(n=44)。CA-MPP重症组中,男27例,女19例,年龄10个月~12岁,平均年龄(5.53±0.64)岁;CA-MPP普通组中,男23例,女21例,年龄1~12岁,平均年龄(5.48±0.71)岁;另选取同期来本院体检的健康儿童45例设为对照组,其中男22例,女23例,年龄1~11岁,平均年龄(5.61±0.93)岁。各组性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
纳入标准:患儿年龄13岁以下,病程不超过8 d,无激素治疗史,诊断符合《诸福棠实用儿科学(第8版)》中MPP诊断标准[7];X线表现为支气管肺炎、大叶性肺炎或间质性肺炎改变;白细胞数大多正常或稍高,血沉多增快,Coombs试验阳性。排除标准:患儿有风湿性疾病、自身免疫病、严重器质性疾病或者合并细菌性、病毒性肺炎、肺结核、肺部肿瘤等。本研究经医院伦理委员会批准,获得患儿家属知情同意书。
1.2 方法
CA-MPP患儿于入院次日早晨、对照组儿童于体检当日均空腹状态下采集静脉血5 mL,经3 000 r/min离心机离心5 min,取上层血清液于-80℃冰箱内保存。散射比浊法测定各组IgA、IgG、IgM以及C3、C4水平;ELISA法检测IL-6、sIL-6R、TNF-α水平;全自动生化分析仪测定ESR水平。患儿均给予抗菌药物治疗,CA-MPP普通组单用阿奇霉素,10 mg/kg,口服1次/d,治疗1~2个疗程(3 d为1疗程、停药4d);CA-MPP重症组给予阿奇霉素-阿奇霉素序贯治疗辅以地塞米松静脉滴注,先予静脉滴注阿奇霉素,10 mg/kg,1次/d,治疗2~4个疗程(5 d为1疗程、停药4d),并辅以静脉滴注地塞米松,1~2 mg/kg,1次/d,连用3 d,病情好转后予阿奇霉素口服,1次/d,治疗2~4个疗程(3 d为1疗程、停药4 d),疗程结束后复查以上项目。
1.3 观察指标
治疗前CA-MPP儿童与对照组儿童血液学指标的比较;治疗前CA-MPP儿童血液学生化指标与病情的相关性分析;治疗前后CA-MPP儿童血液学指标的比较。
1.4 统计学方法
采用SPASS 20.0软件进行数据分析,计量资料采用()表示,两组间比较采用t检验,多组间比较采用单因素方差分析,Pearson相关性分析评价体液免疫功能、血清sIL-6R和血沉的水平与儿童CA-MPP病情严重程度的关系,P<0.05为差异有统计学意义。
2 结果
2.1 治疗前CA-MPP儿童血清血液学指标比较
治疗前,患儿IgA、IgG、IgM、C3、C4、IL-6、sIL-6R、TNF-α水平、ESR水平比较结果:CA-MPP重症组>普通组>对照组,差异有统计学意义(P<0.05)。见表1。
表1 治疗前CA-MPP儿童血清血液学指标比较(±s)Table 1 Comparison of serum hematological indexes of ca-mpp children before treatment(±s)
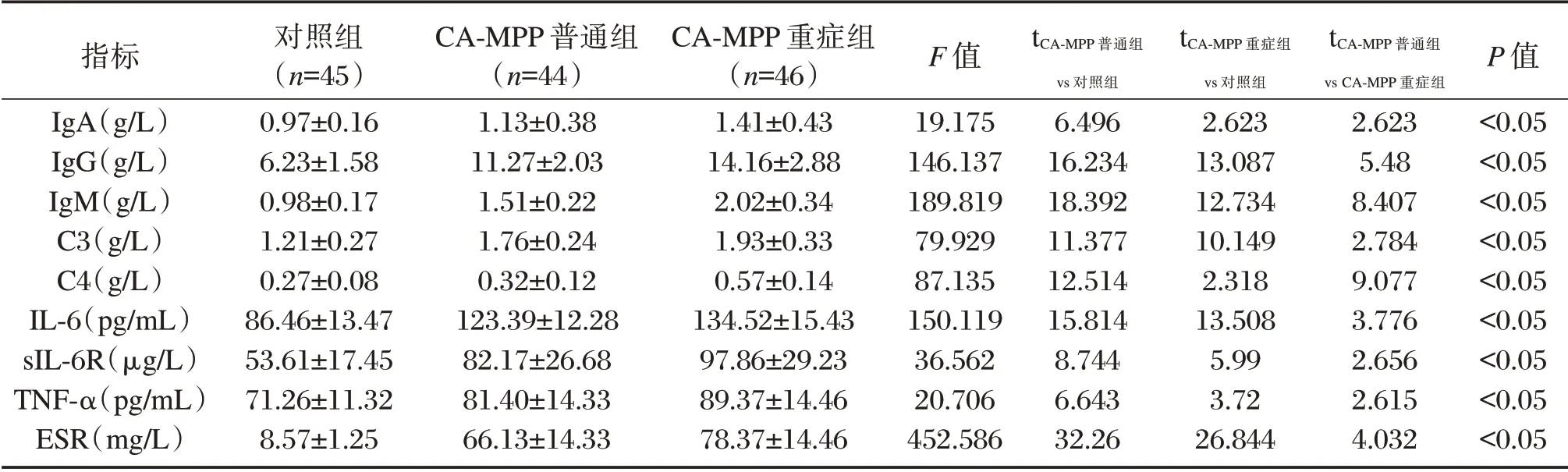
表1 治疗前CA-MPP儿童血清血液学指标比较(±s)Table 1 Comparison of serum hematological indexes of ca-mpp children before treatment(±s)
指标IgA(g/L)IgG(g/L)IgM(g/L)C3(g/L)C4(g/L)IL-6(pg/mL)sIL-6R(μg/L)TNF-α(pg/mL)ESR(mg/L)对照组(n=45)0.97±0.16 6.23±1.58 0.98±0.17 1.21±0.27 0.27±0.08 86.46±13.47 53.61±17.45 71.26±11.32 8.57±1.25 CA-MPP普通组(n=44)1.13±0.38 11.27±2.03 1.51±0.22 1.76±0.24 0.32±0.12 123.39±12.28 82.17±26.68 81.40±14.33 66.13±14.33 CA-MPP重症组(n=46)1.41±0.43 14.16±2.88 2.02±0.34 1.93±0.33 0.57±0.14 134.52±15.43 97.86±29.23 89.37±14.46 78.37±14.46 F值19.175 146.137 189.819 79.929 87.135 150.119 36.562 20.706 452.586 tCA-MPP普通组vs对照组6.496 16.234 18.392 11.377 12.514 15.814 8.744 6.643 32.26 tCA-MPP重症组vs对照组2.623 13.087 12.734 10.149 2.318 13.508 5.99 3.72 26.844 tCA-MPP普通组vs CA-MPP重症组2.623 5.48 8.407 2.784 9.077 3.776 2.656 2.615 4.032 P值<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05
2.2 治疗前CA-MPP儿童血液学生化指标与病情的相关性分析
Pearson相关性分析后发现,治疗前CA-MPP儿童体液免疫功能、血清sIL-6R和血沉的水平均与CA-MPP病情严重程度呈正相关(rIgA=0.43,rIgG=0.38,rIgM=0.52,rC3=0.34,rc4=0.46,rIL-6=0.51,rsIL-6R=0.48,rTNF-α=0.57,rESR=0.42;P均<0.05)。
2.3 治疗前后CA-MPP儿童的血液学生化指标的对比
重症与普通组CA-MPP儿童经过治疗后,血清IgA、IgG、IgM、C3、C4水平以及IL-6、sIL-6R、TNF-α、ESR水平均低于治疗前,差异有统计学意义(P<0.05);治疗后两组患儿血液学生化指标,无统计学差异(P>0.05)。见表2。
表2 治疗后46例重症ca-mpp儿童不同疗效的血清对比(±s)Table 2 serum comparison of 46 children with severe CA MPPafter treatment(±s)
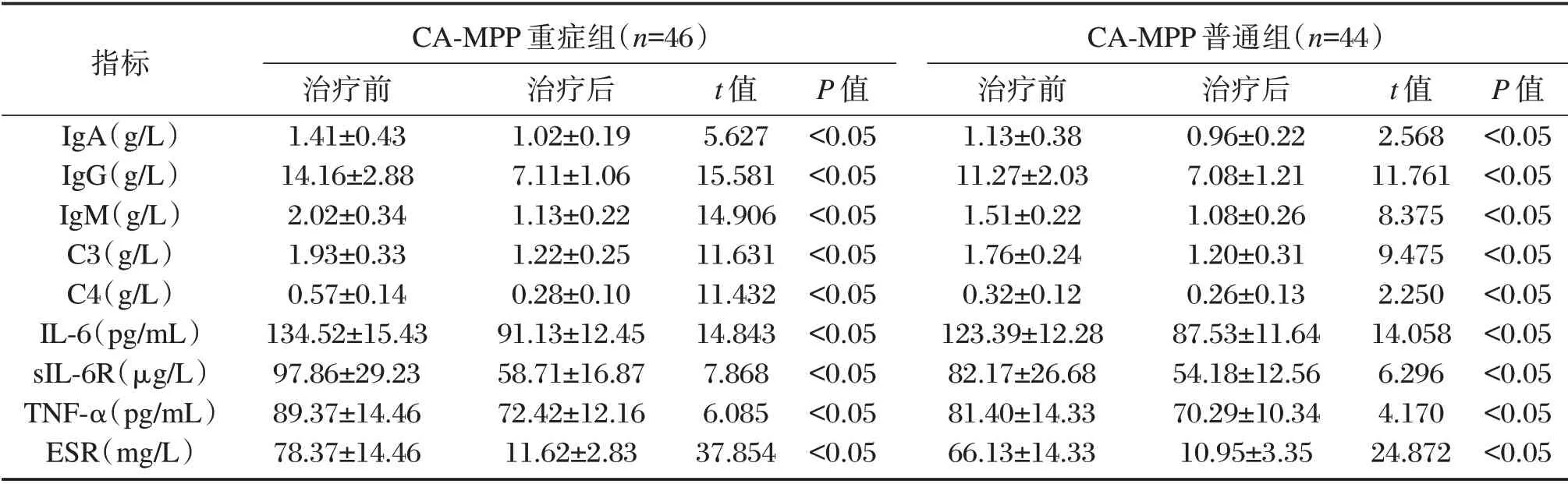
表2 治疗后46例重症ca-mpp儿童不同疗效的血清对比(±s)Table 2 serum comparison of 46 children with severe CA MPPafter treatment(±s)
指标IgA(g/L)IgG(g/L)IgM(g/L)C3(g/L)C4(g/L)IL-6(pg/mL)sIL-6R(μg/L)TNF-α(pg/mL)ESR(mg/L)CA-MPP重症组(n=46)治疗前1.41±0.43 14.16±2.88 2.02±0.34 1.93±0.33 0.57±0.14 134.52±15.43 97.86±29.23 89.37±14.46 78.37±14.46治疗后1.02±0.19 7.11±1.06 1.13±0.22 1.22±0.25 0.28±0.10 91.13±12.45 58.71±16.87 72.42±12.16 11.62±2.83 t值5.627 15.581 14.906 11.631 11.432 14.843 7.868 6.085 37.854 P值<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05 CA-MPP普通组(n=44)治疗前1.13±0.38 11.27±2.03 1.51±0.22 1.76±0.24 0.32±0.12 123.39±12.28 82.17±26.68 81.40±14.33 66.13±14.33治疗后0.96±0.22 7.08±1.21 1.08±0.26 1.20±0.31 0.26±0.13 87.53±11.64 54.18±12.56 70.29±10.34 10.95±3.35 t值2.568 11.761 8.375 9.475 2.250 14.058 6.296 4.170 24.872 P值<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05
3 讨论
肺炎支原体是一种介于病毒与细菌之间的无细胞壁的病原微生物,能引起人类感染支原体肺炎,近年来其发病率呈现低龄化趋势[8]。虽然支原体肺炎为轻型、自限性疾病,但儿童时期由于其机体防御能力尚不足,一旦感染易病情反复,发展为难治性支原体肺炎,若没有得到及时对症治疗,可能会引发一系列严重并发症,造成儿童发生多器官功能障碍综合征[9]。目前临床上关于支原体肺炎(MPP)的发病机制仍不十分明确,主要倾向于免疫学发病机制,与机体的体液免疫和细胞免疫有关[10]。
IgA、IgG及IgM是人体液免疫的重要参与因子,MP作为抗原进人体内刺激机体产生大量特异性抗体,可刺激B细胞活化分泌免疫球蛋白IgA、IgG及IgM,提呈抗原,介导病理免疫应答[11]。儿童在感染MP后,大约1~2周后可产生IgA、IgM。IgM可在3~4周内达到最大值,IgA作为黏膜防御体系重要成分,出现时间较IgM晚,但持续时间长。IgG出现时间相对较晚,在感染MP约5周可以达到最大值,随后一定时间内保持稳定水平[12]。有研究表明,CA-MPP患儿的IgA、IgG及IgM水平显著高于正常儿童[13],本研究中治疗前MPP儿童IgA、IgG、IgM水平高于正常对照组,重症组上述指标水平高于普通组。在机体感染MP后会产生交叉反应激活补体系统,导致血清中C3、C4水平升高,改变宿主抗原结构并形成免疫复合物,产生一系列并发症,引起组织或器官的多种病变,加重病情。本研究中治疗前MPP儿童C3、C4水平高于对照组,且病情越重C3、C4水平越高,提示MP感染后激活了补体系统,与韩晨鹏等[14]研究结果一致。IL-6是一种对体液免疫和细胞免疫均有调节作用的多功能细胞因子,在机体炎症反应、自身免疫中发挥重要作用,直接影响B细胞分泌免疫球蛋白过程。因此,在发生肺炎时血清IL-6水平会升高,而sIL-6R介导IL-6发挥生物学活化作用,参与机体的免疫应答和调节,也随之升高;TNF-α有双重生物学活性,参与机体免疫损伤过程,其水平的升高会促进炎症反应的发生,加重病情。ESR是反映炎症的一种非特异性指标,在早期的炎性反应中会迅速升高,可联合实验室其他检测指标提高肺炎早期诊断的敏感度。Pearson相关性分析后发现,体液免疫功能、血清sIL-6R和血沉的水平均与儿童CA-MPP病情严重程度呈正相关,且CA-MPP儿童在经过治疗后,治疗后重症与普通组CA-MPP儿童血清IgA、IgG、IgM、C3、C4水平以及IL-6、sIL-6R、TNF-α、ESR水平均低于治疗前,提示CA-MPP儿童经过治疗后,病情有所好转,表明上述指标可以对儿童CA-MPP病情及治疗疗效进行辅助评估。
综上所述,体液免疫功能、血清sIL-6R水平和血沉的检测能反映儿童CA-MPP病情变化情况,联合检测上述指标水平对于CA-MPP患儿的病情和疗效评估具有重要意义。
