下调lncRNA HCG18靶向调控miR-34a影响口腔鳞癌SCC4细胞增殖、侵袭以及迁移的分子机制
2020-08-05丁延晶王立新邱静怡余日月
丁延晶 王立新 邱静怡 余日月
长链非编码RNA(Long non-coding RNA,lncRNA)是一种长度大于200 nt的非编码RNA,其最初被人们认为没有生物学作用,后续研究发现,lncRNA参与调控基因印记、mRNA剪切、表观遗传学等过程,并且通过对基因多方面调控影响细胞的生长、转移[1]。研究表明,lncRNA与肿瘤的进展有关,其异常表达往往与肿瘤转移程度等具有密切关系[2]。lncRNA人类白细胞抗原复合体18(human leucocyte antigen complex group 18,HCG18)与多种疾病的病理进程有关[3]。HCG18在非小细胞肺癌等肿瘤中高表达,HCG18表达上调与肿瘤患者的预后和转移有关,下调HCG18可以抑制肿瘤的细胞恶性增殖和转移[4]。miR-34a是近些年来备受关注的miR-34家族成员,其在肝癌、口腔癌等肿瘤中表达下调,上调其表达可以抑制肿瘤细胞恶性表型[5]。通过细胞转染的方法下调细胞中HCG18表达,探讨下调HCG18对口腔鳞癌细胞增殖和迁移的影响和机制。
1 材料与方法
1.1 材料
口腔鳞癌CAL27、HB96细胞购自上海慧颖生物科技有限公司;miR-34a inhibitor、inhibitor control、HCG18 shRNA、HCG18 shRNA、miR-34a mimics、mimics control均由上海吉玛制药技术有限公司构建合成;口腔鳞癌SCC4、HB96细胞购自上海美轩生物科技有限公司;N-cadherin抗体购自美国Santa Cruz Biotechnology:正常口腔黏膜(Normal Oral Keratinocyte,NOK)细胞购自上海艾研生物科技有限公司;E-cadherin抗体购自美国Proteintech Group;引物由生工生物工程(上海)股份有限公司合成。
1.2 HCG18在口腔鳞癌细胞中的表达检测
采用Realtime PCR方法测定,步骤如下:收集口腔鳞癌CAL27、SCC4、HB96细胞和正常口腔黏膜NOK细胞,提取细胞总RNA,提取方法按照Trizol操作说明进行。逆转录反应体系为:1μL的RT Enzyme Mix I、1μL的Random 6 mers、4μL的5×Prime Script Buffer、1μL的Oligo dT Primer,最后添加RNase-free H2O至20μL。收集cDNA,用SYBR进行PCR反应,PCR反应程序为:预变性(95℃30 s),变性(95℃5 s),退火延伸(60℃60 s),一共40个循环。结果按照2-△△Ct法计算。
1.3 细胞转染及下调效果测定
按照Lipofectamine 2000转染试剂进行细胞转染。把转染HCG18 shRNA和shRNA control的细胞设置为sh-HCG18和sh-NC组,把没有转染的细胞设置为Control组。细胞转染后48 h,用Realtime PCR方法测定HCG18表达,步骤同1.2。
1.4 下调HCG18对口腔鳞癌细胞增殖影响检测
采用噻唑蓝(Methylthiazolyldiphenyl-tetrazolium bromide,MTT)方法测定。
1.5 下调HCG18对口腔鳞癌细胞迁移和侵袭影响检测
采用Transwell小室测定,侵袭实验前用基质胶包被,迁移实验前省略包被步骤,其余步骤相同,简述如下:以不含血清的细胞培养液将Control、sh-NC、sh-HCG18组细胞悬浮,然后吸取200 μL的细胞种植到小室的上室中,同时在下室中加入500μL的含血清细胞培养液,放在37℃的CO2培养箱中培养24 h。甲醇固定,结晶紫染色。放在显微镜下随机选取5个视野计数细胞穿膜数目,结果取平均值即为细胞侵袭或迁移数目。
1.6 下调HCG18对口腔鳞癌细胞中N-cadherin、E-cadherin蛋白表达影响检测
采用Western blot方法测定,步骤简述如下:提取Control、sh-NC、sh-HCG18组细胞总蛋白,每个孔内蛋白上样量均为40μg;电泳电压为90 V恒压电泳0.5 h,然后以120 V恒压电泳2 h。将NC膜裁剪成与分离胶大小相同,在60 V恒压条件下转膜,转膜装置在4℃条件下进行,转膜时间设置为60 min。5%脱脂奶粉的封闭;一抗结合过夜;二抗孵育2 h。以电化学发光(Electro-Chemi-Luminescence,ECL)方法显色。结果用mage J分析条带的OD值,把GAPDH作为内参。
1.7 HCG18靶基因预测以及鉴定
生物信息学软件(starbase)预测HCG18的靶基因,发现miR-34a与HCG18有互补结合位点。用荧光素酶报告系统鉴定靶向关系。分别将野生型(WT)和突变型(MUT)HCG18荧光素酶报告载体与miR-34a mimics和mimics control共转染到口腔鳞癌细胞中,48 h后,检测其荧光素酶活性变化。WT和MUT荧光素酶报告载体均由湖南丰晖生物科技有限公司构建。收集Control、sh-NC、sh-HCG18组细胞,U6为内参,以Realtime PCR方法测定miR-34a表达变化,步骤同1.2。
1.8 miR-34a inhibitor对下调HCG18的口腔鳞癌细胞增殖、迁移和侵袭影响检测
在口腔鳞癌细胞中分别共转染miR-34a inhibitor、HCG18 shRNA和inhibitor control、HCG18 shRNA,设置为sh-HCG18+Anti-miR-34a、sh-HCG18+Anti-NC组,按照1.4、1.5、1.6中方法测定细胞增殖、迁移、侵袭以及N-cadherin、E-cadherin蛋白表达变化。
1.9 统计学分析
采用SPSS 21.0软件统计分析,计量资料用()表示,两组间比较用独立样本t检验,多组比较采用方差分析,组间比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 口腔鳞癌细胞和正常口腔细胞中HCG18表达差异
HCG18在口腔鳞癌CAL27、SCC4、HB96细胞中的表达水平均高于正常口腔黏膜NOK细胞,差异有统计学意义(P<0.05)。见表1。
表1 HCG18在口腔鳞癌细胞和正常口腔黏膜细胞中HCG18表达差异比较(±s)Table 1 Comparison of HCG18 expression in oral squamous cell carcinoma cells and normal oral mucosa cells(±s)

表1 HCG18在口腔鳞癌细胞和正常口腔黏膜细胞中HCG18表达差异比较(±s)Table 1 Comparison of HCG18 expression in oral squamous cell carcinoma cells and normal oral mucosa cells(±s)
细胞NOK CAL27 HB96 SCC4 F值P值HCG18水平1.00±0.09 1.69±0.12 2.41±0.23 2.94±0.21 215.60<0.001
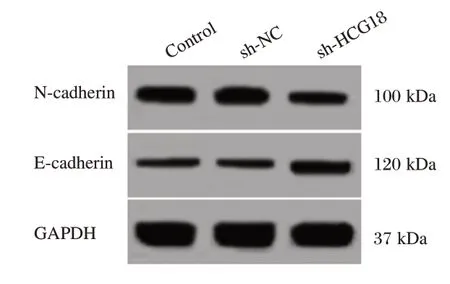
图1 Western blot测定N-cadherin、E-cadherin蛋白表达Figure 1 western blot analysis of the expression of N-cadherin and E-cadherin
2.2 HCG18 shRNA对口腔鳞癌SCC4细胞增殖、侵袭和迁移影响
转染HCG18 shRNA后的口腔鳞癌SCC4细胞中HCG18表达水平降低,细胞增殖能力下降,细胞迁移以及侵袭数目均下降,细胞中N-cadherin蛋白表达水平下降,E-cadherin蛋白表达水平升高。见图1和表2。
2.3 HCG18靶向调控miR-34a
生物信息学软件预测miR-34a和HCG18结合位点,WT和miR-34a mimics共转染后的口腔鳞癌SCC4细胞荧光素酶活性下降。见图2和表3。HCG18靶向调控miR-34a。
表2 细胞中HCG18表达、OD值、迁移数目、侵袭数目以及N-cadherin、E-cadherin蛋白表达差异比较(±s)Table 2 Comparison of HCG18 expression,OD value,migration number,invasion number,N-cadherin and E-cadherin protein expression in cells(±s)
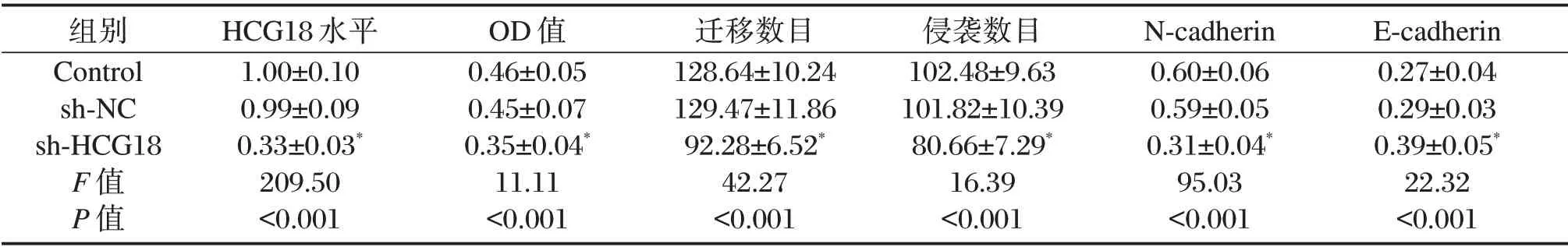
表2 细胞中HCG18表达、OD值、迁移数目、侵袭数目以及N-cadherin、E-cadherin蛋白表达差异比较(±s)Table 2 Comparison of HCG18 expression,OD value,migration number,invasion number,N-cadherin and E-cadherin protein expression in cells(±s)
注:与sh-NC比,*P<0.05。
组别Control sh-NC sh-HCG18 F值P值HCG18水平1.00±0.10 0.99±0.09 0.33±0.03*209.50<0.001 OD值0.46±0.05 0.45±0.07 0.35±0.04*11.11<0.001迁移数目128.64±10.24 129.47±11.86 92.28±6.52*42.27<0.001侵袭数目102.48±9.63 101.82±10.39 80.66±7.29*16.39<0.001 N-cadherin 0.60±0.06 0.59±0.05 0.31±0.04*95.03<0.001 E-cadherin 0.27±0.04 0.29±0.03 0.39±0.05*22.32<0.001
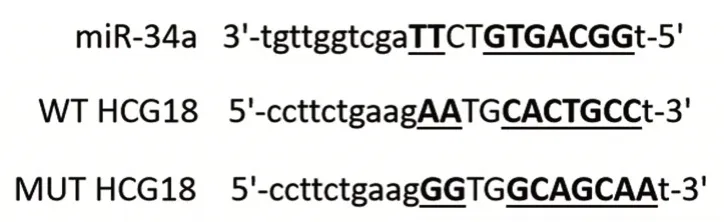
图2 miR-34a和HCG18结合位点示意图Figure 2 Schematic diagram of predicted binding sites of miR-34a and HCG18
表3 细胞荧光素酶活性(±s)Table 3 luciferase activity of cells(±s)
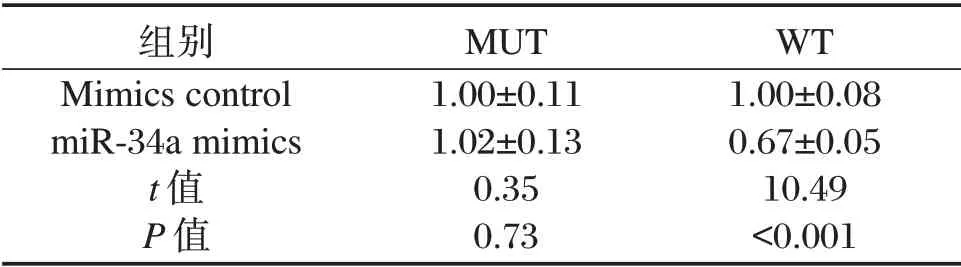
表3 细胞荧光素酶活性(±s)Table 3 luciferase activity of cells(±s)
组别Mimics control miR-34a mimics t值P值MUT 1.00±0.11 1.02±0.13 0.35 0.73 WT 1.00±0.08 0.67±0.05 10.49<0.001
2.4 下调HCG18对口腔鳞癌SCC4细胞miR-34a表达影响
转染HCG18 shRNA后的口腔鳞癌SCC4细胞中miR-34a表达水平升高。见表4。
表4 HCG18 shRNA转染前后口腔鳞癌SCC4细胞中miR-34a表达差异比较(±s)Table 4 Comparison of miR-34a expression in oral squamous cell carcinoma SCC4 cells before and after HCG18 shRNA transfection(±s)

表4 HCG18 shRNA转染前后口腔鳞癌SCC4细胞中miR-34a表达差异比较(±s)Table 4 Comparison of miR-34a expression in oral squamous cell carcinoma SCC4 cells before and after HCG18 shRNA transfection(±s)
注:与sh-NC比,a P<0.05。
组别Control sh-NC sh-HCG18 F值P值miR-34a水平1.00±0.12 0.97±0.08 1.85±0.16a 145.10<0.001
2.5 miR-34a inhibitor对下调HCG18的口腔鳞癌SCC4细胞增殖、侵袭和迁移影响
与共转染inhibitor control和HCG18 shRNA的细胞比较,共转染miR-34a inhibitor和HCG18 shRNA后的口腔鳞癌SCC4细胞中miR-34a表达下调,细胞OD值、迁移数目、侵袭数目均升高,细胞中N-cadherin蛋白表达水平升高,E-cadherin蛋白表达水平下降。见图3和表5。
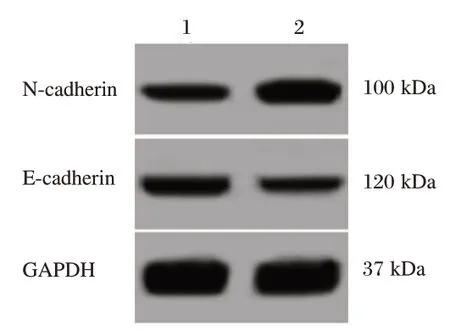
图3 Western blot检测N-cadherin、E-cadherin蛋白表达Figure 3 Western blot analysis of the expression of N-cadherin and E-cadherin
3 讨论
人类基因组中有约2%左右可以转录编码蛋白质,而基因组转录形成的大多数RNA没有编码功能,成为非编码RNA[6]。随着研究的不断深入,人们逐渐发现非编码RNA在细胞生长和发育过程发挥各种不同的生物学作用[7]。lncRNA作为一种常见的非编码RNA,其可以通过调控基因转录而发挥生物学作用[8]。HCG18在肿瘤中发挥类似癌基因的作用,目前已经在肺癌、肝癌等肿瘤中证实,下调HCG18可以抑制肿瘤细胞的侵袭和迁移能力[4,9]。本次实验结果提示HCG18在口腔鳞癌中可能发挥促进作用,这与上述研究结果一致,均说明HCG18可能是肿瘤促进因子。
恶性肿瘤向远端转移是肿瘤死亡率高的重要原因,肿瘤细胞从原来的位置脱落以后,通过黏附作用进入新的组织和器官[10]。EMT是指上皮细胞特征逐渐消失而表现出间质细胞特性[11]。研究显示,肿瘤细胞EMT后转移概率更大[12]。N-cadherin是间质细胞标志蛋白,其属于黏附分子,参与细胞同细胞之间的动态黏附过程[13]。N-cadherin在肿瘤中发挥癌基因的作用,高表达N-cadherin可以促进肿瘤的转移和浸润[14]。E-cadherin是上皮细胞标志蛋白,其不仅可以保持细胞与细胞之间的完整连接,还可以抑制细胞侵袭和迁移能力,E-cadherin具有抗肿瘤进展的作用[15]。本次实验结果表明,下调HCG18后的口腔鳞癌细胞中N-cadherin表达水平降低,E-cadherin表达水平升高,提示下调HCG18抑制口腔鳞癌细胞EMT,进一步证实了下调HCG18具有抗口腔鳞癌转移的作用。
表5 细胞中miR-34a表达、OD值、迁移数目、侵袭数目以及N-cadherin、E-cadherin蛋白表达差异比较(±s)Table 5 Comparison of miR-34a expression,OD value,migration number,invasion number,N-cadherin and E-cadherin protein expression(±s)
表5 细胞中miR-34a表达、OD值、迁移数目、侵袭数目以及N-cadherin、E-cadherin蛋白表达差异比较(±s)Table 5 Comparison of miR-34a expression,OD value,migration number,invasion number,N-cadherin and E-cadherin protein expression(±s)
组别sh-HCG18+Anti-NC sh-HCG18+Anti-miR-34a t值P值miR-34a水平1.00±0.08 0.42±0.04 19.45<0.001 OD值0.34±0.05 0.46±0.03 6.17<0.001迁移数目91.32±7.59 120.48±10.67 6.68<0.001侵袭数目82.96±5.81 99.47±9.63 4.40<0.001 N-cadherin 0.32±0.05 0.63±0.07 10.81<0.001 E-cadherin 0.38±0.06 0.24±0.04 5.82<0.001
研究报道显示,lncRNA作用机制较为复杂,其可以通过调控基因的转录而发挥多种生物学作用,并且同一个lncRNA可以同时调控多个靶基因[16]。本次实验显示,HCG18可以靶向负调控口腔鳞癌细胞中miR-34a的表达,HCG18作用机制可能与miR-34a有关。miR-34a基因定位在1p36.23染色体上,其功能缺失多见于白血病、乳腺癌等恶性肿瘤,miR-34a通过靶向调控下游基因的表达影响细胞的侵袭、迁移[17]。之前的研究表明,miR-34a可以降低口腔鳞癌细胞的侵袭和迁移能力。
综上,下调HCG18在口腔鳞癌细胞增殖、侵袭、迁移和EMT中发挥抑制作用,其作用机制与靶向上调miR-34a的表达有关,目前对于miR-34a作用的下游机制还不明确。我们的实验结果为靶向基因治疗口腔鳞癌提供了参考,为研究HCG18在口腔鳞癌中的调控网络提供了资料。
