SPECT、CT和骨代谢标志物组合模型对肺癌骨转移的诊断价值
2020-08-04麦家杰张金山颜卓恒符立辉
麦家杰,张金山*,颜卓恒,符立辉
1.广州医科大学附属第三医院核医学科,广东广州 510150;2.中山大学孙逸仙纪念医院放射科,广东广州 510120;3.广州医科大学附属第三医院放射科,广东广州 510150;*通讯作者 张金山 zhangjsgd137@163.com
肺癌骨转移是常见并发症之一,有无发生骨转移对肿瘤分期及治疗方案的选择非常重要。《肺癌骨转移诊疗专家共识(2014版)》已将SPECT列入筛查骨转移的首选方法[1],但存在敏感度高、特异度低的不足,CT检查对于骨转移瘤的敏感度高,能够较好地评价骨质破坏程度,但是对于骨皮质早期转移,CT诊断敏感度较低[2],有研究开始借助骨标志物辅助判断骨转移[3]。血清碱性磷酸酶(ALP)和Ca2+水平的变化与肺癌骨转移具有密切联系,其中肺癌骨转移患者的血清ALP和Ca2+水平均显著高于未发生骨转移的患者[4]。本研究结合CT分析有无骨质破坏以及检测血清ALP和Ca2+能提高诊断准确性。并对初次CT未发生骨转移的患者6个月后再次行CT检查,判断有无骨转移,并将影像学信息与血清骨指标进行汇总,筛选出选择最佳的组合模型,为肺癌骨转移的诊断及病情监控提供较高的临床价值。
1 资料与方法
1.1 研究对象 选择2014年1月—2016年12月在我院首次确诊的肺癌患者206例并进行SPECT骨扫描。所有患者均由病理检查诊断为原发性肺癌,排除肾脏疾病、甲状旁腺疾病、影响钙盐代谢水平疾病患者,男137例,女69例,年龄36~72岁。本研究均告知患者及家属,并签署知情同意书。
1.2 肺癌骨转移诊断标准与排除标准 诊断标准:全身SPECT骨扫描提示有转移病灶,阳性判断标准参照文献[5]骨转移诊断标准,骨转移癌的放射性核素骨显像特征性表现为多发的无规则的放射性浓集区。以相邻正常骨组织作为正常对照区,病变部位放射性分布高于对照区为异常浓聚,出现多个异常浓聚影即可诊断为骨转移瘤,所有骨显像结果均由2名以上医师共同诊断得出结果。针对受累骨区域同时再进行CT骨扫描,分析有无骨质破坏;对无骨质破坏者,6个月后再次复查CT,观察有无骨质破坏。以CT发现骨质破坏为标准,判断患者存在肺癌骨转移。
排除标准:①已明确诊断骨转移且接受磷酸钠盐治疗或放疗的患者;②原发性骨肿瘤患者;③患有影响骨代谢的疾病,如风湿性关节炎、甲状旁腺功能亢进等;④骨质疏松的老年患者。
1.3 分组 206例患者确诊后,根据6个月内CT对骨质破坏的判断结果,将患者分为两组:存在骨质破坏则判断发生骨转移,即肺癌骨转移组,共171例;无骨质破坏则认定未发生骨转移,即肺癌无骨转移组,共35例。
1.4 SPECT成像方法 SPECT扫描仪为GE Infinia Ⅱ Hawkeye 4型,检查前静脉注射示踪剂99Tcm-MDP(25 mCi)后,饮水1000 ml并等待2~4 h后进行全身显像,人工设置探头位置,使探头尽量贴近受检者。显像参数:低能高分辨准直器,窗宽20%,能峰140 keV,电压120 kV,矩阵128×128,扫查速度13 cm/min,选择7100A/DI分别行前位和后位全身骨显像SPECT扫查。扫描完成后使用Xeleris系统进行图像后处理,调整本底与图像对比,达到最佳诊断图像效果。
1.5 血清ALP、Ca2+水平检测 进行SPECT扫描前空腹采集静脉血3~4 ml,血清Ca2+检测采用偶氮砷Ⅲ法,ALP检测采用酶法,均采用日本Olympus AU 5400全自动生化分析仪。
1.6 统计学方法 采用SPSS 22.0软件,对于肺癌是否转移患者的血清ALP、Ca2+水平比较采用独立样本t检验;组合模型经多因素回归分析,建立Logistic回归模型,绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),应用约登指数筛选临界值,计算诊断的敏感度、特异度、准确度、阳性预测值和阴性预测值;采用Pearsonχ2检验比较不同组合模型的诊断效能。以P<0.05为差异有统计学意义。
2 结果
2.1 肺癌患者SPECT和CT扫查对骨转移的诊断 检测206例肺癌患者血清ALP、Ca2+水平,SPECT全身骨扫描,并同时进行CT扫查(图1)。第1次CT扫描138例患者发现全身多处骨质破坏,其中134例SPECT阳性,4例阴性;68例CT显示无骨质破坏并6个月后复查。复查结果显示33例出现多发骨质破坏,其中SPECT阳性31例,阴性2例;35例无骨质破坏,其中19例SPECT阳性,16例阴性。以6个月的CT随访结果为标准,SPECT诊断肺癌骨转移的敏感度为96.49%,特异度为45.71%,准确度为87.86%,阳性预测值为89.67%,阴性预测值为72.73%。
2.2 各组患者血清ALP和Ca2+水平比较 肺癌患者SPECT检查前检测血清ALP和Ca2+水平,骨转移组血清ALP[(113.63±32.72)U/L比(88.47±25.29)U/L]和Ca2+水平[(2.24±0.26)mmol/L比(2.08±0.19)mmol/L]均明显高于无骨转移组(P=0.006、P=0.009)。
2.3 血清ALP、Ca2+水平诊断肺癌骨转移的效能 血清ALP、Ca2+水平诊断的特异度高于SPECT(P=0.038),其敏感度、准确度、阴性预测值均低于SPECT,差异均有统计学意义(P=0.025,图2)。

图2 骨代谢标志物及影像学不同组合模型的ROC曲线
2.4 组合模型对肺癌骨转移的诊断 经多因素回归分析,建立Logistic回归模型,并绘制ROC曲线(图2)。组合模型1(ALP和Ca2+)诊断肺癌骨转移的敏感度、特异度、准确度、阳性预测值、阴性预测值及其AUC高于单独ALP或Ca2+的诊断效能。组合模型4(ALP、Ca2+和SPECT)的诊断效能最高,AUC为0.836,其敏感度、特异度、准确度、阳性预测值、阴性预测值分别为94.74%、71.43%、90.78%、94.19%和73.53%。与SPECT诊断效能相比,组合模型4能提高诊断的特异度,差异有统计学意义(P=0.029);但敏感度、准确度、阳性预测值、阴性预测值与SPECT相近,差异无统计学意义(P=0.062,表1)。
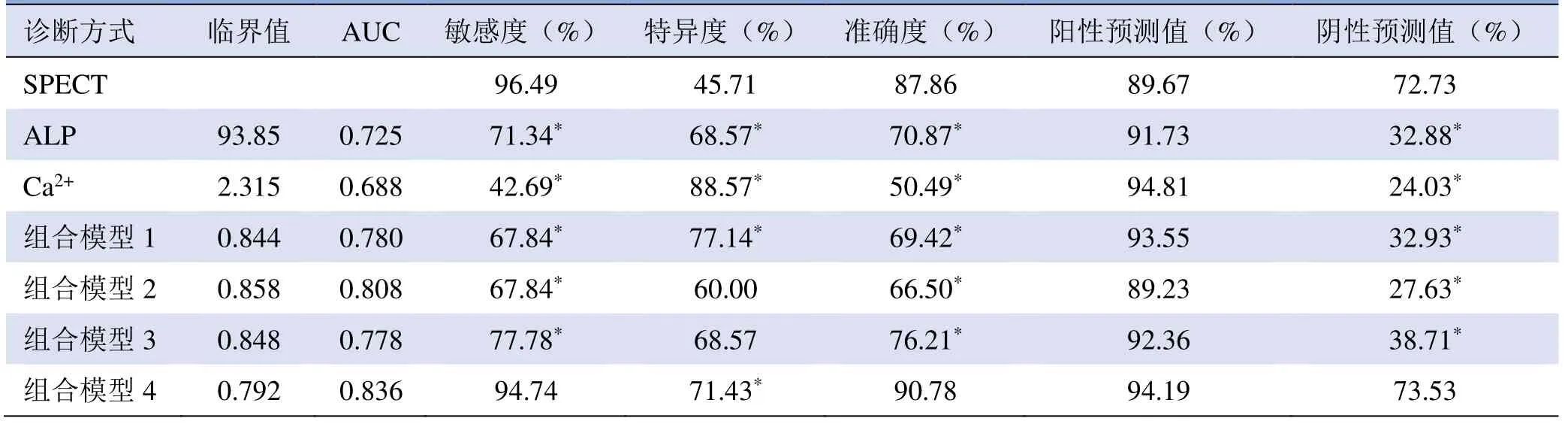
表1 SPECT、ALP、Ca2+和组合模型对肺癌骨转移的诊断效能比较
3 讨论
骨转移是肺癌的常见并发症,2014版肺癌骨转移诊疗专家共识[1]认为肺癌发病隐匿,确诊时约50%已经发生远处转移,主要表现为骨痛、脊髓压迫及病理性骨折等,对患者生活质量造成严重影响。既往研究[6]认为,SPECT诊断骨转移敏感度最高,但由于SPECT特异度较低,常伴有假阳性,肺癌晚期骨转移 瘤伴高度侵袭导致病灶局部血运障碍时,SPECT也可表现为阴性,而CT则呈明显的骨质破坏[7]。CT判断有无骨质破坏有助于鉴别SPECT的假阳性。有学者[8]认为血清肿瘤标志物检测与CT 扫描是目前诊断与监测肿瘤发展的主要手段,随着分子影像技术的发展成熟,以正电子18F-FDG成为评价肺部肿瘤的一种新方法,张蕊等[9]研究发现PET/CT与SPECT/CT一致性较好,但前者费用昂贵,难以常规检查手段开展,后者可在临床上推广。
本研究结果显示,SPECT/CT在诊断肺癌骨转移中敏感性高达96.49%,一定程度上验证了丁浩源等[10]研究的一致性,但鉴于本研究样本量较大,理论上比后者更可靠,但在特异度上两者差异较大,还需进一步研究。由于SPECT的假阳性和骨质破坏的延后性,暂无骨质破坏而SPECT阳性的早期病灶,存在一定的鉴别困难,因此,反映骨代谢标志物的生化指标逐渐在临床中得到应用。ALP和血清Ca2+是反映成骨活动和溶骨活动的重要标志物,在肺癌骨转移患者中溶骨现象和成骨现象往往同时存在。部分文献研究[3-4]认为应用血清ALP和Ca2+的变化有助于判断肺癌骨转移。本研究结果显示,肺癌骨转移与无骨转移组比较,血清ALP、Ca2+水平明显升高,其敏感度和特异度分别为71.34%、42.69%和68.57%、88.57%,与孙乐等[11]的研究相似,ALP和Ca2+检测的特异度明显高于SPECT;Huang等[12]分析来自多中心的1720个样本的骨源性碱性磷酸酶(BAP),发现肺癌骨转移组BAP明显高于无转移组,与本研究结论相同,同时发现BAP升高与骨转移部位多少和破坏程度也有提示作用[13-14],但由于ALP不仅由成骨细胞产生,还可以由肝脏小肠等产生,故特异性不高。但既往研究[12,15]发现与无骨转移者相比,骨转移患者中ALP水平明显偏高,也与本研究一致。本研究将SPECT、ALP、Ca2+随机组合,发现三者组合时诊断效能最优,其敏感度、特异度、准确度、阳性预测值、阴性预测值分别是94.74%、71.43%、90.78%、94.14%、73.53%。陈孟权等[16]将4种骨代谢标志物1型胶原羧基端肽β-特殊序列、1型前胶原氨基端前肽、ALP、Ca2+应用组合模型进行分析,结果显示组合模型诊断肺癌骨转移的敏感度可达87.0%,特异度为90.7%,AUC为0.938,同样认证了组合模型的诊断效能高于单种标志物。
有研究认为肺癌骨转移患者高血钙和高ALP的比例并不高,对肺癌骨转移的应用价值不大。肺癌骨转移患者仅10.31%并发高钙血症,恶性肿瘤患者约10%~20%有高钙血症[17];另一项研究显示[18],肺癌骨转移组ALP增高发生率为36.54%,而非转移组ALP增高发生率为8.54%。总之,与单个诊断指标相比,组合模型(SPECT/CT、ALP和Ca2+)指标性能实现互补,对于肺癌骨转移有更好的诊断效能。由于与既往研究有部分结果不完全相同,本研究需要进一步增加样本量以及其他研究指标,为临床肺癌骨转移的治疗提供更多依据。
