胰腺癌hsa-miR-194的生物信息学分析及靶基因预测*
2020-08-04吴雪虎殷彩桥张孟贤方呈祥
杨 丽, 吴雪虎, 郭 晓, 殷彩桥, 张孟贤, 方呈祥△
湖北民族大学附属民大医院1肿瘤科2消化内科,恩施 4450003华中科技大学同济医学院附属同济医院肿瘤中心,武汉 430030
胰腺癌(pancreatic adenocarcinoma,PAAD)是消化系统肿瘤中恶性程度高、预后极差的肿瘤之一,其发病率和死亡率均位居前列,60%患者就诊时已因发生远处转移而失去根治手术的机会,中位生存期仅约15个月[1]。PAAD因其起病隐匿、诊断不及时且治疗方法有限而未能改善其恶性进展的趋势。尽管目前治疗胰腺癌新药的临床试验不断开展,但其成效也十分有限。因而,进一步探究胰腺癌的发病机制,寻找新的切入点亟待进行。
miRNA(microRNA)是一类长度约20~24个核苷酸的非编码小分子单链RNA,由内源基因编码,主要参与转录后的基因表达调控[2]。迄今,已有大约2万多个miRNA被研究发现,其中大部分miRNA可以通过调节人类1/3的基因表达而参与生命过程复杂的网络调节。越来越多的研究也证实miRNA在多种疾病及恶性肿瘤中表达异常,发挥不同的调节作用,甚至在机体不同组织、不同发育阶段中扮演着癌基因或抑癌基因的角色[3-4]。miRNA的调控机制十分复杂,很多领域还处于研究的盲点。目前,越来越多的DNA甲基化和mRNA/miRNA表达谱被发表在不同的公共知识库中,这些数据可以帮助研究人员确定表观遗传模式,这是研究致癌机制的重要方向。目前,有关hsa-miR-194在胰腺癌中的表达与靶基因预测及其功能研究尚未见报道。本研究旨在通过多种生物信息分析工具,研究胰腺癌中差异表达的miRNA,预测hsa-miR-194可能参与调控的靶基因,为实现肿瘤精准治疗提供理论支持。
1 材料与方法
1.1 利用miRGator v3.0分析hsa-miR-194在不同疾病中的表达
miRGator v3.0(http://mirgator.kobic.re.kr/)在线数据库是一个整合了miRNA表达、靶标预测、基因表达数据、功能分析和疾病相关信息的功能注释系统[5]。miRGator集中收录了包括TCGA、GEO、SRA等数据库中发布的70多个人类miRNA测序数据[6]。将hsa-miR-194输入miRGator v3.0数据库,检索其在不同疾病,包括恶性肿瘤中的表达情况。
1.2 TCGA数据处理
从TCGA(The Cancer Genome Atlas,https://cancergenome.nih.gov/)数据库下载有关胰腺癌的miRNA-seq转录本数据,经标准化处理后转换成miRNA命名的矩阵文件。通过R3.5.1软件(https://www.r-project.org/),安装edgeR等软件包(https://bioconductor.org/biocLite.R),设P<0.05和差异倍数(fold change,FC)的绝对值≥ 2为过滤条件,筛选出胰腺癌与正常组织样本间显著表达差异的miRNAs,并使用R软件制作热图(heatmap)。
1.3 miR-194的碱基序列及保守性分析
miRbase(http://www.mirbase.org/)数据库是目前用于存储miRNA序列数据、注释、预测基因靶标等信息的全方位公共数据库之一,包含206个物种的30424个成熟的miRNA序列,研究者可通过miRNA的名字、ID、染色体位置、序列进行检索[7]。使用miRbase检索获得有关hsa-miR-194的染色体定位、碱基序列以及物种保守性的信息。
1.4 hsa-miR-194在胰腺癌中的DNA甲基化水平
MethHC(http://MethHC.mbc.nctu.edu.tw)数据库整合了TCGA数据库中包含的18种癌症、6000多个样本相关的DNA甲基化、miRNA基因DNA甲基化、mRNA和miRNA的表达谱数据[8]。基于MethHC数据库分析hsa-miR-194在胰腺癌中的DNA甲基化水平较正常组织的差异。
1.5 hsa-miR-194靶基因预测
TargetScan v7.0(http://www.targetscan.org/)提供了包括人、鼠等多类物种的信息,通过搜索和每条miRNA种子区域匹配的保守的8 mer和7 mer位点来预测靶基因[9]。DIANA-microT-CDS[10](http://diana.imis.athena-innovation.gr/)和miRanda(http://www.microrna.org/)数据库也收录了有关人类、鼠、鱼、斑马等物种基因组的miRNA靶标预测信息以及miRNA在不同组织及疾病中的表达谱数据。miRTarBase数据库收录了经实验验证的miRNA靶标,同时提供了支持搜索结果的文献[11]。通过TargetScan v7.0、DIANA-microT-CDS和miRanda这3种miRNA靶基因预测工具,获取hsa-miR-194的公共靶基因,并通过miRTarBase(http://mirtarbase.mbc.nctu.edu.tw/)数据库进行验证。
1.6 hsa-miR-194靶基因GO功能注释和KEGG富集分析
使用DAVID 6.8网络在线分析数据库(https://david.ncifcrf.gov/)对hsa-miR-194的靶基因进行GO(gene ontology)功能注释,其内容包括了基因参与的生物学过程(biological process,BP)、分子功能(molecular function,MF)以及细胞组成(cellular component,CC)。同时,对靶基因进行KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析,找出差异显著的信号转导通路以及肿瘤相关信号通路。设P<0.05为差异具有统计学意义。
2 结果
2.1 hsa-miR-194的表达情况
根据miRGator v3.0数据库,发现hsa-miR-194在结直肠癌、胃癌、肝癌、肾透明细胞癌等恶性肿瘤中的表达丰度显著升高(P<0.05,图1)。miRGator收录的相关疾病信息中没有包含胰腺癌的数据,因而有关其在胰腺癌中的表达研究尚未见明确报道。我们基于目前使用最广、最具权威的TCGA癌症数据库单独下载有关胰腺癌的miRNA-seq转录本数据,其中包含了179个胰腺癌组织样本和4个正常组织样本。根据筛选条件得到差异表达的miRNA列表共15个,其中含2个显著表达上调的miRNA,分别是hsa-miR-194-2、hsa-miR-194-1,以及13个表达下调的miRNA(图2)。miR-194在人类组织的成熟序列为hsa-miR-194-5p,hsa-miR-194-1与hsa-miR-194-2均是has-miRNA-194-5p/hsa-miRNA-194-3p的前体结构(二级结构),即为miRNA-194的stem-loop。因而,我们选择miR-194进行后续研究。

图1 hsa-miR-194在不同疾病中的表达丰度Fig.1 The expression abundance of hsa-miR-194 in different diseases
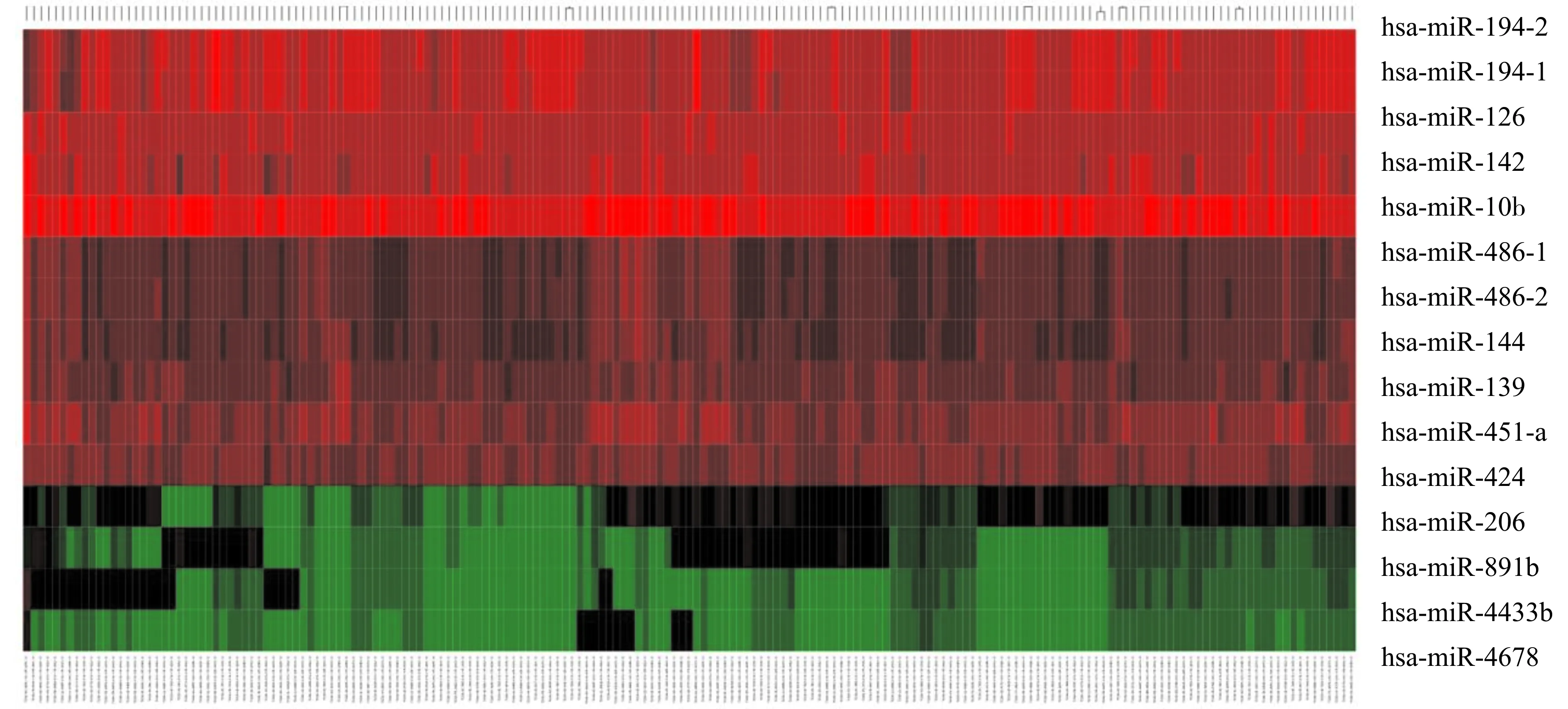
图2 胰腺癌中差异表达的miRNA热图Fig.2 Heatmap of the differentially expressed miRNA in PAAD tissues
2.2 miRNA-194的保守性
利用miRbase检索发现hsa-miR-194定位于染色体11q13.1,同时通过分析包括人类在内的9个物种的miR-194成熟序列(mature sequence)发现,miR-194的22个碱基序列“UGUAACAGCAACUCCAUGUGGA”趋于稳定,且在多物种中高度保守(表1)。
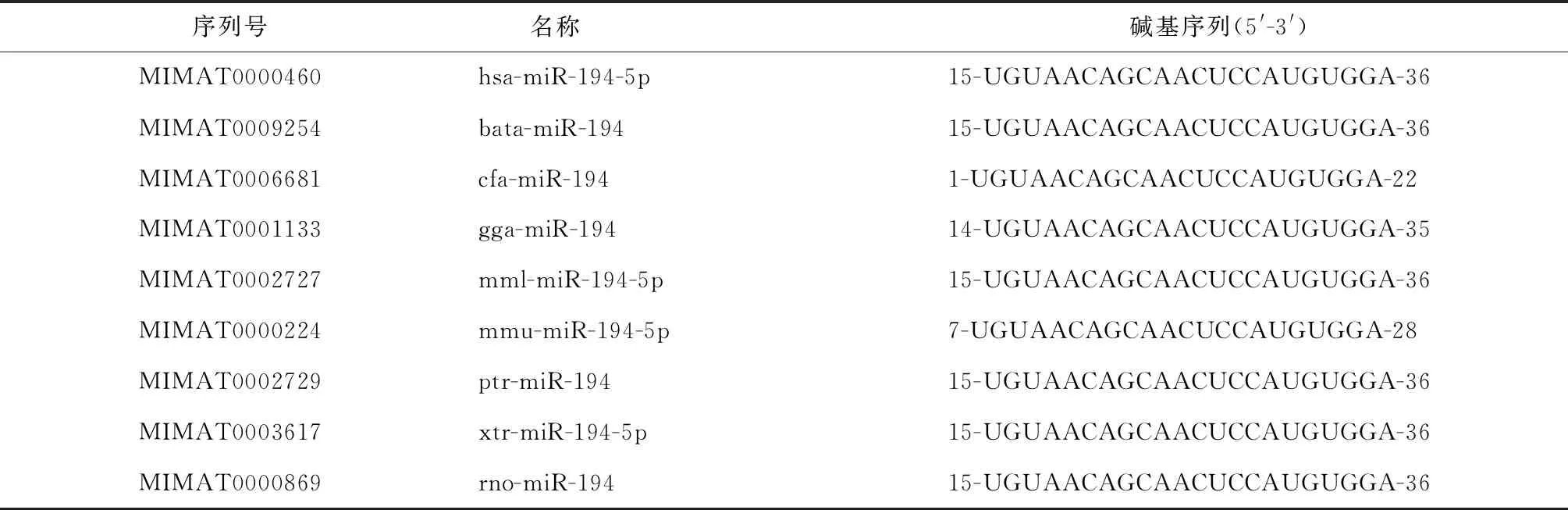
表1 不同物种的miRNA-194碱基序列Table 1 Sequences of miR-194 in different species
2.3 hsa-miR-194在PAAD中的DNA甲基化水平
甲基化作用是转录水平上表达调控的重要方式,DNA甲基化异常可干扰基因的正常转录过程。通过MethHC数据库研究发现,hsa-miR-194在PAAD组织与正常胰腺组织中的DNA启动子区甲基化水平具有显著差异。与正常胰腺组织比较,PAAD组织中hsa-miR-194的表达丰度上调,但其甲基化水平降低(P<0.01,图3)。

与正常胰腺组织比较,**P<0.01图3 hsa-miR-194在PAAD组织和正常胰腺组织中的DNA甲基化水平Fig.3 DNA methylation levels of hsa-miR-194 in PAAD tissues and normal pancreas tissues
2.4 hsa-miR-194的靶基因预测
通过TargetScan、miRanda、DIANA-microT-CDS预测hsa-miR-194的靶基因数分别为473、676和860个,三者取交集;进而在miRTarBase数据库中检索到具有高证据级别证实的靶基因共24个。将以上两者结合分析后发现,由实验方法确认和文献可检索到的最终候选靶标共15个(表2)。
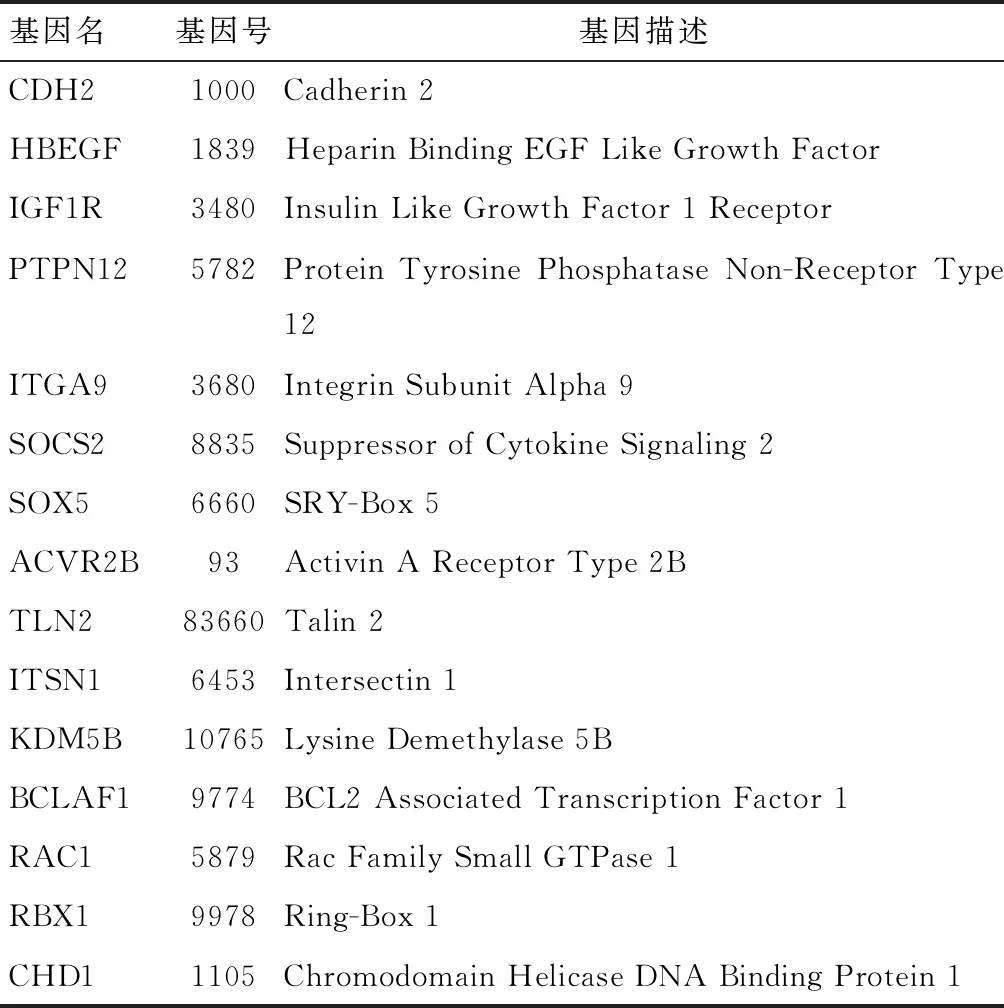
表2 The target genes of has-miR-194Table 2 hsa-miRNA-194的靶基因
2.5 hsa-miR-194靶基因GO注释和KEGG富集分析
GO功能注释显示,hsa-miR-194靶基因所富集的功能主要表现在信号转导的调节(regulation of signal transduction)、细胞粘附(cell adhesion)、蛋白结合(protein binding)、胚期后发育(post-embryonic development)、正向调控蛋白激酶B信号(positive regulation of protein kinase B signaling)等;基于KEGG的通路富集分析显示hsa-mir-194靶基因主要参与了细胞周期调控(cell cycle)JAK-STAT信号通路(JAK-STAT signaling pathway)、TGF-beta信号通路(TGF-beta signaling pathway)、MAPK信号通路(MAPK signaling pathway)、Ras信号通路(Ras signaling pathway)、Wnt信号通路(Wnt signaling pathway)以及PI3K-Akt信号通路(PI3K-Akt signaling pathway)等,同时还参与了乳腺癌(breast cancer)、胰腺癌(pancreatic cancer)、结直肠癌(colorectal cancer)、膀胱癌(bladder cancer)、肝癌(hepatocellular carcinoma)等癌症相关信号通路的转录失调。见表3。

表3 hsa-miR-194靶基因的GO注释和KEGG富集分析Table 3 GO and KEGG enrichment analysis of hsa-miR-194 target genes
3 讨论
本研究通过TCGA数据库整理分析了胰腺癌中miRNA的表达差异,结果发现hsa-miR-194在胰腺癌中的表达显著上调。进一步,我们通过miRGator数据库检索到hsa-miR-194在结直肠癌、胃癌、肝癌、肾透明细胞癌等多种恶性肿瘤中的表达丰度也显著升高。因而,我们推测hsa-miR-194可能参与了胰腺癌发生发展的重要调控机制。miRNA高度的保守性与其功能的重要性有着密切的关系。我们基于miRbase数据库发现,miR-194在包括人在内的9个物种中其成熟碱基序列高度保守,表明其在调控生命活动过程中的稳定性,miR-194参与编码的蛋白质也有着极其重要的作用。DNA甲基化是基因转录的重要表观遗传学调控因子,启动子区DNA甲基化水平高的基因在转录上是沉默的,但在正常细胞中如果一些基因和重复序列的甲基化水平降低,也将出现基因表达和重复序列的激活,从而导致基因印记丢失,X染色体失活,细胞过度增长,表观遗传学的改变等,最终导致肿瘤发生。本研究发现,与正常胰腺组织比较,PAAD组织中hsa-miR-194的DNA甲基化水平降低。DNA甲基化水平可能并非影响hsa-miR-194在PAAD中表达丰度的决定因素,可能还存在着其他调控机制。DNA甲基化水平失衡干扰了基因的正常转录过程,可引起癌基因的扩增、抑癌基因的失活。因而,在肿瘤治疗过程中,可以考虑通过调节DNA甲基化位点,保持基因甲基化平衡,调控基因的正常转录。
miRNA参与的生命活动包括了生长发育,细胞增殖、迁移与凋亡,器官形成,脂肪代谢以及细胞分化等,其具体的作用机制十分复杂。通常,一个miRNA可以通过调控多个靶基因的表达,也可以通过多个miRNA相互结合而精准调控某个基因的表达。为了明确hsa-miR-194如何在胰腺癌等恶性肿瘤中发挥作用,需要预测其相互作用的靶基因,研究靶基因的功能。目前,用于miRNA靶基因预测的常用数据库较多,我们选取了TargetScan、miRanda和DIANA-microT-CDS三大数据库进行预测,取三者的交集后通过miRTarBase数据库进行验证,最后得到RAC1、CDH2、IGF1R、HBEGF、SOCS2、SOX5和RBX1等15个候选靶标。这些靶基因与hsa-miR-194的相互作用均经过了Western blot、qPCR等实验方法验证,且有相关文献报道,有着较高的证据级别。Miao等[12]研究报道miR-194通过靶向CDH2抑制骨肉瘤细胞的增殖和迁移,促进细胞凋亡。研究还发现miR-194靶向调节细胞因子信号抑制因子2(suppressor of cytokine signaling 2,SOCS2)导致致癌激酶FLT3和JAK2的表达降低,所引起的ERK和STAT3信号通路增强可以通过Wnt信号通路靶向调节泛素连接酶TRAF6的表达,增强直肠癌患者新辅助治疗的敏感性,从而作为局部进展期直肠腺癌患者新辅助放化疗反应敏感性的预测生物标志[13]。Das等[14]研究发现miR-194是前列腺癌转移的一个驱动因素,通过靶向SOCS2导致致癌激酶FLT3和JAK2的表达降低,活化ERK和STAT3信号通路,从而促进前列腺癌细胞的迁移、侵袭和上皮-间质转化(epithelial mesenchymal translation,EMT)。靶基因参与调控的机制也错综复杂,因而我们进一步通过生物信息分析技术对靶基因进行GO功能注释和KEGG通路富集分析发现,hsa-miR-194靶基因所富集的功能主要在于细胞粘附、蛋白结合、胚期后发育、蛋白激酶B信号正向调控等;其参与的信号通路主要包括细胞周期调控、JAK-STAT、TGF-beta、MAPK、Ras以及Wnt等信号通路,同时还参与了乳腺癌、结直肠癌、膀胱癌、肝癌、肾癌等恶性肿瘤相关的转录失调。Yang等[15]研究报道,miR-194在乳腺癌中表达升高,下调miR-194的表达可以促进SOX家族转录因子17的表达,调控Wnt/-catenin信号通路,从而抑制乳腺癌细胞的增殖、迁移和侵袭。Bai等[16]研究报道,miR-194可通过PI3K/AKT/FoxO3a和p53/p21信号通路抑制黑色素瘤细胞增殖,诱导细胞凋亡,增加Caspase-3/-9活性,促进人黑色素瘤细胞Bax/Bcl-2的表达。has-miR-194可以在不同恶性肿瘤中扮演癌基因或抑癌基因的角色而发挥不同的作用,成为肿瘤预防及治疗的潜在靶点。
靶基因RAC1编码的蛋白是一种GTPase,属于小GTP结合蛋白的ras超家族成员,也是细胞内重要的信号转导分子,在人体各组织中广泛表达,主要参与细胞有丝分裂周期的调控、细胞骨架重排等。有研究报道RAC1在乳腺癌等多种癌症中过表达,且其编码的蛋白不仅可以调控血管内皮细胞(vascular endothelial,VEC)骨架形成,促进肿瘤血管生成,还可以影响细胞粘附与趋化功能,加速缺氧诱导的人血管内皮细胞的损伤[17]。RAC1可以通过调节NOXs-ROS-NFκB信号通路激活基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9),诱导上皮-间质转化,影响肿瘤的形成[18];RAC1还可通过下游分子Pak1激活Lim激酶,影响肌动蛋白的磷酸化而促进肿瘤细胞的侵袭和迁移。RAC1表达异常,也可以引起多种非肿瘤性的疾病,如亨廷顿舞蹈病、糖尿病视网膜性病变、神经退行性疾病、心肌缺血后再灌注损伤等[19-22]。目前,有关hsa-miR-194如何调节RAC1影响胰腺癌进展的报道暂未发现。本研究基于生物信息分析学发现,胰腺癌中hsa-miR-194靶向调节RAC1基因,通过K-Ras/PI3K-Akt/NFκB信号通路促进细胞生长、抑制凋亡,同时还参与调控细胞骨架重组和蛋白激酶的激活。这为胰腺癌的基础研究和靶向治疗提供了新的思路。
综上,miRNA与其靶基因有着密切的联系,应用生物信息学筛选肿瘤中异常表达的miRNA,预测靶基因并对其进行功能富集分析,有助于快速了解miRNA与其靶基因间错综复杂的作用关系。后期,我们将进一步通过qRT-PCR检测胰腺癌细胞miR-194的表达,并通过Transwell侵袭和迁移实验检测细胞侵袭和迁移能力等,还将通过双荧光素酶活性实验预测靶基因的作用位点,以期获得更可靠的实验结果,为胰腺癌的治疗提供可靠的理论依据。
