非酒精性脂肪性肝炎大鼠TLR4基因及其甲基化水平的相关性研究
2020-08-04徐慧超高艳孟雅楠陈浩郝健亨刘晋芳刘杨苗宇船
徐慧超,高艳,孟雅楠,陈浩,郝健亨,刘晋芳,刘杨,苗宇船
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是 一 种 与胰岛素 抵 抗(insulin resistance,IR)和遗传易感性有关的代谢性肝病,在病理上可分为非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝纤维化和肝硬化[1-2]。NASH 以肝细胞脂肪变性、炎细胞浸润及肝细胞气球样变为特点,是NAFLD进程中一个重要的转折点,可加速疾病后续的发展[3]。Toll样受体4(Toll-like receptor 4,TLR4)是TLR 家族中识别病原微生物的重要成员,是介导脂多糖(lipopolysaccharide,LPS)应答最主要的受体,该受体水平的表达不仅在固有免疫和IR 之间起到纽带作用,也在NASH 的肝脏损伤及修复方面发挥着重要作用[4-5]。但目前尚缺乏对NASH 大鼠模型肝脏组织中TLR4基因甲基化水平的研究报道。本文以SD大鼠为研究对象,探讨肝脏中TLR4基因表达与其甲基化水平的相关性,为NASH的临床研究提供基础。
1 材料与方法
1.1 实验动物与分组 健康雄性SD大鼠20只,SPF级,体质量180~230 g,购自北京维通利华实验动物中心,动物许可证号:SCXK(京)2016-0006。大鼠在室温(23±2)℃、30%~40%相对湿度、每天12 h 光照/黑暗环境下饲养。本实验符合动物管理与使用委员会相关指导原则。大鼠适应性喂养1 周后,采用随机数字表法分为正常组与模型组,每组10只。正常组给予普通饮食,模型组给予高脂高糖饮食(68.6%基础饲料、20%猪油、10%蔗糖、1%胆固醇、0.2%胆酸、0.2%丙硫氧嘧啶,30%果糖溶液),于24周后处死,测量大鼠体质量及肝质量,并取各组大鼠血清及肝脏组织,于低温保存。肝指数=肝湿质量/体质量×100%。收集血清及肝脏组织冻存备用。
1.2 主要试剂与仪器 HE染色试剂盒购自北京索莱宝科技有限公司;丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、三酰甘油(TG)、总胆固醇(TC)试剂盒均购自南京建成生物工程研究所;CD68、TLR4、β-actin 兔抗鼠单克隆抗体,羊抗兔IgG均购自武汉博士德生物工程有限公司;SP(小鼠/兔IgG)-POD KIT 购自北京索莱宝科技有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBRPremix Ex Taq购自宝生物工程(大连)有限公司。荧光显微镜(Leica);MK3型酶标仪(芬兰Thermo公司);凝胶电泳仪、电泳槽、凝胶成像分析仪、基因扩增仪、实时定量PCR 仪(Bio-rad);常温离心机(Eppendorf);超微量紫外分光光度计(Thermo)。
1.3 血清指标检测 取正常组与模型组大鼠血清,采用酶联免疫吸附测定(ELISA)法检测大鼠血清ALT、AST、TG 及TC水平,操作严格按照试剂盒说明书进行。
1.4 肝脏组织病理学切片 取大鼠肝脏组织,进行组织观察并制备5 μm 冰冻切片,HE 染色后,观察各组大鼠肝细胞的形态变化、脂肪变性及炎性细胞浸润的情况。
1.5 免疫组化染色法检测肝脏CD68 蛋白的表达 制备大鼠肝脏5 μm冰冻切片,加入CD68(巨噬细胞分子标记物)一抗(1∶1 000),4 ℃孵育过夜,加入二抗,室温孵育1 h后,加入DAB 显色,并用苏木素复染1 min,最后中性树胶封片。在200 倍光镜下,每组取5 张切片,每张随机读取5 个视野。CD68表达阳性为光镜下细胞膜呈棕黄色颗粒。
1.6 蛋白免疫印迹法(Western blotting,WB)检测肝脏TLR4蛋白含量 取肝脏组织200 mg,研磨成组织匀浆,加入适量含有PMSF 的蛋白裂解液,提取组织蛋白,并用BCA 法进行蛋白定量。将蛋白样本上样进行凝胶电泳,电转移至PVDF膜后封闭、加入内参及TLR4 一抗(1∶1 000)孵育,4 ℃过夜,洗涤后加入辣根过氧化物酶标记的二抗孵育,充分洗涤后进行化学发光显影。采用IPP 6.0 软件计算TLR4 与β-actin 条带灰度值的比值,作为其各自的相对表达量。
1.7 实时荧光定量PCR(qPCR)检测肝脏TLR4 mRNA 含量 于液氮中研磨大鼠肝脏组织,Trizol法提取总RNA,通过超微量紫外分光光度计检测RNA 的纯度及浓度。按照逆转录试剂盒说明书获取cDNA,以cDNA 为模板,β-actin 为内参,用SYBR法检测TLR4 mRNA的表达。引物购自上海生工生物工程股份有限公司,序列见表1。PCR反应条件为:预变性95 ℃30 s;95 ℃5 s,60 ℃30 s,共计40个循环。每个样本至少重复3次。以2-ΔΔCT法计算目的基因相对表达量。

Tab.1 The primer sequence of TLR4 and β-actin表1 RT-PCR引物序列
1.8 亚硫酸氢测序PCR(bisulphite sequencing PCR,BSP)法检测肝脏TLR4 基因甲基化水平 在Ensemble 网站上检索TLR4 基因的启动子区域(http://genome.ucsc.edu/)。应用MethPrimer 程 序(http://www.urogene.org/methprimer)预 测TLR4 基因内CpG 岛的特定甲基化位置。TLR4 基因片段中含有4个CpG位点,在序列中的位置已在图1中加粗标记,分别为24、134、224、229。将各组大鼠肝脏组织送往上海生工生物工程股份有限公司完成BSP检测。BSP扩增引物序列见图1,其中带框为设计的引物位置,中间部分为待测序列。
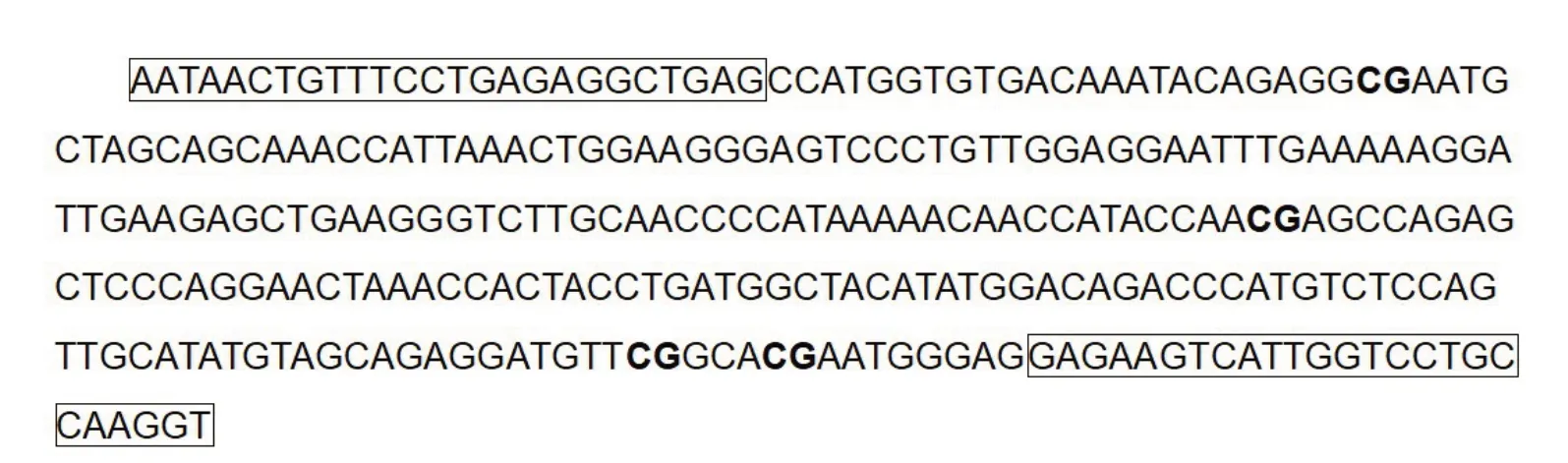
Fig.1 BSP amplification primers and CpG sites in the TLR4 gene fragment图1 BSP扩增引物及TLR4基因片段中CpG位点
1.9 统计学方法 采用GraphPad Prism 8进行统计学处理,计量资料以表示,符合正态分布的数据组间比较采用t检验,相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 肝脏表面及切片观察 肉眼观察,正常组大鼠肝脏颜色偏深红色,肝脏大小、形态如常,包膜光滑清晰,肝缘角较锐;实验24 周末模型组大鼠肝脏颜色淡黄,肝脏偏大,形态饱满,肝缘角变钝,见图2。显微镜下观察HE染色的肝脏切片可发现,正常组肝细胞结构完整,呈放射状排列。与正常组相比,模型组大鼠肝脏组织结构不明显,肝细胞内出现大量脂滴,且肝脏内炎性细胞浸润明显,见图3。
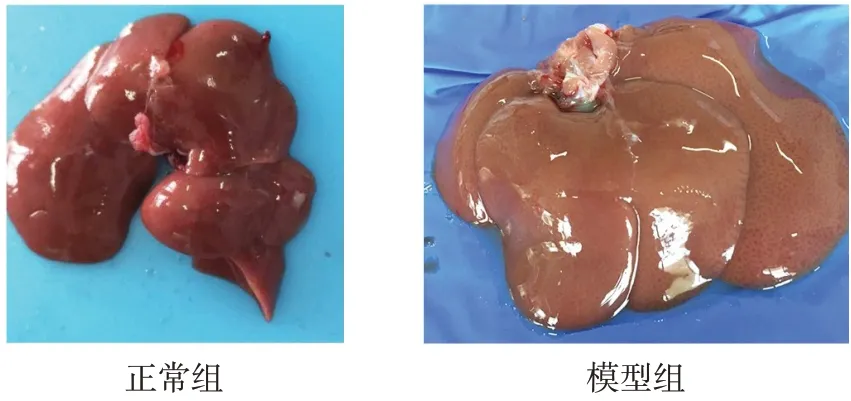
Fig.2 Pictures showing liver surface of normal group and model group图2 正常组与模型组肝脏表面观察
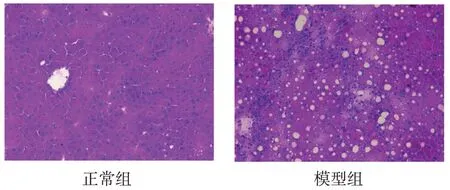
Fig.3 HE staining of normal group and model group(×100)图3 正常组与模型组HE染色(×100)
2.2 2组大鼠肝脏指数及血液检测指标 与正常组相比,模型组大鼠肝指数显著升高,血清中ALT、AST、TC 及TG 水平均明显升高,差异有统计学意义(P<0.05),见表2。
2.3 2 组大鼠肝脏中CD68 蛋白的表达 与正常组相比,模型组棕黄色区域显著增加,肝脏中CD68 蛋白表达明显升高,见图4。
Tab.2 Blood test indicators of normal group and model group表2 正常组与模型组大鼠血液检测指标 (n=10)
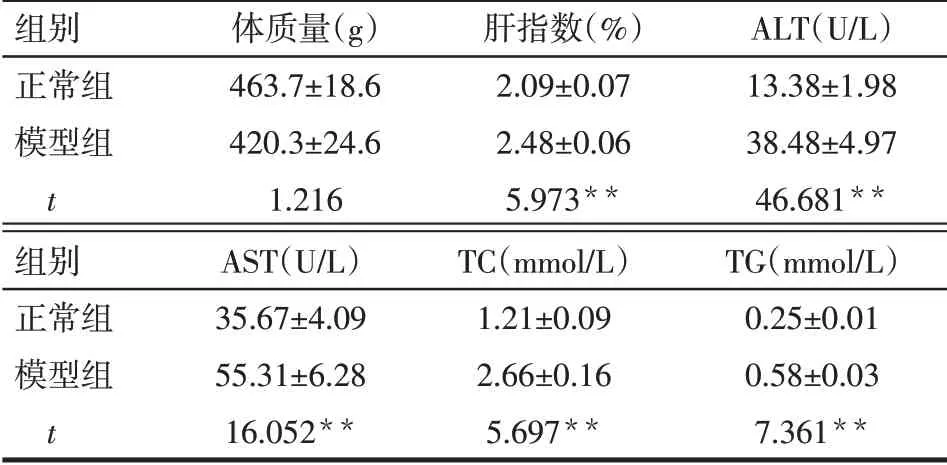
Tab.2 Blood test indicators of normal group and model group表2 正常组与模型组大鼠血液检测指标 (n=10)
**P<0.01
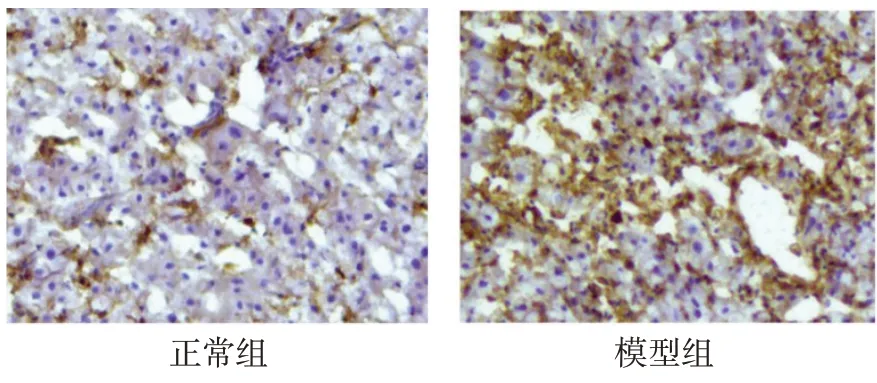
Fig.4 Pictures showing expressions of CD68 protein in liver of normal group and model group(×200)图4 正常组与模型组肝脏CD68蛋白的表达(×200)
2.4 2 组大鼠肝脏中TLR4 蛋白及其mRNA 表达水平比较 与正常组相比,模型组中TLR4蛋白含量及其mRNA 相对含量显著升高,差异有统计学意义(P<0.01),见表3,图5。
Tab.3 Comparison of expressions of relative content of TLR4 protein,TLR4 mRNA and TLR4 gene methylation rates in normal and model rats表3 正常组与模型组大鼠肝脏TLR4蛋白、mRNA表达及TLR4基因甲基化率比较 (n=10)
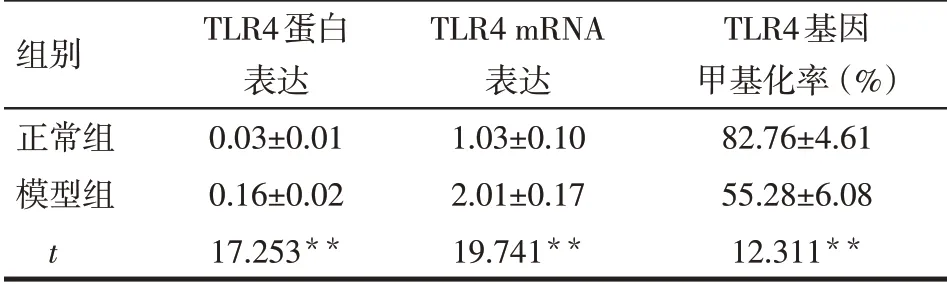
Tab.3 Comparison of expressions of relative content of TLR4 protein,TLR4 mRNA and TLR4 gene methylation rates in normal and model rats表3 正常组与模型组大鼠肝脏TLR4蛋白、mRNA表达及TLR4基因甲基化率比较 (n=10)
**P<0.01
组别正常组模型组t TLR4蛋白表达0.03±0.01 0.16±0.02 17.253**TLR4 mRNA表达1.03±0.10 2.01±0.17 19.741**TLR4基因甲基化率(%)82.76±4.61 55.28±6.08 12.311**
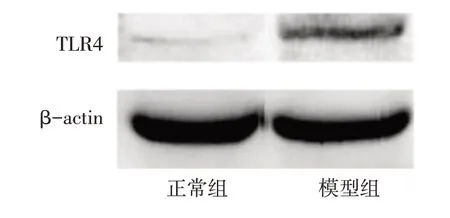
Fig.5 Expressions of relative content of TLR4 protein in liver of normal group and model group图5 正常组与模型组肝脏TLR4蛋白相对含量的表达
2.5 2 组大鼠TLR4 基因甲基化水平比较 BSP 检测结果发现,与正常组相比,模型组大鼠4个甲基化位点中24、134、224及229号甲基化位点甲基化率下降,总甲基化率降低,差异有统计学意义(P<0.01),见图6、7,表3。

Fig.6 Methylation rate of TLR4 gene of rat liver图6 大鼠肝脏TLR4基因甲基化率
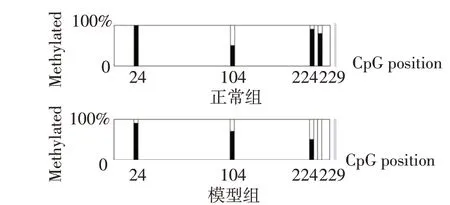
Fig.7 Methylation rates of 4 methylation sites in normal and model groups图7 正常组与模型组4个甲基化位点的甲基化率
2.6 TLR4 基因与甲基化水平的相关性分析 通过对TLR4 mRNA 相对含量与甲基化程度的相关性分析显示,TLR4的甲基化水平与其mRNA相对含量的表达呈负相关(P<0.01),见图8。
3 讨论
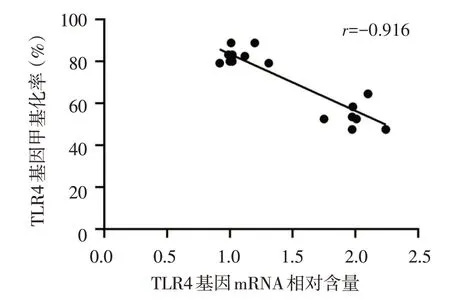
Fig.8 Correlation analysis between TLR4 gene and methylation level图8 TLR4基因与甲基化水平的相关性分析
NAFLD 的发病机制尚未明确,最经典的学说是Day 和James 提出的“二次打击”学说[6]。初次打击主要为IR、脂质代谢异常和肝细胞脂质堆积。第二次“打击”主要包括反应性氧化代谢产物增多,导致脂质过氧化、线粒体功能障碍以及肝细胞发生气球样变和坏死性炎症[7]。最新研究表明,“二次打击”尚不足以描述NAFLD相关联的多种致病途径,而遗传因素、脂质代谢紊乱、IR 及炎症、氧化应激、肝细胞脂肪变性、内质网应激及肠道菌群失调等“多重平行打击”可能是引起NAFLD 的重要原因,其中遗传因素及炎症的产生在NASH发病阶段起到重要致病作用[8]。
NAFLD 的发生、发展受遗传基因的调节。其中表观遗传学DNA甲基化的变化在NASH发病遗传因素中发挥重要作用。营养过剩、运动量过少、压力过大等不健康的生活方式皆可影响DNA 甲基化水平的变化。一项23 例单纯性脂肪肝患者及22 例NASH 患者参加的研究表明,与单纯性脂肪肝患者相比,NASH患者体内线粒体编码的NADH脱氢酶6(NADH dehydrogenase 6,MT-ND6)基因甲基化水平显著升高,且与NAFLD 的严重程度呈正相关,提示线粒体基因的DNA 甲基化水平在NAFLD 的发展和发病机制中起关键作用[9]。NAFLD患者肝脏中过氧化物酶体增殖物激活受体γ(peroxisome proliferatoractivated receptor γ,PPARγ)的表观遗传修饰有助于IR 恢复,同时肝脏PPARγ 共激活因子1α 和线粒体转录因子A 的甲基化水平皆与空腹胰岛素和IR 稳态模型评估相关[10]。虽然DNA 甲基化水平变化在NAFLD 线粒体功能障碍及胰岛素抵抗等方面已被证实发挥了重要作用,但DNA 甲基化与TLR4 的相关研究在NASH 中还鲜见报道,故本研究从经典的炎症相关蛋白TLR4 出发,探讨NASH 中TLR4 的表达与其甲基化水平的相关性。
TLR4由许多免疫和非免疫细胞表达,与机体的损伤和感染信号的识别及转导密切相关,在组织损伤、感染和炎症中起到了“桥梁”作用。研究发现,在高脂饮食诱导的非酒精性脂肪肝小鼠中,富半胱氨酸 蛋 白61(cysteine-rich angiogenic inducer 61,CCN1)蛋白通过TLR4/MyD88/AP-1 信号通路升高明显,进而导致炎症的进展[11]。本课题组前期通过动物实验研究发现,NASH 模型大鼠LPS、肿瘤坏死因子、TLR4、β 干扰素TIR 结构域衔接蛋白(TIR domain containing adaptor protein inducing interferonβ,TRIF)表达明显升高,出现肠源性内毒素血症,大量IR 的触发因子LPS 促使TLR4 表达升高,进而使下游蛋白TRIF 表达升高,激活核内基因,产生大量炎性因子,表明LPS-TLR4-TRIF通路产生炎性因子贯穿于NASH 发病始终[12-13]。CD68 主要表达于单核-巨噬细胞的胞浆蛋白,是巨噬细胞可靠的标记物[14]。通过观察各组大鼠切片中CD68的表达情况,可明显观察到巨噬细胞的变化,使得各组大鼠肝脏组织中TLR4蛋白的表达得到验证。本实验中,模型组CD68表达显著高于正常组,表明模型组中巨噬细胞含量增加,与TLR4的表达相一致。
本实验从表观遗传学角度探讨TLR4 基因甲基化水平在NASH 大鼠模型中表达含量的变化,结果表明,在NASH 发生发展的过程中,TLR4 基因的高表达可能与其甲基化水平的降低有关。本研究有望为NASH的临床研究提供新思路和新方向。
