miR-322对大鼠高原性肺动脉高压的作用及机制研究
2020-08-04张凤涛李晓红王景景孙洪涛陈翀陈锋
张凤涛,李晓红,王景景,孙洪涛,陈翀,陈锋
由于高原低压、低氧环境的影响,长期居住或急进高原人群常常会有不同程度的高原肺动脉高压(high altitude pulmonary hypertension,HAPH)。高原肺水肿与HAPH 联系密切,高原肺水肿是HAPH、肺泡液累积等因素综合作用的结果。研究认为,HAPH是导致高原肺水肿发病的关键因素,是目前常见的一种治疗不及时可致高病死率的呼吸系统疾病,因此深入了解和探究高原病发病机制,对高原病的防治具有重要意义[1]。HAPH 与心血管舒张有密切联系。研究发现,apelin可通过舒张血管来降低肺动脉高压上升程度以缓解HAPH[2]。HAPH 在低压低氧条件下可诱导缺氧诱导因子-1α等因子上调[3],其中miR-322表达上调明显,说明其在HAPH形成中有重要的作用[4]。miRNA 是一类高度保守的非编码RNA,可以抑制mRNA的翻译功能或使其降解[5]。本实验拟使用SD大鼠建立缺氧性肺动脉高压模型,通过腺相关病毒转染封闭miR-322相关序列实现差异性表达,以期阐述miR-322对apelin的影响及调控肺动脉高压的机制。
1 材料与方法
1.1 实验动物与试剂 SPF级雄性SD大鼠40只,8周龄,体质量180~200 g,购自军事医学科学院实验动物中心,许可证号SCXK-(军)2012-0004。大鼠饲养于清洁、通风良好环境,自由摄食、饮水。总RNA提取试剂盒、miRNA提取试剂盒(中国福际公司),逆转录试剂盒(K1622)和apelin 抗体(abcam 公司),α-平滑肌肌动蛋白(α-SMA)抗体(boster公司),辣根过氧化物酶标记山羊抗兔IgG二抗、Alexa 488标记山羊抗小鼠IgG二抗(servicebio公司),Quantscript RTKit和Real Master Mix(Probe)购自天根生化科技有限公司。空载腺病毒以及miR-322-5P封闭腺病毒由和元生物技术(上海)股份有限公司合成。TaqMan探针及引物委托中美泰和公司完成。
1.2 方法
1.2.1 HAPH动物模型建立 40只大鼠以随机数字表法分为常氧组、低氧组、空载体组及miR-322沉默组(n=10),剔除实验过程中死亡大鼠后常氧组10 只,低氧组、空载体组、miR-322沉默组各9只。病毒转染采用气道转染法[6],转染完成后与低氧组相同方法造模。低压氧舱模拟6 000 m海拔高度,舱内大气压47.5 kPa,9.5%~10.1%O2连续低氧培养21 d,制备低氧性肺动脉高压大鼠模型[7],常规饲料喂养;常氧组自由呼吸进食,其他条件相同。
1.2.2 大鼠处理与取材 大鼠饲养21 d后,造模大鼠从低压氧舱中快速取出,与常氧组大鼠均采用异氟烷吸入法麻醉,右心漂浮导管法检测肺动脉压,计算各组大鼠平均肺动脉压(mPAP)并取颈动脉血0.5 mL 进行肺动脉氧分压[p(O2)]检测;放血处死各组大鼠,随机数字表法抽取每组大鼠5 只,取肺组织约100 mg 提取总蛋白用于Western blot 检测,20 mg 提取总RNA,30 mg提取miRNA用于PCR检测。
1.2.3 HE染色观察肺组织形态 肺组织置于10%福尔马林中固定,经梯度乙醇脱水、二甲苯透明、石蜡包埋、切片、HE染色后在光镜下(×200)观察肺组织学形态,每张切片随机读取3个视野。
1.2.4 免疫荧光染色观察α-SMA 表达 石蜡切片经二甲苯、梯度乙醇脱蜡至水,抗原修复,山羊血清封闭,加入α-SMA 一抗,4 ℃过夜,磷酸盐缓冲溶液(phosphate buffer saline,PBS)避光洗涤后孵育二抗,抗荧光淬灭封片剂封片,荧光显微镜下(×400)观察。
1.2.5 实时荧光定量PCR(qPCR)法检测肺组织miR-322以及apelinmRNA 表达 严格按照试剂使用说明书提取总RNA 及miRNA,用TaqMAN 探针法进行qPCR 扩增,每个样本做3 个复孔。以10 倍稀释模板样本进行PCR 反应,反应条件:50 ℃预变性2 min,95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火延伸1 min,共40个循环,以内参照基因(GAPDH)进行相对定量,采用2-ΔΔCt法对结果进行分析,计算miR-322和apelinmRNA表达水平。qPCR引物见表1。

Tab.1 Primer sequence of qPCR表1 qPCR引物序列
1.2.6 Western blot 法检测肺组织apelin 蛋白表达 取约100 mg 肺组织,加入RIPA 裂解液1 mL,冰上研磨制备成匀浆。4 ℃离心10 min,留取上清液并用BCA 法进行蛋白定量。每组取45 μg,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(80 V,100 min)分离后进行转膜、封闭,经封闭后加入apelin一抗(1∶500)4 ℃过夜,次日PBST(含1%吐温-20的磷酸盐缓冲液,PBS-Tween-20)漂洗3 次,每次10 min;加入二抗(1∶5 000),室温摇床1 h后,PBST漂洗3次,每次10 min,加入ECL化学发光剂曝光显影。以目的蛋白与内参GAPDH的灰度值比值代表目的蛋白的相对表达量。
1.3 统计学方法 采用SPSS 16.0 统计软件包进行统计学分析。符合正态分布的计量资料以均数±标准差()表示,多组间比较用单因素方差分析,组间多重比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠p(O2)与mPAP 比较 与常氧组比较,低氧组、空载体组及miR-322 沉默组p(O2)均下降,mPAP 均升高;与低氧组比较,miR-322 沉默组p(O2)上升,mPAP 下降(P<0.05),低氧组和空载体组2指标差异无统计学意义(P>0.05),见表2。
Tab.2 Comparison of oxygen partial pressure and mean pulmonary artery pressure between four groups表2 各组大鼠肺动脉氧分压和平均肺动脉压比较(mmHg,)
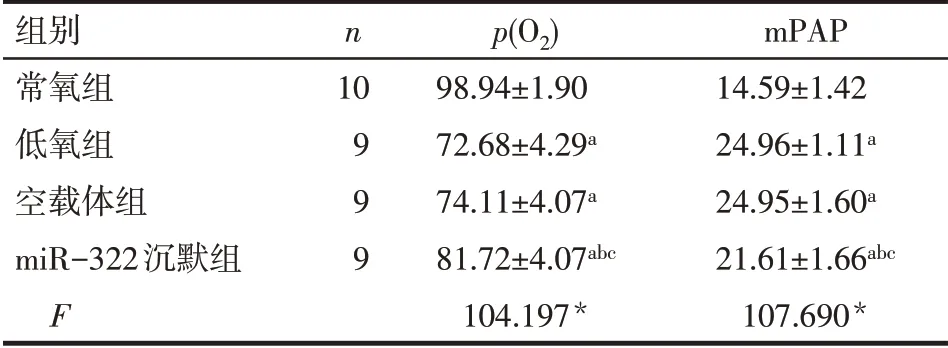
Tab.2 Comparison of oxygen partial pressure and mean pulmonary artery pressure between four groups表2 各组大鼠肺动脉氧分压和平均肺动脉压比较(mmHg,)
*P<0.05;a与常氧组比较,b与低氧组比较,c与空载体组比较,P<0.05;表3同;1 mmHg=0.133 kPa
mPAP 14.59±1.42 24.96±1.11a 24.95±1.60a 21.61±1.66abc 107.690*组别常氧组低氧组空载体组miR-322沉默组F n 10 9 9 9 p(O2)98.94±1.90 72.68±4.29a 74.11±4.07a 81.72±4.07abc 104.197*
2.2 各组肺组织形态学变化 常氧组肺泡间隔正常,组织结构良好。与常氧组比较,低氧组肺泡间隔明显增宽,肺泡及肺间隔可见红细胞,肺泡腔中出现大量炎症细胞,损伤严重,空载组与低氧组损伤程度相似。miR-322 沉默组较低氧组损伤程度降低,见图1。

Fig.1 Comparison of HE staining results between four groups(HE staining,×200)图1 各组大鼠肺动脉形态学变化(HE染色,×200)
2.3 大鼠肺组织α-SMA表达 常氧组肺组织中α-SMA 表达量较低,低氧组较常氧组表达上升,miR-322沉默组较低氧组表达量进一步上升,见图2。

Fig.2 Expressions of α-SMA in lung tissue of four groups(IF,×400)图2 各组大鼠肺组织α-SMA表达情况(免疫荧光,×400)
2.4 各组肺组织miR-322和apelin蛋白及mRNA的表达水平比较 与常氧组比较,低氧组、空载体组及miR-322 沉默组miR-322mRNA 相对表达量、apelin mRNA 和apelin 蛋白相对表达量升高;与低氧组比较,miR-322 沉默组miR-322mRNA 相对表达量降低,apelin mRNA和蛋白相对表达量升高(P<0.05);低氧组与空载体组各指标差异均无统计学意义(P>0.05),见表3、图3。
Tab.3 Comparison of expressions of miR-322,apelin protein and mRNA pairs between four groups表3 各组miR-322以及apelin蛋白和mRNA相对表达水(n=5)
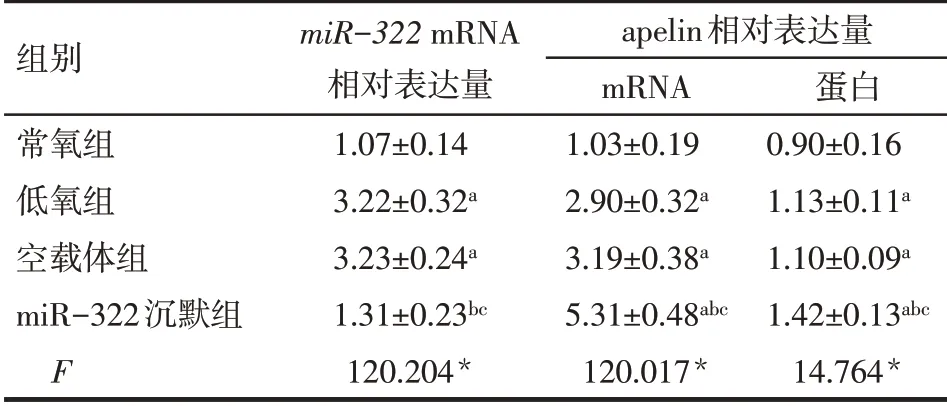
Tab.3 Comparison of expressions of miR-322,apelin protein and mRNA pairs between four groups表3 各组miR-322以及apelin蛋白和mRNA相对表达水(n=5)
组别常氧组低氧组空载体组miR-322沉默组F miR-322 mRNA相对表达量1.07±0.14 3.22±0.32a 3.23±0.24a 1.31±0.23bc 120.204*apelin相对表达量mRNA 1.03±0.19 2.90±0.32a 3.19±0.38a 5.31±0.48abc 120.017*蛋白0.90±0.16 1.13±0.11a 1.10±0.09a 1.42±0.13abc 14.764*

Fig.3 Expressions of apelin protein in lung tissues of each group图3 各组肺组织中apelin蛋白表达情况
3 讨论
急进高原地区的人群由于高原低压和低氧环境的影响,常引起急性高原病。急性高原病以低氧性肺动脉高压引起的急性高原肺水肿最为典型,该病起病急、病情重,救治不及时可造成病死率明显增高。急性高原肺水肿发病机制复杂,体内调控基因及影响因子多,发病机制尚不明确[8-9]。目前,关于高原型肺动脉高压研究发现,apelin可在低氧或缺氧条件下扩张心血管以减轻肺动脉压上升程度[10-11],但大多是在蛋白水平上的研究和探讨,近几年关注于基因水平上探究肺动脉高压的调控机制。miRNA不同基因在不同程度上参与了肺动脉高压的调节[12]。不同的肺动脉高压模型引起的miRNA 表达效果有差异,多种miRNA 如miR-145/143、miR-23b等[13-14]均可影响肺动脉高压的调节,导致肺动脉重塑。但是在高原肺动脉高压发病过程中apelin的调控机制仍不清楚。
本实验中21 d的低压低氧干预使大鼠形成了典型的肺动脉高压,与以往实验研究中的大鼠肺动脉高压的结果一致[7]。本研究结果显示,与常氧组比较,低氧组mPAP、α-SMA、apelin 蛋白以及miR-322mRNA 相对表达量均升高,p(O2)下降,肺组织破坏严重,可见大量炎症细胞浸润。与低氧组相比,miR-322 沉默组mPAP 以及miR-322mRNA 相对表达量均下降,α-SMA、p(O2)、apelin 蛋白相对表达量上升,miR-322 沉默组肺组织损伤程度减轻,表明miR-322mRNA可通过抑制apelin的表达,从而使肺动脉压上升,在miR-322被抑制后,apelin表达上升,降低了肺动脉压上升程度,同时减轻了肺组织的损伤,提示在高原型肺动脉高压中,miR-322 低表达可以上调apelin蛋白的表达,这与Zhu等[10-11]研究结果一致。HE染色结果显示,低氧组肺组织损伤严重,而miR-322沉默组中肺组织损伤明显减轻;免疫荧光结果表明,apelin 高表达可以促进α-SMA 表达,增加血管扩张程度,缓解肺动脉压的上升并且降低血管增厚程度,这与HE结果一致,再次证实miR-322抑制了apelin的表达,内源性apelin 可以舒张血管,增加平滑肌活跃性,这一点不同于吴媛媛等[15]外源性apelin 作用效果结论,该研究认为在临床上要尽可能避免使用外源性apelin 治疗高原肺动脉高压。
综上,大鼠高原型肺动脉高压模型大鼠肺组织中miR-322 和apelin 表达明显升高,在抑制miR-322 后,apelin表达进一步升高,miR-322可能通过降低肺组织内源性apelin 蛋白的表达,降低了机体的血管扩张反应,不利于机体适应高原性气候的生活。
