胰源性门脉高压症32例临床分析
2020-08-03杨益波余保平
杨益波, 余保平
武汉大学人民医院消化内科,湖北 武汉 430060
胰源性门脉高压症(pancreatic portal hypertension,PPH)是一种不常见的疾病,具有多种潜在原因[1-2],占所有门静脉高压症患者5%左右[3]。患者的肝功能一般不受影响,但胃和/或食管静脉曲张是常见的,上消化道出血(upper gastrointestinal bleeding,UGIB)可能是危及生命的临床表现[2-3]。然而,许多患者是无症状者有非特异性腹痛。胰腺炎症或肿瘤性疾病是PPH的主要原因。可以通过内镜治疗控制出血。脾动脉栓塞或脾切除术的确定性治疗往往被认为是必要的,但无症状的PPH患者是否应用仍存在争议[4]。本研究分析了一组连续性PPH患者的临床表现、病因和预后,总结了与UGIB风险相关的潜在因素。
1 资料与方法
1.1 一般资料在这项单中心研究中,收集我院10年期间(2008年7月至2018年7月)所有PPH患者的诊疗记录,并进行回顾性分析。PPH的诊断基于Wang等[4]先前遵循的标准:(1)胰腺病理学的存在;(2)门静脉高压症的临床、内镜或实验室证据,包括脾静脉和/或脾肿大的全部或部分闭塞;排除门静脉高压症的其他原因,如肝硬化;(3)对临床、影像学和实验室提示的肝硬化患者立即被排除在进一步的分析之外。
1.2 方法本组病例的临床表现、相关病症、实验室数据、诊断评估、生存和结果均从医疗记录中检索。记录患者的一般资料、临床表现和实验室检查结果、治疗、预后,进行相关因素分析。随访是基于患者病史(5个月~7年)的最后一次临床评估,同时参考了与PPH相关的影像学检查报告。

2 结果
2.1 临床资料在10年期间,共收集到32例PPH患者,男25例,女7例,年龄(57.3±10.2)岁,其中20例(62.5%)为无症状或非特异性腹部疼痛;12例(37.5%)表现为UGIB。7例(21.9%)患者体格检查发现有脾肿大(见表1)。
2.2 病因在所有PPH患者中,慢性胰腺炎最多,有18例(56.3%),胰腺癌6例(18.8%),胰腺假性囊肿4例(12.5%),急性重症胰腺炎2例(6.3%),胰腺手术2例(6.3%)(见表1)。
2.3 实验室检查所有病例血常规检查血小板计数(中位数,范围)[201.5(66~437)×109L-1];5例患者发现有血小板减少症(见表1)。大便常规:大便隐血试验(OB)为阳性12例(37.5%);小便常规、肝肾功能基本正常;肝炎全套均为阴性。

表1 临床和实验室数据
2.4 特殊检查32例患者均行胃镜检查,其中还对17例患者(53.1%)进行了超声内镜检查,确认了所有胃肠静脉曲张。腹部成像用于所有患者,CT扫描86.4%(28例)(见图1);多普勒超声50.0%(16例)。在成像评估中,无肝脏改变提示肝硬化或门静脉异常。20例(62.5%)患者完善了血管造影检查,结合以上检查发现孤立性胃底静脉曲张18例(56.3%),孤立性食管下段静脉曲张5例(15.6%),两者皆有9例(28.1%)。发现脾静脉阻塞5例(15.6%)。
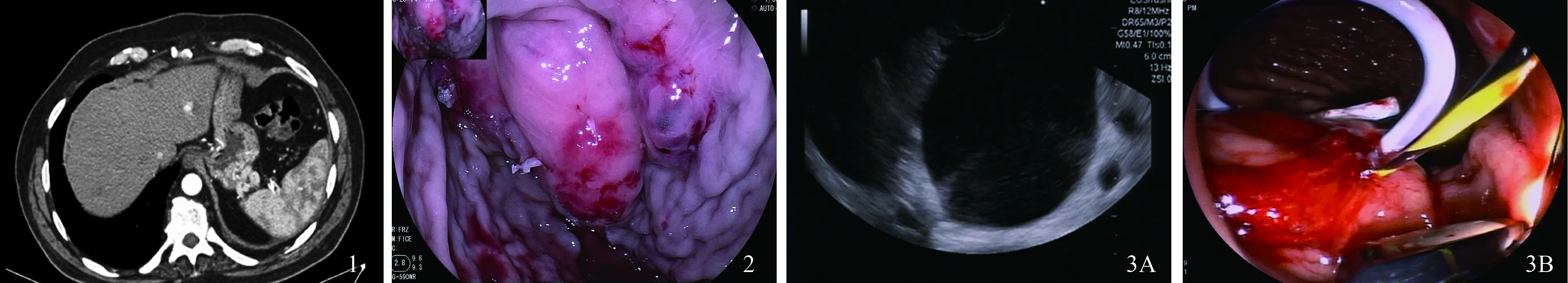
图1 CT图像显示脾肿大和脾静脉曲张;图2 内镜下可见:贲门-胃底-胃体:可见大量新鲜血凝块,考虑为近期出血部位,胃底静脉部曲张延伸至胃体中部大弯侧,呈蔓枝状改变,行内镜下行硬化剂治疗;图3 超声内镜结果 A:超声内镜下胰腺假性囊肿;B:超声内镜下胰腺假性囊肿引流术
2.5 治疗及转归本组病例中12例(37.5%)伴UGIB患者接受了内镜止血治疗,其中8例(25.0%)患者行内镜下曲张静脉结扎(EVL),4例患者选择了氰基丙烯酸酯内镜下止血(见图2),随后在胃镜评估中无活动性出血,采用了观察等待策略。8例(25.0%)患者进行脾动脉栓塞,其中2例行脾栓塞术后进行了胸腔镜切除术。3例(9.4%)患者也进行了手术治疗(脾切除术或假性囊肿引流术)(见图3)。5例患者(15.6%)使用抗凝药物(低分子量肝素和/或华法林)进行药物治疗。中位随访时间为40个月(5个月~7年)。4例(12.5%)患者死亡,其中3例死于胰腺癌复发,另1例死于与PPH无关的感染性并发症。其余患者预后良好,无来自其他地方或病因的胃肠出血记录。无其他因素预测UGIB风险增加。
3 讨论
PPH是一种由胰腺原发疾病引起脾静脉阻塞导致的局限性、区域性、左侧门静脉系统压力升高的门脉高压症。脾静脉伴行或紧贴胰腺背面,与脾动脉伴行走行于胰体尾的后方。脾静脉的血栓形成(splenic vein thrombosis,SVT)或受压闭塞而引起脾静脉血液回流受阻,引起左侧门静脉系统的压力增高。胰腺疾病常常是脾静脉血栓形成或闭塞的主要原因[2,4],在本研究中,胰腺炎最多,其中18例(56.3%)为慢性胰腺炎,2例(6.3%)为急性胰腺炎;胰腺肿瘤6例(18.8%);胰腺假性囊肿4例(12.5%);胰腺手术2例(6.3%)。在周冰等[5]报道的28例PPH患者中16例患者有胰腺炎病史,其中14例为慢性胰腺炎,2例为急性胰腺炎。胰腺炎症发作时可使胰腺腺泡破坏释放大量胰液和炎症介质使脾静脉血流淤滞、血管内膜损伤、血管痉挛,致使脾静脉血栓形成或闭塞。胰腺炎后胰腺的包裹性坏死可形成胰腺假性囊肿直接压迫脾静脉导致脾静脉血液回流受阻,进而导致PPH的发生[6]。胰腺肿瘤与胰腺炎症引起的广泛性血管病变不同,多以局部血管改变为主。良性肿瘤以局部压迫脾静脉致使静脉闭塞为主,而恶性肿瘤除可引起局部压迫外,恶性肿瘤细胞的直接浸润脾静脉导致脾静脉阻塞,引起PPH。前者预后良好而后者预后差。2例患者有胰腺手术史,但根据医学记录,手术前尚未出现PPH。胰腺手术可导致PPH,在其他文献中也有报道[7-8]。脾静脉结扎可能是医源性PPH的原因。在病理生理上,结果与脾静脉完全闭塞相同,脾静脉系统的压力增加,通过脾静脉与胃或胃网膜静脉之间的吻合传递,导致胃或胃食管静脉曲张。
PPH的临床表现为胃底和/或食管静脉曲张、脾脏肿大、脾功能亢进、无症状或非特异性腹痛(与原发疾病相关)。当脾静脉阻塞后,脾静脉的属支静脉血流通过侧支循环回流至门静脉,其中经胃短静脉途径最为重要侧支循环途径,也是最常见的代偿途径,是形成孤立性胃底静脉曲张的基础[9]。本研究中所有患者均有胃底和/或食管静脉曲张,这可能是导致消化道出血的原因。本研究中有18例(56.3%)患者有孤立性胃底静脉曲张,5例(15.6%)有孤立性食管下段静脉曲张,两者皆有9例(28.1%)。其中12例(37.5%)患者伴有消化道出血。通常情况下,食管静脉曲张不像胃底静脉曲张那么常见,因门静脉主干的压力是正常的,脾静脉阻塞后,血液引流通过胃冠状静脉。只有当胃冠状静脉在脾静脉阻塞远端排出时,才会出现胃底和食管静脉曲张合并[10-11],本研究中大多数患者无症状或表现为非特异性上腹部疼痛,少于40%患者患有UGIB。在另一项回顾性研究中,只有15%的脾静脉血栓形成患者出现静脉曲张出血[12]。一项针对慢性胰腺炎患者的前瞻性研究显示,只有8%患有脾静脉血栓形成,其中大多数患者未出现任何形式的症状性胃肠道出血[13]。Köklü等[11]研究24例PPH患者,慢性腹痛也是最常见的症状,仅有8例患者有UGIB史。根据文献显示,45%~72%的PPH患者因静脉曲张破裂而出现UGIB,25%~38%患有腹痛[2,11,14]。PPH患者常伴有脾肿大。在本研究中,只有7例患者有脾脏肿大,5例有血小板减少,肝功能正常。一些研究报道脾脏肿大在PPH患者中是普遍的,但在其他报道中并未发生这种情况[4,10-11]。
PPH的诊断方法包括多普勒超声、钡餐、食管胃十二指肠镜检查、内镜超声、CT和MR成像等检查。本组病例中,32例患者均行胃镜检查,其中还对17例患者(53.1%)进行了超声内镜检查,确诊了所有胃/食管静脉曲张。腹部成像用于所有患者。在成像评估中,无肝脏改变提示肝硬化或门静脉异常。20例(62.5%)患者完善了血管造影检查,结合以上检查发现孤立性胃底静脉曲张18例(56.3%),孤立性食管下段静脉曲张5例(15.6%),两者皆有9例(28.1%)。发现脾静脉阻塞5例(15.6%)。另外,CT、US和MR成像还可对更深的壁内和胃周围的静脉曲张、正常肝实质、脾肿大和脾静脉血栓进行可视化。胃静脉曲张通常在CT上被认为是胃底后内侧壁上增强的,清晰的,圆形或管状的密度。虽然超声内镜检查、磁共振血管造影日益普及,但脾静脉的血管造影是诊断的金标准[15-20]。
PPH是导致门脉高压的罕见的可治愈的综合征之一。在治疗原发疾病的基础上,本病的治疗包括:抗凝治疗、手术治疗、内镜下治疗、介入治疗和保守治疗。手术治疗是针对主要病因的手术矫正结合脾切除术[10-21]。介入治疗主要有脾动脉栓塞术,其目的是实现部分栓塞,在保持其免疫功能的同时减少流向脾脏的血流量。我们确定了7例脾肿大的患者,5例患者有脾功能亢进。其中3例接受了脾动脉栓塞和/或脾切除术。在内镜手术失败后,脾切除术或脾栓塞术是一种挽救UGIB患者生命的手术[22]。然而并非所有PPH患者都会出现出血并发症。Agarwal等[12]报道称,尽管在研究中有22%的慢性胰腺炎患者具有脾静脉血栓形成的影像学证据,但只有15%的患者出现胃肠道出血。无症状患者比有症状患者的治疗更有争议,一些研究认为脾切除术是预防出血的措施,也有人认为对患者的存活率无任何好处[12]。更多的证据表明,在无症状患者病情可以持续追踪观察[23-24]。Köklü等[11]在入院时出现胃肠道出血的6例患者中也未发现再次出血的病例,只有1例患者接受脾切除术。脾脏的血管栓塞手术可能与严重的并发症有关,如部分胃和/或胰腺梗塞、脾破裂、急性胰腺炎、胸腔积液、肺不张、败血症和所谓的“梗塞后综合征”,以腹痛、白细胞增多和发热及脾脓肿为主要临床表现[25-26]。本研究患者未出现严重的并发症。另外,朱军等[27]报道对4例PPH伴有消化道出血的患者行脾静脉支架置入术,实现脾静脉血管再通。术后短期随访(12个月)未发现消化道出血,胃底曲张静脉明显减少、血小板数目增加、脾脏体积较术前缩小。这可能是一项有前景的治疗方法。以前研究指出,随着内镜治疗的使用,静脉曲张根除的成功率提高[28]。内镜下治疗包括内镜下止血夹止血治疗和硬化疗法,对于急性大出血的患者是一种非常有效的方法。本研究中12例(37.5%)UGIB患者接受了内镜治疗。8例(25.0%)患有食管静脉曲张破裂出血的患者后来被纳入内镜下曲张静脉结扎(EVL)方案,4例(12.5%)患者选择了氰基丙烯酸酯内镜下止血。对内脏静脉系统血栓形成的患者进行抗凝治疗并不一致,必须考虑消化道出血的风险。在32例PPH患者中,只有少数患者接受口服治疗或肠外抗凝治疗,抗凝治疗的信息有限。理论上所有患有炎性或肿瘤性静脉血栓形成的患者均应进行抗凝治疗,但对于所有静脉曲张的患者,很难确定出血风险。在这种情况下,抗凝治疗可能只能在氰基丙烯酸酯栓塞后开始。但这种方法不是无风险的,并且很难在无症状患者中采用这种方法。综合这些结果,我们建议对PPH患者采取谨慎的治疗方法。即使是有症状,因为血管造影的好处或其外科干预可能会被其风险所抵消。
本研究有一些必须强调的重要局限性:这是一项回顾性分析,其中包括最近和以前诊断为PPH的患者。因此,可能存在一些包容性偏倚,但鉴于每年诊断为PPH的患者数量较少,很难进行前瞻性研究;本研究中无关于PPH年发病率的真实数据。它也不是所有地区的代表。因为只包括在消化科的PPH患者。如果结合有关所有患者遗传性血栓形成倾向与脾梗死的数据会更有意义。
预后:PPH的总体预后明显依赖于原发疾病,但在恶性原发疾病的病例中预后较差,因为脾静脉受累系晚期的恶性肿瘤浸润所致[29]。本组病例中有4例(12.5%)患者死亡,3例死于胰腺癌,另1例死于与PPH无关的感染性并发症。其余患者预后良好,无来自其他地方或病因的胃肠出血记录。无其他因素预测UGIB风险增加。
PPH通常与胰腺疾病有关,急性或慢性胰腺炎是主要病因。大多数患者无症状,消化道出血和脾脏肿大是PPH最重要的临床表现,有胰腺病史合并UGIB的患者在临床上应考虑PPH,其结果与胃食管周围的静脉回流受阻有关。对于患有UGIB和/或脾脏肿大的患者,主张进行手术和/或血管内治疗,特别是对于大量UGIB而内镜手术失败者。但在其他的情况下应采用保守的方法。抗凝治疗不是必须的,应根据具体情况加以考虑。
