TLR4/NF-κB/COX-2致炎信号通路对幽门螺杆菌相关性慢性萎缩性胃炎发生、发展的影响及机制研究
2020-08-03黎慧娟唐畅宇
黎慧娟,陈 露,唐畅宇
湖南省第二人民医院消化内科,湖南 长沙 410007
慢性萎缩性胃炎(chronic atrophic gastritis, CAG)是指临床上患者胃黏膜上皮和腺体发生萎缩,胃黏膜变薄,同时伴有幽门腺化生和肠腺化生的一类慢性消化系统疾病[1-2]。目前,临床上关于CAG的主要病因可能是环境因素和宿主因素的长期协同参与作用结果,其中与幽门螺杆菌(Helicobacter pylori,H.pylori)感染密切相关,而长期慢性炎症是诱发胃癌的主要病理基础,炎症反应持续激活也是胃癌的重要特征[3]。TLR4/NF-κB/COX-2致炎信号通路是参与临床多种炎性疾病的重要通路,在慢性萎缩性胃炎发生、发展过程中,TLR4/NF-κB/COX-2致炎信号通路的失调与疾病发生密切相关[4-5]。临床上CAG的发生、发展是一个多基因参与、多通路协同调控的复杂网状调控过程,深入研究CAG发生、发展的炎症相关分子调控机制,不仅具有进一步理解CAG发病分子机理的理论意义,还可能为临床早期诊断、预防和治疗提供新策略。
1 资料与方法
1.1 一般资料选取2017年6月至2018年7月我院消化内科收治的经临床胃镜和组织病理学活检确诊为H.pylori相关性慢性胃炎患者79例为本次研究对象,男42例,女37例。上述患者依据是否发生胃萎缩分为萎缩性胃炎组(40例)和非萎缩性胃炎组(39例)。另选取我院同时期健康体检者39名作为正常组,男20名,女19名。受试对象的临床前一般资料如年龄、性别、BMI指数等差异均无统计学意义(P>0.05)(见表1),具有临床可比性。
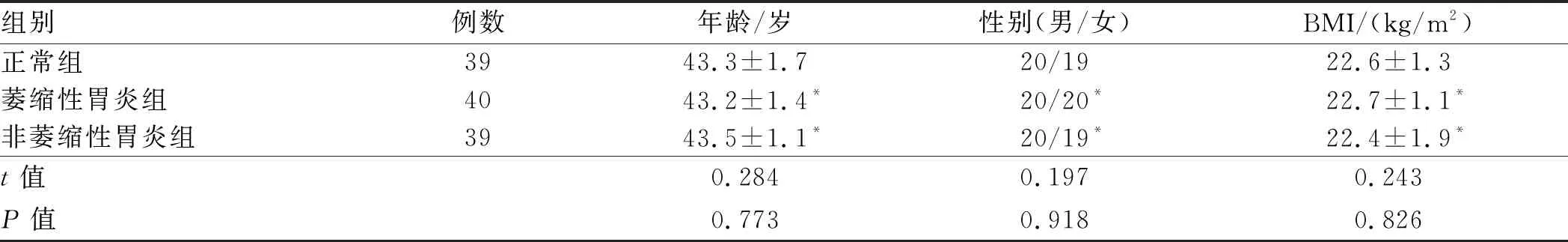
表1 受试对象的一般资料比较
1.1.1 纳入标准:① 经临床胃镜和组织病理学检测诊断为H.pylori相关性慢性胃炎患者;② 患者均具备完整的临床一般检查资料,自愿参与本研究,并于术前签署知情同意书。
1.1.2 排除标准:① 患者伴有其他重要脏器疾病,如心血管功能障碍、内分泌疾病史以及肿瘤病史者;② 患者目前正在服用其他疾病治疗药物或于术前6个月使用过激素治疗;③ 不情愿参与本研究的患者。
1.2 研究方法
1.2.1 组织病理学检查:受试对象胃黏膜病理组织学损伤严重程度判断依据《慢性胃炎及上皮性肿瘤胃黏膜活检病理诊断共识(2017)》和《胃炎的分类和分级:悉尼系统修正版》,于胃镜下选择病变部位,需评估黏膜萎缩、肠上皮化生和不典型增生等组织学变化。每种组织学变化评估程度分为无、轻度、中度和重度4级[6-7]。
1.2.2H.pylori感染诊断及严重程度判定标准:胃镜下分别取观察受试对象的胃黏膜黏液层、表面上皮、小凹上皮标本组织学染色或涂片检查H.pylori感染情况。H.pylori感染诊断及严重程度判定标准如下:无:特殊染色片上未见H.pylori;轻度:偶见或小于标本全长1/3有少数H.pylori;中度:H.pylori分布超过标本全长的1/3但低于2/3;重度:H.pylori基本分布于标本全长[8]。
1.2.3 qRT-PCR法检测胃黏膜组织中TLR4、NF-κB p65和COX-2 mRNA水平:通过胃镜获取受试对象的胃黏膜病理组织并采用Trizol裂解液提取组织总RAN。采用Epoch紫外分光光度计对上述RNA样本进行浓度检测;采用Takara公司5×PrimeScript RT Master Mix反转录试剂盒进行反转录;随后采用Takara公司2×SYBR Premix Ex Taq Ⅱ进行实时定量PCR,检测患者胃黏膜组织中TLR4、NF-κB p65和COX-2 mRNA水平。TLR4:Forward:5′-TTGAGCAGGTCTAGGGTGATTGAAC-3′,Reverse:5′-ATGCGGACACACACACTTTCAAATA-3′;NF-κB p65:Forward:5′-AGGCGTCAAGGGATT-3′,Reverse:5′-GCGTCCATCCATGATAC-3′;COX-2:Forward:5′-TTCAAATGAGATTGTGGGAAAAT-3′,Reverse:5′-AGATCATCTCTGCCTGAGTATCTT-3′;GAPDH:5′-AAGGTCGGAGTCAACGGATT-3′,Reverse:5′-CATGAGTCCTTCCACGATAC-3′[9-10]。
1.2.4 Western blotting法检测胃黏膜组织中TLR4、NF-κB p65、COX-2蛋白水平:通过胃镜获取受试对象的胃黏膜病理组织,加入RIPA裂解液提取总蛋白。采用BCA法进行蛋白定量。随后取30 μg蛋白进行SDS-PAGE凝胶电泳和转膜。裁剪目的蛋白条带并采用质量浓度为50 g/L脱脂奶粉溶液室温封闭1 h。分别加入TLR4、NF-κB p65、p-NF-κB p65、COX-2和GAPDH人源单克隆抗体(1∶1 000稀释),4 ℃孵育过夜。次日,PBST洗涤目的蛋白条带,加入HRP标记抗人源IgG二抗室温孵育2 h。PBST洗涤3次,后进行ECL化学发光。采用Bio-Rad凝胶成像系统分析目的条带。
1.2.5 相关性分析:采用Pearson相关性分析萎缩性胃炎组患者胃窦、胃体、全胃不同胃黏膜萎缩病变程度与H.pylori感染和TLR4、p-NF-κB p65及COX-2表达的相关性。

2 结果
2.1 3组胃黏膜病理组织学变化情况对比3组胃黏膜病理组织学变化情况见表2。与正常组比较,萎缩性胃炎组和非萎缩性胃炎组患者的胃黏膜组织病理损伤明显加重,且萎缩性胃炎组较非萎缩性胃炎组更明显,差异有统计学意义(P<0.05)。

表2 患者的胃黏膜病理组织学变化情况对比
2.2 3组胃黏膜组织H.pylori感染严重程度对比本研究中正常组未发生H.pylori感染,即其H.pylori感染率为0。萎缩性胃炎组和非萎缩性胃炎组患者的胃黏膜病理组织H.pylori感染率分别为97.5%和66.67%,表明二者的H.pylori感染明显加重,且萎缩性胃炎组较非萎缩性胃炎组感染更严重,差异有统计学意义(χ2=10.873,P=0.004)。
2.3 qRT-PCR检测结果3组胃黏膜病理组织中TLR4、NF-κB p65、COX-2 mRNA表达水平见图1。结果显示,萎缩性胃炎组和非萎缩性胃炎组患者的胃黏膜组织中TLR4、NF-κB p65、COX-2 mRNA表达水平较正常组均显著上调,且萎缩性胃炎组较非萎缩性胃炎组表达明显增加,差异有统计学意义(P<0.05)。

注:与正常组比较,*P<0.05,**P<0.01;与萎缩性胃炎组比较,△P<0.05。
2.4 Western blotting检测结果3组胃黏膜病理组织中TLR4、NF-κB p65、p-NF-κB p65和COX-2蛋白表达水平见图2。结果显示,萎缩性胃炎组和非萎缩性胃炎组患者的胃黏膜组织中TLR4、p-NF-κB p65和COX-2蛋白表达水平较正常组均显著上调,且萎缩性胃炎组较非萎缩性胃炎组表达明显增加,差异有统计学意义(P<0.05),而NF-κB p65无明显变化(P>0.05)。

注:与正常组比较,*P<0.05,**P<0.01;与萎缩性胃炎组比较,△P<0.05。
2.5 Pearson相关性分析结果采用Pearson相关性分析结果显示,萎缩性胃炎组患者胃窦、胃体、全胃不同胃黏膜萎缩病变程度与H.pylori感染和TLR4、p-NF-κB p65及COX-2的表达呈正相关(P<0.05)(见表3)。

表3 Pearson相关性分析萎缩性胃炎组患者病变程度与H.pylori感染和TLR4、p-NF-κB p65和COX-2表达的相关性
3 讨论
CAG是一种胃癌的重要癌前病变,其临床主要特点为胃腺正常结构丧失,并伴有肠上皮化生[11]。近年来,大量研究表明,CAG患者胃黏膜存在持续性、反复性炎症反应,进而激活机体免疫反应和多种致炎信号通路。随着对CAG发病机制的研究深入,CAG的防治越来越受到人们的关注[12]。然而,目前临床上针对CAG的有效治疗途径除了通过根除H.pylori、抑制胃酸分泌和非甾体抗炎药物治疗等外,还无更有效的治疗手段[13-14]。既往研究表明,TLR4/NF-κB/COX-2致炎信号通路的失调与CAG的发生密切相关,CAG是有多基因参与、多通路协同调控的复杂网状调控过程[15]。研究人员通过抑制TLR4/NF-κB/COX-2信号通路,发现CAG大鼠胃黏膜损伤明显改善,提示有效抑制TLR4/NF-κB/COX-2信号通路有望减轻胃黏膜炎症反应,进而为阐明CAG发病分子机理及为临床早期诊断、预防和治疗提供新策略和实验依据[16]。
Toll样受体(Toll-like receptor, TLRs)是一类著名的模式识别受体家族,在库普弗细胞(Kupffer cells)等一系列细胞类型中表达[17-18]。在CAG发生、发展过程中,胃黏膜上皮细胞坏死会释放ATP、线粒体DNA等细胞成分,以及高迁移率基因(HMGB1)等分子,这些分子被认为是损伤相关的分子模式(damage-associated molecular patterns, DAMPs),进而可触发TLRs下游效应[19]。TLRs信号激活能通过介导下游NF-κB炎性信号通路的磷酸化活化,进而促进炎性细胞生产并释放促炎细胞因子和细胞介质如TNF-α、IL-6和COX-2[20]。COX-2是环氧合酶(COX)家族重要成员,研究表明COX-2可参与多种因素诱导的炎性反应病理过程,COX-2过表达可通过不同途径参与炎症的发展[21]。其中细胞因子与CAG的发展有关。炎性细胞释放各种细胞因子如IL-6和IL-12等,进而诱导COX-2的产生,提示不同因素导致的TLR4/NF-κB/COX-2致炎信号通路的功能异常可能与消化系统疾病尤其以CAG病变相关[22]。
本研究通过对2017年6月至2018年7月我院消化内科收治的经临床胃镜和组织病理学活检检查确诊为H.pylori相关性慢性胃炎的79例患者和同时期于我院体检的健康体检者39名进行分析,通过观察三组受试对象的组织病理学变化与H.pylori感染情况,以及三组受试对象胃黏膜组织中TLR4、NF-κB p65、COX-2 mRNA和蛋白表达情况,探究TLR4/NF-κB/COX-2致炎信号通路对H.pylori相关性慢性萎缩性胃炎发生、发展的影响及机制。上述研究结果显示,与正常组比较,萎缩性胃炎组和非萎缩性胃炎组患者的胃黏膜组织病理损伤显著且H.pylori感染加剧,且萎缩性胃炎组较非萎缩性胃炎组更明显,差异有统计学意义。qRT-PCR法和Western blotting法检测结果显示,萎缩性胃炎组和非萎缩性胃炎组患者的胃黏膜组织中TLR4、NF-κB p65和COX-2表达较正常组均显著上调,且萎缩性胃炎组较非萎缩性胃炎组上调明显,差异有统计学意义。此外,Pearson相关性分析结果显示,萎缩性胃炎组患者胃窦、胃体、全胃不同胃黏膜萎缩病变程度与H.pylori感染和TLR4、p-NF-κB p65及COX-2的表达呈正相关。慢性萎缩性胃炎患者胃黏膜组织中TLR4/NF-κB/COX-2致炎信号通路的异常活化与疾病发生、发展显著相关,可用于CAG患者早期筛查及患者胃黏膜萎缩病变程度的预测指标,对慢性萎缩性胃炎的早期发现和防治具有重要临床意义和价值。
综上所述,TLR4/NF-κB/COX-2致炎信号通路在H.pylori相关性CAG的恶性演变过程中发挥重要作用,对TLR4/NF-κB/COX-2致炎信号通路的深入研究可为H.pylori相关性CAG患者的临床治疗提供新靶点和理论依据。
