miR-21靶向调控TET1促进结直肠癌HCT15和HT29细胞增殖、侵袭及迁移
2020-08-03梁国刚林丽丽王豆豆
梁国刚, 林丽丽, 王豆豆
青岛市第八人民医院,山东 青岛 266000
结直肠癌是胃肠道中常见的消化道恶性肿瘤,早期诊断率低、复发转移率高,其发病率和死亡率在消化系统恶性肿瘤中仅次于胃癌、食管癌和原发性肝癌[1]。目前,尚缺乏针对结直肠癌有效的治疗手段,科学家一直致力于其发生、发展的分子机制和关键调控因子研究,试图为结直肠癌的发生、转移寻找有效的生物标志物,制定更好的诊疗策略。microRNA(miRNA)是一段非编码的单链小RNA,可以与目标mRNA的3′-UTR区配对结合,降解目标mRNA表达或抑制mRNA的翻译,参与基因表达的调控[2]。有研究发现,miR-21可以通过调控多个靶向基因位点,对细胞的增殖、凋亡、周期转化、侵袭及迁移等能力产生影响[3-4],其潜在的作用靶点还有待进一步研究发掘。DNA甲基化通过抑制某些抑癌基因的表达影响肿瘤的进程,而DNA去甲基化则可以激活某些癌基因或抑癌基因的表达。TET1作为TET家族(ten eleven translocation)的一员,通过催化5-甲基胞嘧啶(5-mc)转化为5-羟基甲基胞嘧啶(5-hmc),进而引起DNA的主动去甲基化过程,可以使被甲基化而沉默的基因重新活化并表达[5-6]。在多项研究中,TET1被报道作为肿瘤抑制因子,在多种癌症中表达缺失或下调,然而,导致结直肠癌中这一重要的肿瘤抑制因子下调的机制仍需进一步阐明。本文利用生物信息学手段预测miR-21的靶基因为TET1,双荧光素酶实验进行验证,利用qRT-PCR研究肿瘤组织中miR-21及TET1的表达情况,利用体外细胞转染实验研究miR-21与TET1的调控关系以及miR-21对结直肠癌细胞的增殖、侵袭及迁移行为的影响,旨在初步阐明miR-21调控结直肠癌发生、发展的分子机制。
1 材料与方法
1.1 研究材料收集2017-2018年经青岛市第八人民医院确诊并进行根治术的结直肠癌患者40例,所有患者手术前均未接受过新辅助放疗或化疗,且均已签署知情同意书,实验方案经伦理委员会批准。取其肿瘤组织及与之配对的肿瘤组织边缘正常结直肠组织(距癌组织5 cm以上,经病理证实无癌组织浸润),组织取出立即置于液氮中冻存用于后续实验分析。人结直肠癌细胞株HCT15和HT29购自中国科学院上海细胞库,使用含质量浓度为100 g/L胎牛血清(FBS)的DMEM培养基,在体积分数为5% CO2浓度,37 ℃的恒温细胞培养箱中进行培养,生长密集达到80%后,对细胞进行传代培养。
1.2 靶基因预测在miRBase(http://www.mirbase.org/)、TargetScan(http://www.targetscan.org/)、miRDB(http://www.mirdb.org/)、microRNA(http://www.microrna.org/)数据库中,以miR-21为检索词,进行靶基因预测,将3个数据库的预测结果取交集,即可预测得到可信度和准确性较高的靶基因。结合既往研究结果,选择其中一个与肿瘤相关的靶基因进行后续实验验证。
1.3 细胞转染实验取对数生长期的细胞,用胰酶消化后接种于6孔板,37 ℃、体积分数为5% CO2培养箱内培养过夜。使用LipofectamineTM2000(Invitrogen)转染试剂,按照说明书步骤,分别向细胞中转染hsa-miR-21 mimics(miR-21)、mimics control(miR-ctrl)、hsa-miR-21 inhibitor(anti-miR-21)、inhibitor control(anti-miR-ctrl)、hsa-miR-21 inhibitor(anti-miR-21)+si-TET1。转染完成后,在37 ℃、体积分数为5% CO2的培养箱中进行孵育,用于后续实验。
1.4 总RNA的提取及荧光定量PCR将组织以及细胞样品用液氮研磨成粉末,加入Trizol裂解液进行总RNA的提取,紫外光吸收法检测RNA浓度及纯度,OD260 nm/OD280 nm在1.8~2.0内表示所提取RNA纯度较好。使用逆转录试剂盒(Takara,日本)说明书,配置10 μl反应体系,以总RNA为模板逆转录得到cDNA。荧光定量PCR在ABI 7300 Realtime PCR仪上进行,使用Fast Start Universal SYBR Green Master试剂盒配置10 μl PCR反应体系,引物由上海生工生物公司合成,引物序列如表1所示,根据试剂盒说明书进行PCR反应。以GAPDH为内参对照,以2-ΔΔCT计算相对表达量,ΔCT=CT目的基因-CT内参,CT值为每个反应管内的荧光信号到达设定的阈值时所经历的循环数,所有实验均重复3次。
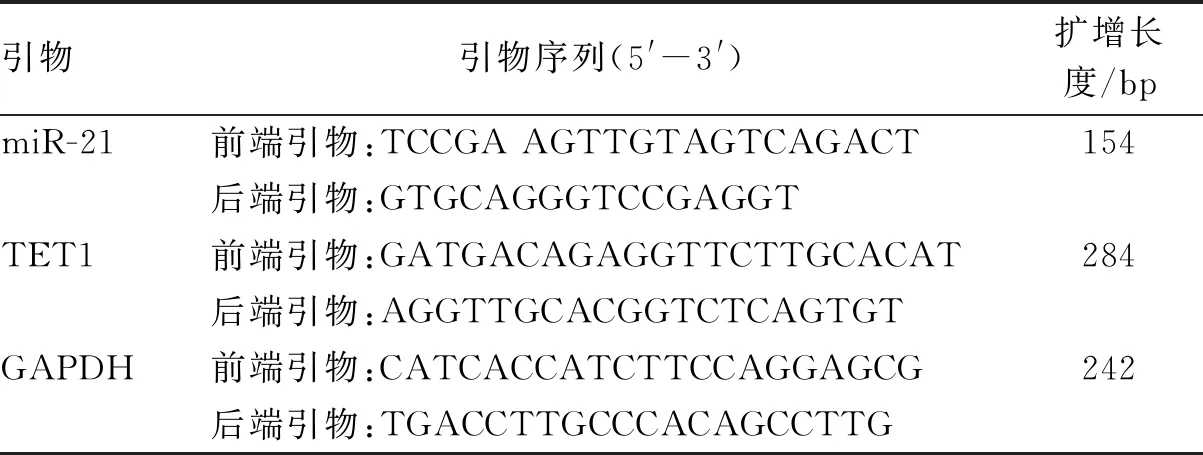
表1 miR-21、TET1、GAPDH引物序列
1.5 双荧光酶素实验将野生型和突变型TET1 3′-UTRs序列插入到pmirGLO载体(Promega,USA)中,它们分别被命名为pmirGLO-TET1-wt和pmirGLO-TET1-mut。两种重组载体分别与hsa-miR-21 mimics (miR-21)或mimics control(miR-ctrl)共转染至人结直肠癌细胞株HCT15和HT29中,实验设置4个组别,分别为pmirGLO-TET1-wt+hsa-miR-21 mimics组(miR-21+TET1-wt组)、pmirGLO-TET1-wt+miR-ctrl组(miR ctrl+TET1-wt组)、pmirGLO-TET1-mut+hsa-miR-21 mimics组(miR-21+TET1-mut组)和pmirGLO-TET1-mut+miR-ctrl组(miR ctrl+TET1-mut组)。转染完成后,在37 ℃,体积分数为5% CO2培养箱中继续培养48 h,使用GLO-MAX20/20荧光检测仪检测转染后细胞的萤火虫荧光素酶活性,以海肾荧光素酶活性为内参对照,相对荧光素酶活性为萤火虫荧光素酶活性与海肾荧光素酶活性之比。
1.6 Western blotting检测使用胰酶消化细胞,加入蛋白裂解液置于冰上裂解,离心后取上清液即为样品总蛋白,利用BCA法测定蛋白的浓度。总蛋白经质量浓度为80 g/L、80 V SDS-PAGE凝胶电泳,电转移至PVDF膜上,BSA封闭1 h,加入相应的一抗(1∶1 000),4 ℃孵育过夜,TBST洗膜3次后,加入二抗(1∶2 000),室温孵育1 h。TBST洗膜3次后,加入ECL显色液,将条带放入曝光夹中,利用BIO-RAD Molecular Imager荧光成像仪采集图像。以GAPDH作为内参,目的蛋白表达水平用目的条带与内参条带灰度值之比表示。
1.7 细胞增殖、侵袭、迁移能力检测细胞增殖能力用CCK-8增殖试剂盒检测,胰酶消化细胞并计数,于96孔板加4 000个细胞,每孔用含质量浓度为100 g/L FBS的DMEM培养基补充至100 μl,在体积分数为5% CO2,37 ℃的细胞培养箱中进行培养,分别在培养0、24、48、72 h后加入10 μl CCK-8,2 h后使用酶标仪上机检测(450 nm波长)。以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
细胞侵袭能力用Transwell小室进行检测,胰酶消化细胞,培养液重悬细胞,将细胞密度调整1×106ml/孔,Transwell小室以Matrigel基质胶铺底,小室上室加入200 μl细胞悬液,下室中加入600 μl含质量浓度为100 g/L FBS的DMEM培养基,细胞培养箱中培养24 h后,用棉签除去滤膜上的Matrigel基质胶和细胞,使用PBS冲洗、4%多聚甲醛固定、结晶紫染色后,100×光镜下随机选取10个视野对滤膜下表面细胞计数,取其平均值代表细胞的侵袭能力。
细胞迁移用细胞划痕实验检测,胰酶消化细胞,培养液重悬细胞,在6孔板中加入5×106个细胞,培养24 h后,使用白枪头比着直尺沿着每孔偏中线两侧进行划痕,枪头要垂直于板面,不能倾斜,并保持用力均匀,划痕应尽量直且宽度一致;PBS清洗3次,去除划下的细胞,再加入无血清培养基3 ml;放入培养箱培养,在培养0、12、24、36、48 h后观察细胞向中间迀移情况,拍照记录。计算迁移闭合率来反映细胞的迁移能力。迁移闭合率(%)=(迁移距离/划痕距离)×100%。

2 结果
2.1 生物信息学筛选miR-21的靶基因将三个数据库结果取交集,预测得出可信度和准确性较高的靶基因,我们筛选出miR-21的靶基因为TET1,miR-21可以与TET1基因3′-UTR区结合,如图1所示。

图1 数据库预测TET1与miR-21的结合位点
2.2 结直肠癌组织中miR-21和TET1的表达水平及相关性分析40对临床结直肠癌组织以及配对的正常结直肠组织中miR-21和TET1的表达水平,结果显示:结直肠癌组织中miR-21表达水平显著高于正常结直肠组织(P<0.01)。相反,TET1的表达水平显著低于正常结直肠组织(P<0.01,见图2)。

图2 结直肠癌组织和邻近的正常结直肠组织中miR-21(A)和TET1(B)的表达水平;图3 结直肠癌组织中miR-21和TET1相对表达量的相关性分析
进一步对结直肠癌组织中miR-21与TET1表达水平进行相关性分析,结果显示:miR-21与TET1的表达水平呈显著负相关(R=-0.75,P<0.01,见图3)。
2.3 miR-21的靶向基因TET1的验证双荧光素酶实验验证miR-21的靶向基因TET1,研究发现:miR-21+TET1-wt组相对荧光素酶活性显著低于其余三组(P<0.01),而其余三组差异无统计学意义(P>0.05,见图4)。miR-21抑制了pmirGLO-TET1-wt相对荧光素酶活性,而当靶位点发生突变时,miR-21不能发挥作用。

图4 双荧光素酶实验验证miR-21的靶向基因TET1
2.4 miR-21调控TET1蛋白表达Western blotting检测转染miR-21后TET1蛋白表达水平,结果显示:转染miR-21 mimics后,细胞中TET1蛋白表达显著降低(P<0.001,见图5),转染miR-21 inhibitor后,TET1蛋白表达显著升高(P<0.01,见图6),这进一步阐明了miR-21对TET1的负向调控作用。
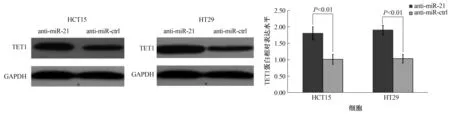
图6 转染miR-21 inhibitor对结直肠癌细胞HCT15和HT29中TET1蛋白表达水平的影响

图5 转染miR-21 mimics对结直肠癌细胞HCT15和HT29中TET1蛋白表达水平的影响
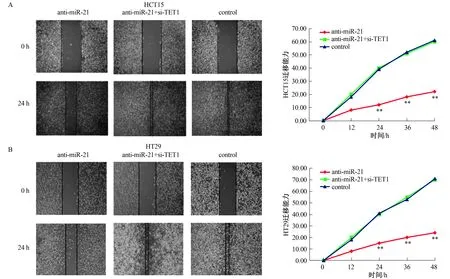
2.5 miR-21表达对细胞增殖、侵袭和迁移能力的影响转染抗miR-21使得miR-21低表达而TET1高表达,转染抗miR-21+si-TET1后使得miR-21低表达而TET1由于si-TET1的作用未发生改变,对各转染组细胞增殖、侵袭和迁移能力进行测定,结果显示:抗miR-21转染后细胞的增殖、侵袭和迁移能力均受到抑制(P<0.01),转染抗miR-21+si-TET1后细胞增殖、侵袭和迁移能力未发生显著变化(P>0.05,见图7~9)。
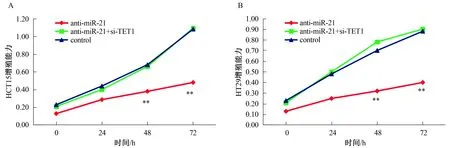
注:与control和anti-miR-21+si-TET1比较,**P<0.01。
3 讨论
结直肠癌是我国发病率和死亡率较高的恶性肿瘤之一,其早期不易发现,复发率高,晚期缺乏有效的治疗手段,对人类健康造成严重的威胁[7]。结直肠癌的发生发展是癌基因与抑癌基因等多种因素的共同作用,机制复杂。因此,探索结直肠癌发生发展的机制,寻找关键调控因子,对提高结直肠癌诊疗水平和改善预后具有重要意义。
miRNA通过与mRNA结合来调节基因的表达,并根据靶点的不同发挥癌基因或抑制因子的作用。近年来,随着miRNA研究的不断深入,研究发现食管鳞癌中经X-Ray照射后EC109细胞系的miR-126、miR-101表达上调,DNA损伤修复基因DNA-PKcs mRNA表达上调;miR-21表达下调,与DNA-PKcs mRNA表达呈负相关[8]。并有学者发现,miR-21在结直肠肿瘤中呈现异常高表达水平,检测miR-21的表达水平可能在结直肠癌的早期诊断、临床治疗和预后评估中有着广阔的应用前景[9]。此外,miR-21可作用于多个靶基因位点,Peacock等首次发现在结直肠癌细胞中PDCD4是miR-21的一个靶基因[10],ITGB4、CCL20和RhoB也均是miR-21的调控靶点[11-13]。因此,我们采用生物信息学方法预测miR-21的靶基因,预测选择出miR-21的靶基因TET1。TET1是TET家族中最早被发现的一个DNA羟甲基化调控酶,它可以使某些被甲基化沉默的基因实现去甲基化,进而重新表达,在肿瘤的发生和发展过程中发挥着重要的调控作用[14]。癌细胞的转移扩散与TET1的沉默或下调有关,Neri等[15]研究发现,TET1在结直肠癌肿瘤组织中的表达下调,TET1在肝癌、乳腺癌、胰腺癌和前列腺癌中通常不存在[16-19]。本文对结直肠癌组织中miR-21及TET1的表达水平进行分析发现,癌组织中miR-21表达水平上调而TET1表达水平下调,这表明miR-21发挥癌基因的作用而TET1发挥抑癌基因的作用,进一步证实了前人的研究结果。进一步研究其相关性发现,miR-21和TET1的表达水平呈负相关。基于此,我们推测在结直肠癌中miR-21可能靶向作用于TET1并引起其表达下调。双荧光素酶实验验证显示TET1是miR-21的靶基因,对其调控关系进行研究发现,转染miR-21降低了结直肠癌细胞中TET1蛋白的表达,这也证实了我们的推测,miR-21对TET1的表达水平呈负调控作用。在结直肠癌细胞miR-21可靶向作用于TET1 mRNA的3′-UTRs并引起TET1的表达下调。
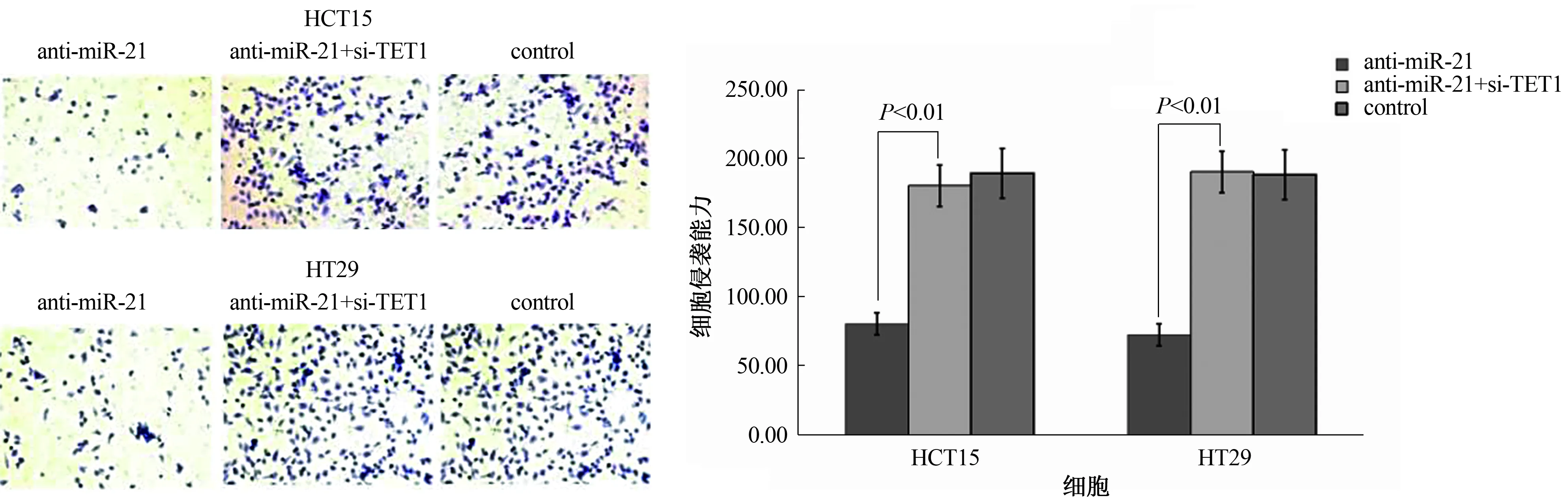
图8 miR-21表达对结直肠癌细胞HCT15和HT29侵袭能力的影响
注:与control和anti-miR-21+si-TET1比较,**P<0.01。
miRNA在肿瘤的增殖、侵袭和预后中起着关键的调节作用。已有研究显示,miR-21是一种癌基因,在结直肠癌的发生、发展、转移等生理过程中发挥重要的作用[9]。同时,TET1的沉默能够促进肿瘤的增殖、侵袭等生物学功能[20]。本文研究miR-21调控TET1表达对结直肠癌细胞生物学行为的影响,转染抗miR-21降低miR-21的表达而抬高TET1表达,抑制了结直肠癌细胞的增殖、迁移和侵袭能力,再转染si-TET1敲低TET1的表达,可以抵消抗miR-21介导的细胞增殖、侵袭和迁移的抑制作用。由此可见,miR-21对结直肠癌细胞增殖、侵袭和迁移的影响依赖于TET1的作用。miR-21的表达可以减少或沉默TET1表达,促进结直肠癌细胞的侵袭及癌症的转移。
综上所述,结直肠癌患者癌组织中miR-21高表达而TET1低表达;TET1是结直肠癌中miR-21的一个靶基因,受miR-21的反向调控;miR-21通过靶向作用于TET1促进结直肠癌细胞的增殖、侵袭与迁移。
