金黄色葡萄球菌ATCC25923人工感染BALB/c雌鼠肾脏组织PRNP和PRND的表达变化研究
2020-07-31孙康永杰魏亚琴杨宇泽万学瑞赵云海郭容霞
孙康永杰,魏亚琴,杨宇泽,万学瑞,樊 杰,赵 波,赵云海,郭容霞,王 川
金黄色葡萄球菌是属于葡萄球菌科的革兰氏阳性、凝固酶阳性病原体,是一种直径约为1 μm的球形细菌,形成葡萄状簇,通常无症状地出现在人体的某些部位,例如皮肤、皮肤腺体和黏膜,包括健康个体的鼻腔和内脏[1]。金黄色葡萄球菌既是共生细菌,又是人类病原体。大约30%的伤口被金黄色葡萄球菌定殖。同时,它是菌血症和感染性心内膜炎(IE)以及骨关节、皮肤和软组织、胸膜肺以及与医疗设备相关感染的主要原因[2-7]。金黄色葡萄球菌长期以来一直被认为是对人类和兽医学的挑战[8]。金黄色葡萄球菌被确定为与牛乳腺炎、火鸡的脚关节感染相关的病原体[9-10]。在中国,由金黄色葡萄球菌感染导致奶牛乳腺炎的发病率高于其他国家[11]。PRNP编码的细胞型朊蛋白(cellular prion protein, PrPC),是一种高度保守、在所有哺乳动物体内广泛表达的细胞表面糖蛋白;当其错误折叠成痒病型朊蛋白(scrapie isoform of prion protein, PrPSc)并在神经细胞内积累时,将导致传染性海绵状脑病(transmissible spongiform encephalopathies, TSEs)的发生[12]。PRND编码的Doppel蛋白(Dpl)与朊蛋白(PrPC)均属于朊蛋白家族。虽然Dpl与PrPC氨基酸序列同源性仅约25%,但两者翻译后修饰及空间结构却非常相似,并且C-端具有相似的结构域,即由3个α-螺旋和2个β-折叠以及2个糖基化位点组成[13]。目前发现PrPC和Doppel蛋白之间存在拮抗作用[14-15]。PrPC保守性非常强,真核生物的大部分组织均可表达PrPC,其在哺乳动物体内广泛分布,尤其在中枢神经系统内大量存在[16]。目前大量研究发现,PrPC在全身(人或者动物)多种细胞通路和信号传导过程中发挥作用[17]。而Doppel蛋白在野生型小鼠睾丸和心脏中高水平表达,脾脏和骨骼肌中表达程度低,在脑、肾、肝和肺中几乎不表达[18]。朊蛋白在细菌感染中可能发挥作用,流产布鲁氏菌利用肠道M细胞上的PrPC作为一种侵入性受体[19]。牛分枝杆菌感染导致PRNPmRNA表达水平逐渐升高[20]。Ingram RJ等人通过实验证明PrP0/0小鼠在链球菌引起的细菌性败血症模型中显示易感性改变[21]。在感染幽门螺杆菌患者的胃黏膜中PrPC高表达,在未受感染的胃黏膜中不表达或低表达[22]。虽然PRNP在细菌感染中发挥功能,但是Doppel蛋白的具体生理功能尚未确定。朊蛋白家族中的PRND在细菌感染过程中发挥什么样的功能?感染金黄色葡萄球菌后对PRNP和PRND表达有什么变化?我们仍然不清楚。因此,本实验通过金黄色葡萄球菌ATCC25923人工感染小鼠,研究PRNP和PRND在金黄色葡萄球菌感染后的表达变化,探讨金黄色葡萄球菌感染与PRNP和PRND的关系,为PrPC和Doppel蛋白在细菌感染中的作用研究提供理论基础。
1 材料与方法
1.1 主要的试剂与仪器
1.2实验动物及菌株 24只BALB/c雌鼠购自兰州大学医学部基础医学院实验动物中心。金黄色葡萄球菌ATCC25923由甘肃省人民医院魏莲花老师馈赠。
1.3 方 法
1.3.1细菌接种与培养 将金黄色葡萄球菌ATCC25923接种于高压灭菌后的TSB液体培养基(100 mL),接种前加入5%羊血清(用0.45 μm滤器过滤),放置于摇床中37 ℃培养至菌液OD600介于0.6~0.8之间。
1.3.2感染BALB/c雌鼠 将菌液离心,加入适量PBS缓冲液稀释至OD600值等于0.6。将24只BALB/c雌鼠分为空白对照组和第1 d、第2 d、第3 d、第4 d、第5 d、第6 d、第7 d感染组。其中空白对照组3只,感染组每组3只。感染组BALB/c雌鼠在腹部皮下分四点注射0.1 mL金黄色葡萄球菌ATCC25923菌悬液。空白对照组相同方法在BALB/c雌鼠在腹部皮下分四点注射0.1 mL注射PBS缓冲液。
1.3.3解剖小鼠 在金黄色葡萄球菌ATCC25923感染后第1 d、第2 d、第3 d、第4 d、第5 d、第6 d、第7 d解剖对应各组小鼠,每只小鼠摘取心脏、肝脏、脾脏、肺脏、肾脏、胸腺、小肠、大肠、卵巢和子宫。每组所有组织器官分为3部分,第一部分置于装有1 mL 10%甲醛的1.5 mL灭菌EP管中,第二部分组织器官抹片,最后一部分直接装于1.5 mL灭菌EP管中置于-80 ℃冰箱。
1.3.4感染组织抹片革兰氏染色及石蜡切片制作 感染组织抹片革兰氏染色,油镜观察,发现肾脏中最先出现金黄色葡萄球菌,所以采取肾脏制作石蜡切片[23]。
1.3.5引物设计与合成 采用Oligo 6软件,依照荧光定量引物设计准则,在保守区域设计特异性引物。引物交由金唯智生物科技有限公司合成。见表1。
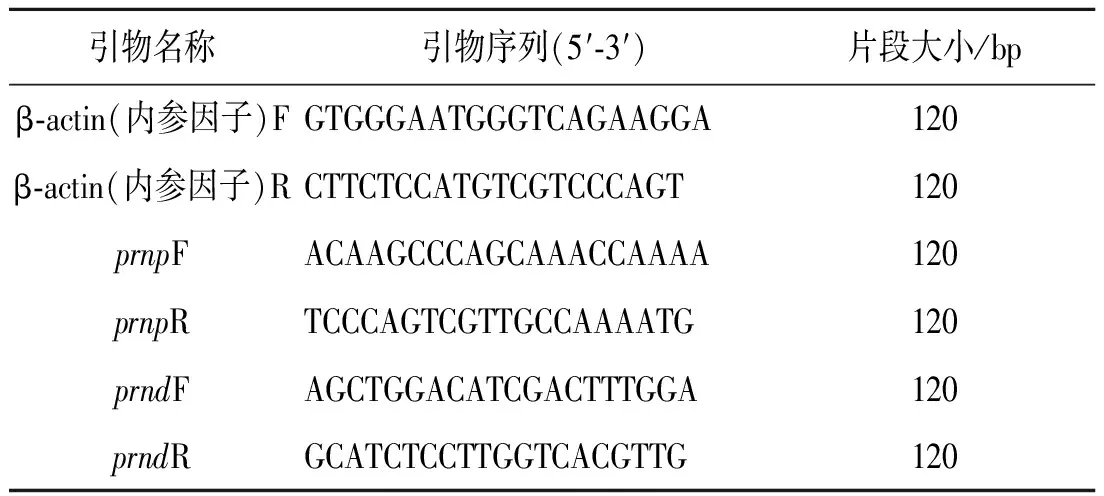
表1 引物序列及大小
1.3.6荧光定量PCR检测小鼠肾脏中PRNP基因和PRND基因的表达 将存放于-80 ℃冰箱的肾脏组织留样按照TRIzol说明书提取总RNA。取1 μL RNA溶液加入到超微量分光光度计中测定总RNA浓度和纯度。按逆转录试剂盒说明书合成cDNA,荧光定量PCR方法参照文献[24]。具体条件为:95 ℃预变性30 s;95 ℃变性5 s,62 ℃退火10 s,72 ℃延伸10 s,35个循环,延伸阶段收集信号,qPCR结束后立即进行熔解曲线分析,验证引物扩增的特异性。以β-actin为内参基因,以空白组为对照,采用比较Ct值相对定量法(2-ΔΔCt)来分析不同感染时间PRNP与PRND基因的表达量[25],数据使用SPSS 25进行单因素方差分析。
2 结 果
2.1金黄色葡萄球菌感染小鼠的病理变化 小鼠在第1 d和第2 d与空白对照组相比无明显变化。从感染后第3 d开始,小鼠变得精神沉郁,饮水量和食量开始下降,到第7 d最为严重,抓取时甚至出现不反抗的现象,第5 d解剖时发现腹部注射部位发生病变,皮肤有轻微脓肿,打开腹腔后,闻到明显的腐臭味。与空白对照相比,第3 d至第7 d的组织器官发生不同程度的病理变化,尤其是腹腔器官,肝脏颜色变深,质地变脆,体积肿大。肾脏、脾脏、卵巢发生肿胀,小鼠的粪便变稀,血液颜色变深。
2.2金黄色葡萄球菌感染小鼠肾脏的革兰氏染色结果 以革兰氏染色的情况来看,小鼠的内脏器官从第2 d开始出现金黄色葡萄球菌,每天细菌出现的数量都在递增,其中肾脏感染最早且较为严重。所以选取肾脏做后续实验。见图1。
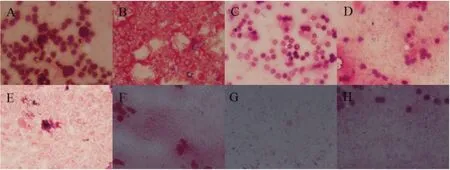
A.空白对照;B.第1 d;C.第2 d;D.第3 d E.第4 d;F.第5 d;G.第6 d;H.第7 d
2.3金黄色葡萄球菌感染小鼠肾脏组织的变化 与空白对照组相比,感染后第3 d肾小球炎性细胞增生,肾小管间局部轻微出血;感染后第4 d肾小管弥漫性肿胀,管腔狭窄;感染后第5 d肾脏间质炎性细胞增生,肾小管肿胀,间质局部出血。见图2。

A.空白对照;B.第3 d;C.第4 d;D.第5 d
2.4荧光定量PCR测定PRNP、PRND表达量结果 利用荧光定量PCR检测金黄色葡萄球菌ATCC25923感染BALB/c雌鼠后1~7 d肾脏中PRNP基因与PRND基因的相对表达量,以空白组作为对照,PRNP基因第1 d到第7 d的相对表达量分别是:6.147 5±0.166 4(P=7.188 9×10-18),3.031 4±0.169 7(P=7.186 6×10-12),2.345 6±0.162 8(P=1.160 9×10-9),2.143 5±0.114 0(P=5.448 6×10-8),3.387 0±0.044 7(P=1.916 1×10-12),2.907 9±0.064 0(P=2.572×10-11)和2.329 4±0.141 4(P=8.479×10-9),均显著高于对照组(P<0.05),其中第1 dPRNP相对表达量最高;PRND基因第1 d到第7 d的相对表达量分别是:9.253 5±0.112 6(P=3.965 7×10-21),13.086 4±0.102 1(P=1.012 5×10-23),3.580 1±0.161 0(P=3.544×10-13),1.972 5±0.111 9(P=1.995 2×10-7),3.732 1±0.090 2(P=1.932 2×10-13),1.189 2±0.064 0(P=0.144)和4.438 3±0.149 2(P=5.157 7×10-15),PRND基因第6d的相对表达量和对照组差异无统计,其余各天PRND基因的相对表达量高于对照组(P<0.05),其中第2 dPRND相对表达量最高。见图3。
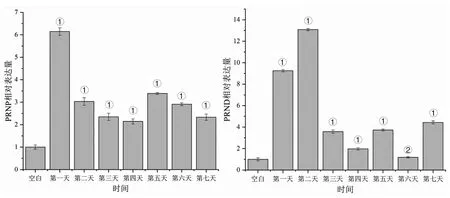
图3 PRNP基因和PRND基因的相对表达水平(①:P<0.05;②:P>0.05)
3 讨 论
金黄色葡萄球引起的菌血症可并发心内膜炎、转移性感染或败血症综合征。内皮细胞是这些疾病致病过程的中心,而单核细胞和巨噬细胞在感染过程起中心作用[26]。PrPC是细胞表面上糖基磷脂酰肌醇(GPI)锚定的糖蛋白,先前的研究已经证明PrPC与巨噬细胞的吞噬能力有关[27]。此次实验发现小鼠腹部皮下注射金黄色葡萄球菌2 d后,在肾脏最先发现金黄色葡萄球菌,且肾脏感染较为严重,肾脏感染属于转移性感染。从HE染色结果可看出金黄色葡萄球菌感染造成小鼠肾脏组织肾小球炎性细胞增生,肾小管肿胀以及间质局部出血,肾脏间质炎性细胞增生。感染金黄色葡萄球菌后,PRNP的表达在1~7 d内都高于空白对照组。其中第1 d表达量最高,虽然从第2 d开始下降,但都维持在空白对照组的2倍以上。PRND的表达量也都高于空白对照,第1 d和第2 d最为明显,从第3 d开始相对表达量下降。而朊蛋白在哺乳动物机体内广泛分布,可能参与机体多种生理功能的维持[28]。表达于肠上皮细胞中M细胞表面的PrPC通过与细菌表面的Hsp60相互作用,在流产布鲁氏菌进入M细胞中发挥重要作用[19]。在链球菌感染过程中,PRNP基因敲除的小鼠T细胞激活程序的某些组成部分被终止,而这些组成部分是完全有效的超抗原或抗原反应所必需的,PrPC表达似乎与诱导免疫效应机制密切相关[21]。PrPC通过调控促炎细胞因子上调和抑制细胞凋亡途径,从而参与小胶质细胞对牛分枝杆菌感染的反应调节[20]。而幽门螺杆菌感染伴随着胃黏膜中PrPC表达的急剧上调,这与本实验结果一致[22]。本实验发现小鼠肾脏的PRNP和PRND的表达随着金黄色葡萄球菌感染时间发生变化,暗示这两种蛋白可能直接或者间接参与了小鼠机体抵抗感染的过程,同时这也是我们首次证实PRND的表达随着金黄色葡萄球菌感染时间发生变化。PrPC和Doppel蛋白在感染过程中并没有表现出明显的拮抗作用,而PRNP和PRND表达同时上调的具体原因需要进一步研究。
利益冲突:无
