有机肥对羊草草原土壤细菌群落多样性的影响
2020-07-31商丽荣万里强李向林
商丽荣,万里强,李向林
有机肥对羊草草原土壤细菌群落多样性的影响
商丽荣,万里强,李向林
(中国农业科学院北京畜牧兽医研究所,北京 100193)
【】以呼伦贝尔天然羊草草原退化打草场为研究对象,揭示不同有机肥处理对土壤养分状况和土壤细菌群落多样性的影响,为羊草草原的改良、恢复及合理利用提供科学依据。田间试验采用单因素随机区组设计,共7个处理分别为:对照(ck),蚯蚓粪15 t·hm-2(a1)、30 t·hm-2(a2)、45 t·hm-2(a3),菌渣15 t·hm-2(b1)、30 t·hm-2(b2)、45 t·hm-2(b3)。本研究采用 Miseq高通量测序技术,分析不同有机肥处理对土壤细菌群落多样性的影响机制。同时结合土壤化学性质,探究不同有机肥处理下细菌群落变化的环境驱动因子。不同有机肥处理可以改善土壤养分状况并形成明显的细菌群落。a3处理的土壤有效磷含量较对照显著增加37.3%。b3和a3处理土壤有效钾含量较对照显著增加62.99%和40.53%。b3处理下的地上生物量显著高于其他处理(244.11 g·m-2)。此外,施蚯蚓粪和菌渣显著增加了土壤中细菌群落的丰富度。与ck相比,a1和b2处理下丰富度指数显著增加。在门水平上,21个样品共获得31个类群。其中放线菌门(Actinobacteria),变形菌门(Proteobacteria),酸杆菌门(Acidobacteria),疣微菌门(Verrucomicrobia)和绿弯菌门(Chloroflexi)为优势类群,相对丰度共占细菌群落的85%以上。a2处理的放线菌最为丰富(36.79%)。变形菌门(Proteobacteria)在b1和b3处理中含量较高(23.29%,22.32%)。酸杆菌门(Acidobacteria)在a1处理中最高(20.69%)。而LEfSe表明在b3处理下检测到更多的细菌分类群(17个进化枝,1个纲,1个目,4个科和11个属)。另外,土壤有效氮(=0.001)、有效钾(=0.005)和有机质(=0.006)对土壤中的细菌群落组成有极显著的影响(<0.01),全钾(=0.014)对土壤细菌群落组成有显著影响(<0.05)。说明有效氮、有效钾、有机质和全钾是细菌群落的主要驱动因素。有机肥在羊草草原的应用改变了土壤细菌群落结构。蚯蚓粪和菌渣在45 t·hm-2施肥量情况下提高了速效养分含量,也提高了羊草草原土壤细菌群落的生物多样性,有利于草地农业生态系统的可持续发展。
有机肥;土壤养分;土壤细菌群落;羊草草原
0 引言
【研究意义】呼伦贝尔草原总面积近866.7万hm2,其中羊草草原占37.3%[1],是该地区主要的草牧业生产基地。近年来,由于连年打草和放牧利用,草地生态系统养分大量输出,导致草原普遍存在严重的退化现象[2-3]。土壤肥力下降被认为是中国北方草原生产力低下的主要原因之一[4],长期以来,施肥已被广泛用作维持土壤肥力和作物生产力的管理措施[5]。合理施肥会改变土壤pH,影响土壤微生物活性和养分转化过程[6-7],进而提高牧草产量和品质[8-9]。有机肥料来自动物或植物物质,由于其丰富的有机物质和平衡的营养物质,可在一定程度上改变土壤的物理化学性质及微生物状况[10-12]。【前人研究进展】研究表明,有机改良剂可以刺激植物生长和微生物活动[13],并为微生物提供底物。施肥改变了土壤微生物活性和群落结构,并引起土壤生物学特性的差异,进而影响土壤结构和土壤肥力[14]。此外,施有机肥能显著改变土壤微生物群落结构及多样性[15],提高微生物的生物量和代谢活性[16]。RAJKUMAR等[17]研究发现土壤微生物群落是影响地上部植物营养、发育和抗性的关键因素。【本研究切入点】以往相关领域的研究主要是针对氮、磷、钾等不同肥料及配比施用对植被及土壤微生物的影响,草地过多施用化肥易引起土壤板结、水体富营养化、重金属污染,最终导致草原土壤酸化、营养失衡、生物多样性减少、草地生产力降低等问题[18]。施用有机肥能改善土壤质量、改变土壤微生物组成,提高土壤生产力[19]。目前普遍认为,有机肥料对土壤中微生物的丰度具有更显著的影响[20]。本研究所用蚯蚓粪有机肥是蚯蚓消化当地农场的牲畜粪便后的产物,菌渣有机肥是种植蘑菇后残留的基质。因此,有必要开展不同有机肥处理对土壤微生物群落多样性的影响研究。【拟解决的关键问题】本试验以呼伦贝尔天然羊草草原退化打草场为研究对象,采用 Miseq高通量测序技术,探讨两种有机肥不同水平下土壤细菌群落多样性的响应机制,并结合土壤化学性质揭示其驱动因素,为呼伦贝尔天然羊草草原退化打草场的恢复和合理利用提供科学依据。
1 材料与方法
1.1 试验设计
试验地位于内蒙古自治区呼伦贝尔市海拉尔区谢尔塔拉镇,中国农业科学院呼伦贝尔草原生态系统国家野外科学观测站内羊草草原打草场(49°25′N,119°70′ E),是大兴安岭西麓丘陵向蒙古高原的过渡区,属于中温带半干旱大陆性气候,土壤为栗钙土;海拔649.6 m,最高气温为36.2℃,最低气温为-48.5℃,年均气温-2.4℃,≥10℃年积温1 500—1 800℃,无霜期为110 d左右;年平均降雨量350—400 mm,多集中在7—9月,且雨热同期[21]。植被类型是以羊草为建群种的典型草原,主要优势种有羊草()、贝加尔针茅(Roshev.)、糙隐子草()等,伴生种有早熟禾()、展枝唐松草()和寸草苔(C.A.)等。
2018年6月中旬雨季及牧草旺盛生长季前期,在地势平坦、草地群落特征相似的区域设置样地(试验前为打草场),试验包括对照(ck),蚯蚓粪15 t·hm-2(a1)、30 t·hm-2(a2)、45 t·hm-2(a3),菌渣15 t·hm-2(b1)、30 t·hm-2(b2)、45 t·hm-2(b3)共7个处理。蚯蚓粪(有机质含量26.1%、全氮10.65 g·kg-1、速效磷282.23 mg·kg-1、速效钾2839.20 mg·kg-1、含水量1%)和菌渣(有机质含量24.6%、全氮12.39 g·kg-1、速效磷382.01 mg·kg-1、速效钾690.70 mg×kg-1、含水量1%)由该观测站提供,蚯蚓粪有机肥主要是蚯蚓消化牛粪,菌渣有机肥是种植蘑菇后的基质,人工撒施于地表。田间试验采用单因素随机区组试验设计,每个处理重复3次,小区面积3 m×5 m,小区间距为1 m,共21个试验小区。
1.2 样品采集
在每个小区选取4个点用土钻取0—20 cm土层样品,混合为一个土样。去除石块和根系等杂物后将所有样品密封在无菌塑料袋中,以冰封存并立即送至实验室。将土壤样品过2 mm筛,一部分自然风干用于分析土壤化学性质,另一部分装入离心管中冷冻用于土壤微生物的分析。
1.3 测定方法
1.3.1 土壤理化性质测定 土壤全氮采用凯氏定氮法;土壤全磷采用NaOH碱熔-钼锑抗比色法;土壤全钾采用原子吸收火焰光度计法;土壤速效氮采用碱解扩散法;采用0.05 mol×L-1NaHCO3钼锑抗分光光度法测定土壤速效磷含量;采用NH4OAc浸提-原子吸收火焰分光光度计法测定土壤速效钾含量;采用重铬酸钾氧化-外加热法测定土壤有机质含量;土壤pH值以水(土水比1﹕5)为浸提液,用多参数袖珍传感器(PT 162)测定[22-24]。
1.3.2 土壤微生物DNA提取和PCR扩增 土壤DNA采用Power Soil ® DNA Isolation Kit试剂盒提取,提取步骤按照试剂盒说明书进行。用1%的琼脂糖凝胶电泳进行检测,使用核酸定量仪(Nano Drop ND-2000)检测提取DNA的浓度和纯度。
选择细菌V3-V4区的16S rDNA序列进行PCR扩增,扩增引物为338F(5′-ACTCCTACGGGAGGCAG CAG-3′)和806R(5′-GGACTACHVGGGTWTCTAA T-3′)。PCR扩增体系为5×Buffer 4 µL,dNTPs(2.5 mmol×L-1)2 µL,Forward Primer(5 µmol×L-1) 0.8 µL,Reverse Primer(5 µmol×L-1)0.8 µL,Polymerase 0.4 µL,BSA 0.2 µL,Template DNA 10 ng,ddH2O 20 µL。扩增程序为:95℃预变性3 min,27个循环(95℃变性30 s,55℃退火30 s , 72℃延伸45 s),最后72℃延伸 10 min (PCR仪:ABI GeneAmp® 9700型)。
1.3.3 Illumina Miseq 测序 使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega,USA)进行检测定量。根据Illumina MiSeq平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2*300的文库。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.4 测序数据处理
对下机原始测序序列使用Trimmomatic 软件质控,使用FLASH软件进行拼接利用。(1)设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口前端位置截去该碱基后端所有序列,之后再去除质控后长度低于50 bp的序列;(2)根据重叠碱基overlap将两端序列进行拼接,拼接时overlap之间的最大错配率为0.2,长度需大于10 bp。去除无法拼接的序列。(3)根据序列首尾两端的barcode和引物将序列拆分至每个样本,barcode需精确匹配,引物允许2个碱基的错配,去除存在模糊碱基的序列,最后获得用于后续分析的高质量序列。
1.5 数据统计分析
使用UPARSE软件,根据97%的相似度对序列进行OTU聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier对每条序列进行物种分类注释,选用Silva数据库,得到OUT的分类学信息。利用Mothur 1.30.1 软件在97% 相似水平上进行α多样性指数分析。
使用IBM SPSS 20.0(SPSS Inc.,USA)进行土壤化学性质和α多样性(Shannon,Ace,覆盖度)分析,并使用单因素方差分析比较不同处理之间差异的显著性(<0.05)。LEfSe(http://huttenhower.sph. harvard.edu/galaxy/root?tool_id=lefse_upload)根据分类学组成对样本按照不同的分组条件进行线性判别分析(LDA),找出对样本划分产生显著性差异影响的群落或物种。其余部分使用R语言分析作图。
2 结果
2.1 土壤养分及地上生物量的变化
蚯蚓粪和菌渣有机肥对土壤速效磷和速效钾产生了明显的影响(表1),导致土壤pH趋于中性且a3处理显著高于其他处理。施用蚯蚓粪和菌渣分别使土壤有效磷和有效钾含量显著增加(<0.05)。此外,a3处理的有效磷含量增高,而b3处理的有效钾的含量最高。通过蚯蚓粪和菌渣处理提高了土壤可利用养分,表明蚯蚓粪和菌渣对化学性质有明显的影响。此外,在b3处理下,地上生物量显著高于其他处理(表1)。
2.2 土壤细菌序列及其多样性指数
利用Illumina Mi Seq平台测序结果显示,在所有土壤样品中,总共获得1 405 452个序列读数。除去短的、低质量、单体、重复和嵌合体之外,保留了955 201个有效序列。基于97%的相似性,在所有样品中获得总共3 481个OTU,划分为31个门,75个纲,153个目和298个科。所将数据抽平一次,每个样品得到35 708条高质量序列(表2)。
试验结果表明,所有处理的覆盖指数均大于0.98,这也说明测序能力能够比较真实地反映土壤样本的细菌群落特征(表2)。与ck处理相比,b2处理中观察到的OTU数量显著(<0.05)增加了7.19%。同时,a1处理的Shannon多样性指数最高(6.53),其次是b2处理(6.51)。此外,ck的丰富度指数Ace显著(<0.05)低于a1和b2,分别降低了7.07%和7.23%。

表1 不同有机肥处理的土壤化学性质和地上部生物量
数据为平均值±标准差(n=3);同列数值后不同小写字母表示差异显著(<0.05)。ck,无施肥处理,a1、a2、a3分别为蚯蚓粪施肥量15、30、45 t·hm-2,b1、b2、b3分别为菌渣施肥量15、30、45 t·hm-2。下同
Data are means ± standard deviation (n=3); Different small letters mean significant differences (<0.05). ck, no fertilization treatment, a1, a2, a3 are the amount of vermicompost application 15, 30 and 45 t·hm-2, b1, b2, b3 are the amount of mushroom residues application 15, 30 and 45 t·hm-2. The same as below

表2 不同有机肥处理下土壤细菌测序及群落α多样性指数
2.3 细菌群落组成
在门水平上共得到31个类群,所有样品中的前5个主要门是放线菌门(Actinobacteria)、变形菌门()、酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)和绿弯菌门(Chloroflexi),它们占细菌群落相对丰度的85%以上(图1)。在这些占优势的门中,放线菌在a2处理中最为丰富(36.79%),但在a1处理中最少(31.57%)。相反,酸杆菌门在a1处理中最高(20.69%),在a2处理中最低(13.92%)。变形菌门作为第二丰富的门,在b1和b3处理中含量较高(23.29%,22.32%)。而疣微菌门在a3处理中占比最多(12.72%),绿弯菌门在b2处理中最为丰富(10.59%)。
2.4 细菌群落差异分析
PLS-DA显示不同施肥处理的土壤细菌群落有所不同(图2)。不同水平的蚯蚓粪和菌渣处理下形成不同的细菌群落。此外,a1、a2、b3和其他处理清楚地分开并沿着comp1左右分布。而a3和ck处理之间没有明显差异,类似的a2和b3处理的群落组成相似。

图1 不同有机肥处理细菌门的组成结构

图2 不同有机肥处理的土壤细菌群落PLS-DA图
为了确定与不同有机肥水平相关的特定细菌分类群,我们使用线性判别分析(LDA)效应大小(LEfSe)比较了ck、a1、a2、a3、b1、b2和b3处理中的细菌群落。进化图中不同分类级别的每个圆圈表示该级别的分类,黄色表示丰度没有显著变化,圆形直径的大小表示相对丰度。如图3所示,26个细菌进化枝在统计学上有显著差异,LDA得分为2或更高。根据LEfSe的LDA,与其他处理相比,在b3处理中LEfSe检测到更多的细菌分类群(17个进化枝,1个纲,1个目,4个科和11个属),即Limnochordia(纲到科)、Pseudomonadaceae(科到属)、(属)、(属)、(属)、(属)、Microbacteriaceae(科到属)、(属)、(属)、(属)、(属)。在b1处理中,Thermoactinomycetaceae(科)和(属)的相对丰度显著高于其他6种处理。相比之下,科水平的FFCH13075和属水平的在a3处理中更高。类似地,在a2处理中富集Nocardioidaceae(科),Polyangiaceae(科)和(属)(图3)。
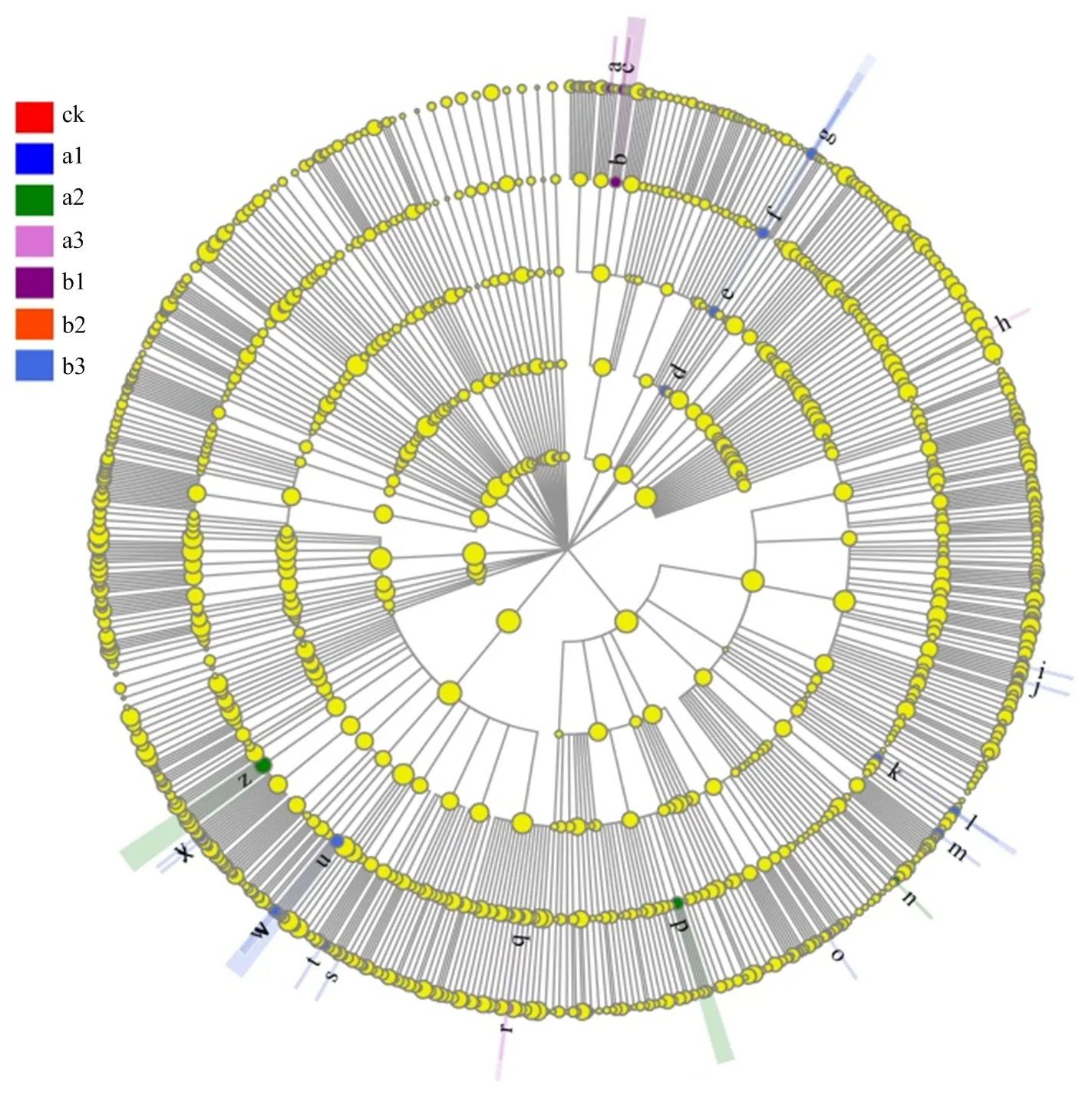
2.5 不同处理的细菌群落结构及其与环境因子的关系
结果表明,在属水平,RDA基于物种的相对丰度检测到土壤特性与细菌群落之间的关系。表明第一和第二种RDA成分能够解释细菌13.72%变化,第一个成分(RDA 1)解释了细菌菌群总变异的7.70%;第二个成分(RDA 2)解释了细菌菌群总的6.02%的变化(图4)。此外,RDA表明不同的环境变量对整个细菌群落有不同的影响(表3)。分析结果表明,有效氮(=0.001),有效钾(=0.005)和有机质(=0.006)对土壤中的细菌群落组成有极显著的影响(<0.01),全钾(=0.014)对土壤细菌群落组成有显著影响(<0.05)。
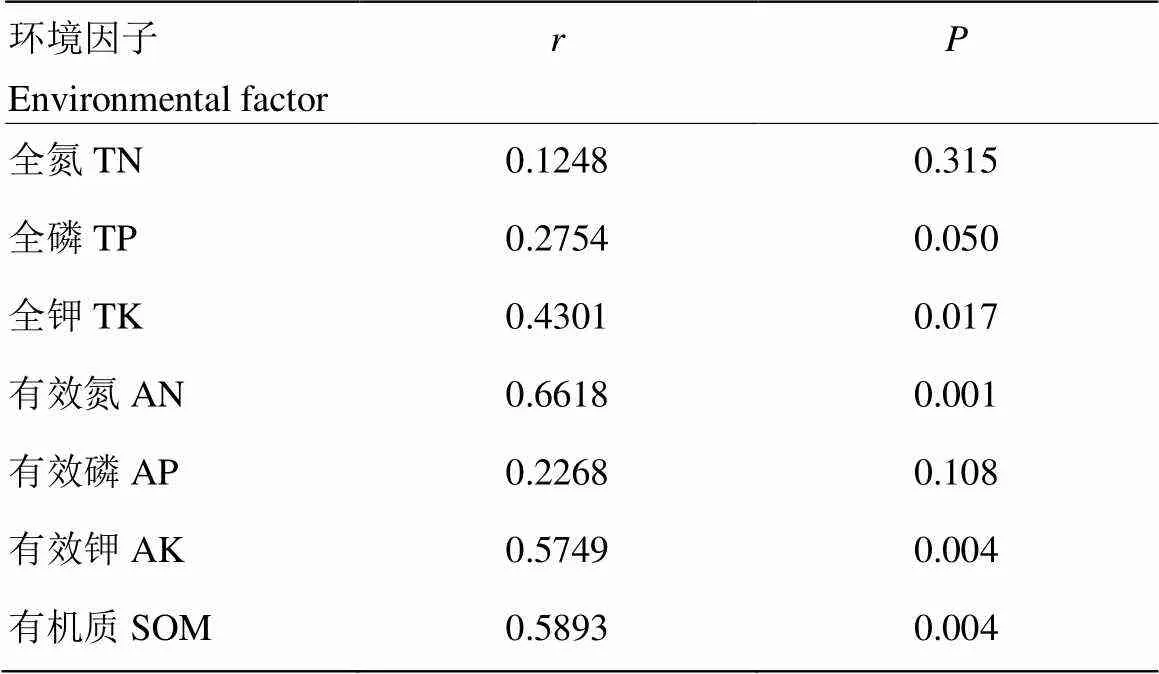
表3 基于属水平的细菌群落和环境因子之间相关性的P值
3 讨论
结果表明,不同有机肥处理对土壤细菌群落Ace指数和地上草产量有显著影响(表1)。CHU等[25]研究发现,在砂质壤土中通过施用有机肥,有机碳和土壤氮、磷、钾养分也显著增加。本试验结果表明,施用蚯蚓粪和菌渣有机肥后有效地提高有效磷和有效钾的含量(表1),这与草地农业生态系统中大多数施肥试验所得结果一致[26-28]。而有机肥料施用下土壤pH、总养分和有机质含量并没有显著变化,表明这些指标在短期内变化不明显,CHEN等也得出类似的结论[29]。此外,与其他处理相比,菌渣(b3)处理显著增加了牧草的总生物量,这与有机肥料可显著影响草产量的观点较为一致[30]。这些都表明蚯蚓粪和菌渣有机肥的施用会增加有机物质营养库和草地的有效养分含量,并显著提高了牧草产量[31]。

图4 属水平上不同有机肥处理的土壤细菌的相对丰度和土壤化学性质的RDA分析
微生物群落的生物多样性和丰富性对于土壤生态系统的完整性、功能性和长期可持续性至关重要,但它们通常也会因农业扰动而发生变化[32]。在本研究中,施用蚯蚓粪(a1)和菌渣(b2)有机肥导致土壤细菌丰富度指数(Ace)显著增加(表2)。然而,细菌群落多样性Shannon指数在不同有机肥处理之间没有显著变化,这与前人的研究结果类似[33]。这可能是由于施用有机肥会对土壤理化性质和生物学特性尤其是对土壤pH和微生物群落有明显的影响机制。本试验中,所用蚯蚓粪有机肥主要是蚯蚓消化畜禽粪便后的产物,通常呈碱性,因此施用于土壤后常使其pH值趋于中性;而菌渣有机肥主要是种植蘑菇后的基质,其中大量的菌丝体富含氨基酸、纤维素、碳氢化合物和微量元素。因此,蚯蚓粪和菌渣有机肥在土壤中的施用能显著改变微生物种群,进而影响微生物群落的一系列活动。
虽然细菌群落的相对丰度和多样性方面对于有机肥的施用有着不同的响应机制,但我们的研究结果表明,土壤微生物群落结构由于蚯蚓粪和菌渣有机肥的不同梯度而发生显著的变化,这与土壤和植物特征的变化是一致的。对门的丰度分析表明,放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadtes)是所有处理中的前6位优势门(图1),大致与先前的研究类似[21,34]。放线菌作为细菌门占比最大的一类门,在有机物分解和腐殖质形成过程中起着关键作用[35-36],并且它可以产生多种抗生素来保护土壤和植物根部免受病原微生物的侵害[37],CHEN等[38]基于长期施肥试验报道了相似的丰度变化趋势。其次是变形菌门(Proteobacteria),包括可以固氮和各类代谢物的细菌,其中许多可以利用光合作用来储存能量。而酸杆菌门(Acidobacteria)是一种新近分离的细菌,目前对它们的研究很少,但它们在生态系统中起着重要作用。疣微菌门(Verrucomicrobia)则是主要存在于水生、土壤环境或人类粪便中的一类门,ZHAO等[32]也指出,长期高水平化学肥料施用下的疣微菌门(Verrucomicrobia)比低水平化学肥料或无化学肥料的施用更为丰富,因其涉及有机碳的利用[39],可以提高叶片的光合作用效率,增强牧草的物质积累。绿弯菌门(Chloroflexi)含有绿色色素,与保水能力和地上生物量呈显著正相关,可有效降解纤维素[40-41]。
任何环境因素的改变都可能在一定程度上改变土壤微生物群落结构[42]。根据本试验结果,PLS-DA评分图清楚地区分了不同有机肥料处理下土壤细菌微生物群落之间的差异(图2)。这些结果与大多数长期施肥试验的研究结果一致[43],即施用不同水平的蚯蚓粪和菌渣有机肥会不同程度地影响土壤微生物群落结构。本试验中,在a2处理中观察到最丰富的Nocardioidaceae、Polyangiaceae(科)和(属)(图3),可以产生抗生素和降解的纤维素[44]。而a3处理下最丰富的是(属)和(科),(属)可以产生有机营养素、发酵有机酸、蛋白质提取物和一些碳水化合物。此外,本试验结果表明,蚯蚓粪有机肥的施用会影响土壤微生物活动,从而影响土壤和植物生长的一系列活动。施用不同水平的菌渣有机肥后,科水平的和属水平的在b1富集,LEfSe的分析则表明在b3处理下土壤的生物菌群最为丰富(图3)。并且这些微生物进化枝(、、和)都与纤维素降解、呼吸代谢和碳水化合物的合成密切相关[45]。假单胞菌()具有分解蛋白质和脂肪的能力,迅速分解土壤中的腐殖质,可为植物提供养分[46]。本试验研究结果表明,施用有机肥可以促进有机物的分解,并影响土壤微生物区系。
此外,有机肥对土壤影响引起的环境因素变化对群落中不同微生物群的贡献不同(图4)。许多研究还表明,土壤环境因素影响微生物群落结构[32,47-48]。例如,WEI等[49]根据35年的粪肥和化肥施用试验,结果表明SOC和TN是影响微生物群落结构的主要环境因素。然而,WANG等[50]表明土壤pH、有机质和有效磷含量是影响玉米根际细菌群落的重要因素。本试验中,RDA揭示了全钾、有效氮、有效钾和有机质是影响土壤细菌群落结构和组成的关键因素(图4,表3)。说明施用蚯蚓粪和菌渣增加了有效养分和有机质含量的同时也影响细菌群落的组成,而氮和有机质作为土壤微生物的主要能源,对塑造细菌群落至关重要。
4 结论
在羊草草原土壤中,施用45 t·hm-2蚯蚓粪和菌渣有机肥不仅增加了土壤有效磷和有效钾含量,而且提高了羊草草原土壤细菌群落的Ace指数、地上生物量和放线菌的丰度。蚯蚓粪和菌渣有机肥在45 t·hm-2施肥量下对羊草草原的改良效果最好和产量最高。然而,有机肥长期施用对土壤有效养分和菌群的具体影响机制还有待进一步深入研究。
[1] 乌云, 娜仁高娃, 田瑞芳. 呼伦贝尔草原生态保护与畜牧业可持续发展. 内蒙古农业大学学报(社会科学版), 2014, 16(2): 18-21.
WU Y, NAN REN G W, TIAN R F. Hulunbeier grassland ecological protection and sustainable development of animal husbandry.2014, 16(2): 18-21. (in Chinese)
[2] 卡着才让, 德科加, 徐成体. 不同施肥时间及施氮水平对高寒草甸生物量和土壤养分的影响. 草地学报, 2015, 23(4): 726-732.
KA ZHUO C R, DE K J, XU C T. The effects of different fertilization time and nitrogen application levels on biomass and soil nutrients in Alpine meadow., 2015, 23(4): 726-732. (in Chinese)
[3] CLARK F E, PAUL E A. The microflora of grassland., 1970, 22: 375-435.
[4] HE N, YU Q, WANG R, ZHANG Y H, GAO Y, YU G R. Enhancement of carbon sequestration in soil in the temperature grasslands of northern China by addition of nitrogen and phosphorus., 2013, 8: e77241.
[5] SHEN J P, ZHANG L M, GUO J F, RAY J L, HE J Z. Impact of long-term fertilization practices on the abundance and composition of soil bacterial communities in Northeast China., 2010, 46: 119-124.
[6] VOURLITIS G L, ZORBA G, PASQUINII S C, ROBERT M. Chronic nitrogen deposition enhances nitrogen mineralization potential of semiarid shrubland soils., 2007, 123(1): 836-842.
[7] ZEGLIN L H, STURSOVA M, SINSABAUGH R L, COLLINS S L. Microbial responses to nitrogen addition in three contrasting grassland ecosystems., 2007, 154(2): 349-359.
[8] ROEM W J, BERENDSE F. Soil acidity and nutrient supply ratio as possible factors determining changes in plant species diversity in grassland and heathland communities., 2000, 92(2): 151-161.
[9] GUSEWELL S. N:P ratios in terrestrial plants: variation and functional significance: Tansley review., 2004, 164(2): 243-266.
[10] HATI K M, MANDAL K G, MISRA A K, GHOSH P K, BANDYOPADHYAY K K. Effect of inorganic fertilizer and farmyard manure on soil physical properties, root distribution, and water-use efficiency of soybean in Vertisols of central India., 2006(97): 2182-2188.
[11] BHATTACHARYYA R, CHANDRA S, SINGH R D, KUNDU S, SRIVASTVA A K, GUPTA H S. Long-term farmyard manure application effects on properties of a silty clay loam soil under irrigated wheat-soybean rotation., 2007, 94: 386-396.
[12] SUN R, ZHANG X, GUO X, WANG D, CHU H. Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw., 2015, 88: 9-18.
[13] GE G, LI Z, FAN F, CHU G, HOU Z, LIANG Y. Soil biological activity and their seasonal variations in response to long-term application of organic and inorganic fertilizers., 2010, 326: 31-44.
[14] ABBOTT L K, MURPHY D V.. Netherlands: Kluwer Academic Publishers, 2003.
[15] BERTHRONG T, BUCKLEY D H, DRINKWATER L E. Agricultural management and labile carbon additions affect soil microbial community structure and interact with carbon and nitrogen cycling., 2013, 66(1): 158-170.
[16] WEI D, YANG Q, ZHANG J Z, WANG S, CHEN X, ZHANG X, LI W Q. Bacterial communities structure and diversity in a black soil as affected by long-term fertilization., 2008,18(5): 582-592.
[17] RAJKUMAR M, SANDHYA S, PRASAD M N V, FREITAS H. Perspectives of plant-associated microbes in heavy metal phytoremediation., 2012, 30(6): 1562-1574.
[18] SOLOMON S. IPCC(2007): Climate change the physical science basis., 2007, 9(1): 123-124.
[19] WU M N, QIN H L, CHEN Z, WU J S, WEI W X. Effect of long-term fertilization on bacterial composition in rice paddy soil., 2011, 47(4): 397-405.
[20] NGOSONG C, JAROSCH M, RAUPP J, NEUMANN E, RUESS L. The impact of farming practice on soil microorganisms and arbuscular mycorrhizal fungi: Crop type versus long-term mineral and organic fertilization., 2010, 46: 134-142.
[21] YAN Y C, YAN R R, CHEN J Q, XIN X P, ELDRIDGE D J, SHAO C L, WANG X, LV S J, JIN D Y, CHEN J Q, GUO Z J, CHEN B R, XU L J. Grazing modulates soil temperature and moisture in a Eurasian steppe., 2018, 262: 157-165.
[22] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 1981.
BAO S D.. Beijing: China Agricultural Press, 1981. (in Chinese)
[23] KUO S. Phosphorus//SPARKS D L, PAGE A L, HELMKE P A, LOEPPERT R H, SOLTANPOUR P N, TABATABAI M A, JOHNSTON C T, SUMNER M E.SSSA and ASA, Madison, 869-920.
[24] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000.
LU R K.. Beijing: China Agricultural Science and Technology Press, 2000. (in Chinese)
[25] CHU H Y, FU J T, MORIMOTO S, LIN X G, YANG K, HU J L, ZHANG J B. Community structure of ammonia-oxidizing bacteria under long-term application of mineral fertilizer and organic manure in a sandy loam soil., 2007, 73: 485-491.
[26] WU M, QIN H, CHEN Z, WU J, WEI W. Effect of long-term fertilization on bacterial composition in rice paddy soil., 2011, 47: 397-405.
[27] DAQUIADO A R, KUPPUSAMY S, KIM S Y, KIM J H, YOON Y E, KIM P J, OH S H, KWAK Y S, LEE Y B. Pyrosequencing analysis of bacterial community diversity in long-term fertilized paddy field soil., 2016, 108: 84-91.
[28] ZHONG W H, GU T, WANG W, ZHANG B, LIN X G, HUANG Q R, SHEN W S. The effects of mineral fertilizer and organic manure on soil microbial community and diversity., 2010, 326: 511-522.
[29] CHEN Y, ZHANG X D, HE H B, XIE H T, YAN Y, ZHU P, REN J, WANG L C. Carbon and nitrogen pools in different aggregates of a Chinese Mollisol as influenced by long-term fertilization., 2010, 10: 1018-1026.
[30] MARIE ŠTÝBNAROVÁ, PAVLÍNA MIČOVÁ, KAREL FIALA, HANA KARABCOVÁ, OLDŘICH LÁTAL, JAN POZDÍŠEK. Effect of organic fertilizers on botanical composition of grassland, herbage yield and quality., 2014, 60(3): 87-97.
[31] CHEN D, YUAN L, LIU Y R, JI J H, HOU H Q. Long-term application of manures plus chemical fertilizers sustained high rice yield and improved soil chemical and bacterial properties.2017, 90: 34-42.
[32] ZHAO J, ZHANG R F, XUE C, XUN W B, SUN L, XU Y C, SHEN Q R. Pyrosequencing reveals contrasting soil bacterial diversity and community structure of two main winter wheat cropping systems in China., 2014, 67: 443-453.
[33] MARTIN H, BEAT F, JOCHEN M, PAUL M, FRANCO W. Distinct soil microbial diversity under long-term organic and conventional farming., 2015, 9: 1177-1194.
[34] XU J, LIU S J, SONG S R, GUO S L, TANG J J, JEAN W H Y, MA Y D, CHEN X. Arbuscular mycorrhizal fungi influence decomposition and the associated soil microbial community under different soil phosphorus availability.2018, 20: 181-190.
[35] KOPECKY J, KYSELKOVA M, OMELKA M, CERMAK L, NOVOTNA J, GRUNDMANN G L, YVAN M L, MARKETA S M. Actinobacterial community dominated by a distinct clade in acidic soil of a waterlogged deciduous forest., 2011, 78: 386-394.
[36] SUN J, ZHANG Q, ZHOU J, WEI Q. Pyrosequencing technology reveals the impact of different manure doses on the bacterial community in apple rhizosphere soil., 2014, 78: 28-36.
[37] WANG Q F, JIANG X, GUAN D W, WEI D, ZHAO, B S, MA M C, CHEN S F, LI L, CAO F M, LI J. Long-term fertilization changes bacterial diversity and bacterial communities in the maize rhizosphere of Chinese Mollisols., 2017, 125: 88-96.
[38] CHEN X, JIANG N, CHEN Z H, TIAN J H. Response of soil phoD phosphatase gene to long-term combined applications of chemical fertilizers and organic materials., 2017, 119: 197-204.
[39] LI M, JAIN S, DICK G J. Genomic and transcriptomic resolution of organic matter utilization among deep-Sea bacteria in Guaymas basin hydrothermal plumes., 2016, 7: 1125.
[40] LINO T, MORI K, UCHINO Y, NAKAGAWA T, HARAYAMA S, SUZUKI K.gen. nov., sp. nov., a moderately thermophilic anaerobic bacterium isolated from microbial mats at a terrestrial hot spring and proposal ofclassis nov., for a novel lineage at the periphery of green sulfur bacteria., 2010, 60: 1376-1382.
[41] PODOSOKORSKAYA O, KADNIKOV V, GAVRILOV S N, MARDANOV A V, MERKEL A Y, KARNACHUK O V, RAVIN N V, BONCH E A, KUBLANOV I V. Characterization of Melioribacter roseus gen. nov., sp. nov., a novel facultatively anaerobic thermophilic cellulolytic bacterium from the class Ignavibacteria, and a proposal of a novel bacterial phylum Ignavibacteriae., 2013, 15: 1759-1771.
[42] BURNS R G, DEFOREST J L, MARXSEN J, SINSABAUGH R L, STROMBERGER M E, WALLENSTEIN M D, WEINTRAUB M N, ZOPPINI A. Soil enzymes in a changing environment: Current knowledge and future directions., 2013, 58: 216-234.
[43] LIU W X, WANG Q L, WANG B Z, WANG X B, FRANKS A E, TENG Y, LI Z G, LUO Y M. Changes in the abundance and structure of bacterial communities under long-term fertilization treatments in a peanut monocropping system., 2015, 395: 415-427.
[44] YOON J H, CHOI J H, KANG S J, CHOI N S, LEE J S, SONG J J.gen. nov., sp. nov., a cellulose-degrading bacterium isolated from forest soil from Naejang Mountain in Korea., 2010, 60: 615-619.
[45] VERASTEGUI Y, CHENG J, ENGEL K, KOLCZYNSKI D, MORTIMER S, LAVIGNE J, MONTALLBET J, ROMANTSOV T, HALL M, MCCONKEY B J, ROSE D R, TOMASHEK J J, SCOTT B R, CHARLES T C, NEUFELD J D. Multisubstrate isotope labeling and metagenomic analysis of active soil bacterial communities., 2014, 5: e1157-14.
[46] ZHANG Q, ZHANG W. Microbial flora analysis for the degradation of beta-cypermethrin.. 2017, 24: 6554-6562.
[47] SHEN Z Z, WANG D S, RUAN Y Z, XUE C, ZHANG J, LI R, SHEN Q R. Deep 16S rRNA pyrosequencing reveals a bacterial community associated with banana Fusarium wilt disease suppression induced by bioorganic fertilizer application., 2014, 9(5): e98420.
[48] XUN W B, HUANG T, ZHAO J, RAN W, WANG B, SHEN Q R, ZHANG R F. Environmental conditions rather than microbial inoculum composition determine the bacterial composition, microbial biomass and enzymatic activity of reconstructed soil microbial communities., 2015, 90: 10-18.
[49] WEI M, HU G Q, WANG H, BAI E, LOU Y H, ZHANG A J, ZHU GE Y P. 35 years of manure and chemical fertilizer application alters soil microbial community composition in a fluvo-aquic soil in Northern China., 2017, 82: 27-34.
[50] WANG Q F, JIANG X, GUAN D W, WEI D, ZHAO B S, MA M C, CHEN S F, LI L, CAO F M, LI J. Long-term fertilization changes bacterial diversity and bacterial communities in the maize rhizosphere of Chinese Mollisols., 2017, 125: 88-96.
Effects of Organic Fertilizer on Soil Bacterial Community Diversity inSteppe
SHANG LiRong, WAN LiQiang, LI XiangLin
(Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193)
【】In order to provide a practical and scientific basis for improvement, restoration and reasonable use of degraded grassland, the effects of different organic fertilizers on soil nutrient status and soil bacterial diversity were revealed in the naturalsteppe degraded grassland in Hulunbeier. 【】The field experiments were designed by single factor randomized block design, and the seven treatments were as follows: the control (ck), vermicompost 15 t·hm-2(a1), 30 t·hm-2(a2), 45 t·hm-2(a3), mushroom residues 15 t·hm-2(b1), 30 t·hm-2(b2), 45 t·hm-2(b3). Combined with the physical and chemical properties of soil, this study used the high-throughput sequencing technology of Miseq to analyze the effects of different organic fertilizer treatments on the diversity of soil bacterial communities, and to explore the environmental drivers of bacterial community changes under different organic fertilizer treatments. 【】The results showed that organic fertilization improved the soil nutrient status and shaped the distinct bacterial communities. Compared with ck, the AP content increased significantly by 37.27% under a3 treatment. AK content under b3 and a3 treatments increased significantly by 62.99% and 40.53% compared with the control, respectively. And aboveground biomass was significantly higher than other treatments under b3 treatment (244.11 g·m-2). Moreover, vermincompost and mushroom residues fertilizers significantly increased the richness of the bacterial community. Compared with ck, the richness index increased significantly under a1 and b2 treatments. At the phylum level, a total of 31 taxa were obtained from 21 samples. Actinobacteria, Proteobacteria, Acidobacteria, Verrucomicrobia and Chloroflexi were the dominant groups, and relative abundances account for the bacterial community 85% or more. Actinomycetes were the most abundant under a2 treatment (36.79%). Proteobacteria was higher under b1 and b3 treatments (23.29% and 22.32%, resptectively). Acidobacteria was the highest under a1 treatment (20.69%). And LEfSe showed that more bacterial taxonomic groups were detected under b3 treatment (17 clades, 1 class, 1 order, 4 families and 11 genera). In addition, AN (=0.001), AK (=0.005), and SOM (=0.006) had extremely significant effects on the composition of bacterial communities in the soil (<0.01), while TK (=0.014) had not. The composition of soil bacterial community had a significant effect (<0.05). It showed that AN, AK, SOM and TK were the main driving factors of bacterial community.【】Organic fertilizer changed the soil bacterial community structure insteppe. Our results indicated vermicompost and mushroom residues at 45 t·hm-2increased available nutrient content, but also enhanced the biodiversity of soil bacterial communities in the grasslands of, which contributed to the sustainable development of grassland agro-ecosystems.
organic fertilizer; soil nutrient; soil bacterial community;steppe

10.3864/j.issn.0578-1752.2020.13.010
2019-08-12;
2019-12-25
国家重点研发计划(2016YFC0500608-2)、国家牧草产业技术体系项目(CARS-34)
商丽荣,E-mail:slr2738156002@163.com。通信作者万里强,Tel:13264058879;E-mail:wanliqiang@caas.cn。通信作者李向林,Tel:13501062212;E-mail:lxl@caas.cn
(责任编辑 林鉴非,李云霞)
