云南芒果采后炭疽病病原菌的鉴定及室内生防菌的筛选
2020-07-30杨苑郭永福唐浩智张彪史龚林汪娅婷杨俊魏兰芳
杨苑, 郭永福, 唐浩智, 张彪, 史龚林, 汪娅婷, 杨俊, 魏兰芳
1.云南农业大学资源与环境学院, 昆明 650201;
2.云南农业大学植物保护学院, 昆明 650201;
3.云南农业大学实践教学条件管理中心, 昆明 650201
芒果(MangiferaindicaL.)为漆树科芒果属常绿大乔木,其外形美观、果实口感独特且营养丰富,并具有较高的经济价值。芒果的主要种植区为亚洲南部热带的国家和地区。我国芒果的主要种植区域分布在热带、亚热带地区,沿海地区以海南、广西、广东、福建和台湾等为主,内陆则以云南和四川居多。芒果产业经过多年发展,已成为中国热区农业重要的经济收入[1-3]。云南是中国重要的芒果种植区,主要分布在滇西和滇南区域。近年来,随着消费者对云南芒果需求量的增加,芒果在云南省的种植面积日趋扩大,而且不断引入和推广新品种,但这也为云南芒果病虫害的流行和发生创造了有利条件,从而加重了云南芒果炭疽病害的发生[4]。芒果炭疽病全生育期均可发生,病原菌具有潜伏侵染特性,病原菌菌丝体或孢子初期借助雨水和昆虫侵入植株潜育,在幼果期侵染幼果,多数为潜伏侵染,导致贮运期果实的腐烂的病果率为30%~50%,严重可达100%,造成了严重的经济损失,这成为制约芒果产业发展的主要因素之一[5-7]。有研究表明,贵州、广西芒果炭疽病均由胶孢炭疽菌(Colletotrichumgloeosporioides)引起[8-9];陈亭妤等[10]对台农芒采后炭疽病分离的38株病原菌进行了鉴定,分别为暹罗炭疽菌(C.siamense)、亚洲炭疽菌(C.asianum)和果生炭疽菌(C.fructicola)。然而,目前少有研究报道云南省芒果采后炭疽病的病原菌,因此明确云南芒果采后炭疽病的病原菌尤为重要。
目前,生产上针对芒果炭疽病的防治主要是依赖多菌灵、苯来特和甲基硫菌灵等农药[11]。过量使用农药易引起抗药性,破坏生态系统;农药残留对人类也存在安全问题[12]。生物防治因其无毒、无残留且不破坏生态系统而受到广泛关注。现已报道的芒果炭疽菌生防细菌主要以芽孢杆菌属为主,如从红树植物秋茄(Kandeliacandel)体内分离的内生解淀粉芽孢杆菌分泌的一类抗菌蛋白对C.gloeosporioides具有较强的拮抗作用[13];任建国等[14]从芒果根部土壤中分离得到4株芽孢杆菌属生防菌对芒果炭疽病病原菌具有抑制作用,并且能通过诱导芒果植株苯丙氨酸解氨酶(phenylanlanine ammonialyase,PAL)、多酚氧化酶(polyphenol oxidase,PPO)与过氧化物酶(peroxidase,POD)活性的显著提高来提高芒果对病原菌的抗性。此外,研究表明,荧光假单胞菌(Pseudomonasfluoresceas)能通过诱导芒果植株的抗性来阻止芒果炭疽病病原菌的入侵[15]。现报道的生防细菌多用来进行种植生长期植株的防治[16-18];也有少量针对芒果采后炭疽病生物防治的研究,如采用水杨酸与木霉菌混合对芒果进行浸泡可降低采后芒果炭疽病的发生[19]。因此,发掘芒果采后炭疽病的高效生防细菌,对芒果采后炭疽病的生物防治具有重要意义。基于此,本研究采用形态学特征观察和rDNA-ITS序列分析对云南芒果采后炭疽病病原菌进行鉴定,并利用实验室已有的生防芽孢杆菌和抗生素溶杆菌开展病原菌生防细菌的筛选,以期为芒果采后炭疽病的生物防治产品的开发与推广提供新的思路和可靠的理论依据。
1 材料与方法
1.1 实验材料
1.1.1供试芒果 本研究所用芒果种植于云南省元江县白谷冲种植基地,品种为金煌芒(MangiferaindicaLinn.)。其中,病果为采后3~5 d发现病状的果实,发病率约为40%;用于回接验证实验的健康果为采后2周未发病的果实。
1.1.2供试生防细菌 抗生素溶杆菌菌株L-44、L-114、L-117由云南农业大学生物多样性与病害控制国家工程中心细菌研究室提供;菌株W-1、W-2由云南农业大学实践教学条件管理中心微生物实验室从紫茎泽兰根际土壤中分离获得,经鉴定分别为枯草芽孢杆菌和解淀粉芽孢杆菌。
1.1.3培养基与试剂 用于病原菌分离培养的培养基为马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,115 ℃灭菌20 min;用于抑菌实验的培养基为营养琼脂(nutrient agar,NA;pH 7.0)培养基:蛋白胨5 g,葡萄糖10 g,牛肉浸膏3 g,酵母膏1 g,琼脂20 g,蒸馏水1 000 mL,115 ℃灭菌20 min。上述化学试剂(分析纯)均购于天津市凤船化学试剂科技有限公司。2×EasyTaqPCR SuperMix购于北京擎科生物科技有限公司昆明分公司,引物也由此公司合成。
1.2 仪器与设备
Gsp-9160MBE恒温培养箱(上海博迅医疗生物仪器股份有限公司),TP600 PCR仪(日本Takara公司),DYY-6D电泳仪(北京六一生物科技有限公司),5810高速冷冻离心机(德国Eppendorf公司),ChemiDoc XRS+紫外凝胶成像系统(美国Bio-Rad公司)。
1.3 实验方法
1.3.1病原菌的分离、纯化与培养 芒果采后炭疽病病原菌的分离参照赵超等[20]的方法并进行改进。用自来水清洗发病芒果果实表面,再用无菌水冲洗,于病、健交界处切取5 mm×5 mm的表皮组织块,在75%酒精中浸泡60 s,取出后用无菌水漂洗3次,晾置3~5 min,再将表面消过毒的表皮放置在PDA平板上(每组处理设3组平行实验),置于26 ℃培养,待组织块周围长出菌体,边缘挑取新生菌丝块(1 cm×2 cm)转接到新的PDA培养平板上,最后采用单株分离的方法纯化来获得病原菌菌株。
1.3.2病原菌形态学初步鉴定 在已灭菌的载玻片中央滴一滴PDA固体培养基,待其冷却后挑取微量已分离纯化好的菌株于其上,盖上盖玻片用接种环后端轻轻按压使培养基均匀分布,加入少量无菌水,26 ℃培养5 d,在显微镜下观察菌丝及孢子形态特征。
1.3.3病原菌的致病性测定 依照柯赫氏法则,将分离所得病原菌回接至无病害的健康芒果,置于26 ℃培养,观察并记录侵染特征。侵染后挑取侵染区病原菌再次进行分离鉴定[21],具体操作如下:取健康无病芒果,自来水将果皮表面清洗干净,75%酒精中浸泡60 s,取出后用无菌水清洗3次,每次30 s。将表面水分用吸水纸或者灭菌滤纸去除,随后采用针刺伤口接种法进行接种,每个果实接种针刺4个点,将1.3.1分离菌株培养7 d后的菌丝块(直径约为5 mm)紧贴于针刺点,培养基侧位于外侧,空白对照为接种无菌的PDA培养基,放置于保鲜盒中(放入2张无菌滤纸在保鲜盒底部,并加约5 mL无菌水进行保湿处理),于26 ℃培养箱中培养,并观察记录其发病情况。按组织分离方法从接种后的发病组织中再次分离病原菌,若两次分离的菌株在显微镜下观察形态一致则可以确定为病原菌。
1.3.4病原菌分子生物学鉴定 对已分离菌株进行活化,用灭菌的打孔器取新鲜菌丝块(d=5 mm),将其接种于PDA平板上(d=90 mm),置于26 ℃恒温培养箱中,培养5 d。待其铺满平板,刮取表面的菌丝备用。采用CTAB法提取经致病性验证的菌株的总DNA,釆用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增,以基因组DNA为模板。PCR反应体系(25 μL)为:2×EasyTaqPCR SuperMix 12 μL,DNA(约50 ng·μL-1) 1 μL,ITS1(10 μmol·L-1)1 μL,ITS4(10 μmol·L-1) 1 μL,ddH2O 10 μL。反应程序为:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min。PCR产物经1.0%琼脂糖凝胶电泳检测,进行回收纯化。将PCR产物交由上海生工生物工程有限公司进行测序。再将得到的rDNA-ITS序列在GenBank数据库进行BLAST比对,获得相似性高的序列以确定其分类学地位,并用MEGA 5.0软件构建系统发育树。
1.3.5室内生防细菌的筛选 生防细菌的活化:将低温保存的生防细菌用平板划线法接种到NA平板上,于28 ℃培养箱内培养48 h。
菌悬液的制备:将活化后的生防菌分别接入装有50 mL的无菌NA液体培养基的三角瓶中(以无菌NA液体培养基作为空白对照),置于28 ℃、160 r·min-1摇床上培养48 h。用600 nm波长、1 cm比色皿测定其OD值,并用无菌水稀释使得菌悬液的OD值为0.5,备用。
室内平板拮抗实验:为了测定病原菌抑菌作用,在NA平板中心接种病原菌菌盘(d=5 mm),将灭菌滤纸片放到距离病原菌菌盘2 cm处(间隔120°,放置3个无菌滤纸片),菌株W-1、W-2、L-114、L-117、L-44,以无菌水为空白对照,并用移液器向滤纸小圆片上注入10 μL菌悬液,置于26 ℃培养箱中培养,观察抑菌效果,并测定抑制率[19]。
2 结果与分析
2.1 病原菌形态学初步鉴定
在芒果炭疽病果实病斑处采用组织分离法[22]分离到芒果炭疽病病原菌菌株wm10(共分离纯化得到13株,经鉴定均为同一菌种,用菌株wm10做后续实验)。菌株wm10在PDA培养基平板上菌落为圆形,边缘整齐。菌落的生长从中央到边缘由原来的白色逐渐转为灰白色;wm10的菌丝呈绒毛状,7 d左右中央菌丝上出现褐色分生孢子堆(图1);利用显微镜观察分生孢子单胞,呈棍棒形、两端钝圆、无色透明(图1)。与James等[23]和Prihastuti等[24]描述的分离自芒果和咖啡豆的病原菌C.asianum显微观察形态结果相一致,故将分离的病原菌菌株wm10初步鉴定为Colletotrichum属。
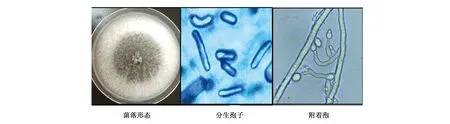
图1 病原菌的形态特征Fig.1 The morphology of pathogen
2.2 病原菌的致病性测定
利用针刺接种法将病原菌wm10接种到健康芒果果实,接种口在接种病原菌12 h后颜色变黑,2 d后接种口伴随着长出白色菌丝,4 d后症状明显:在接种口处出现黑色的圆形或近圆形病斑,略凹陷,且病、健交界的部位最明显(图2)。7 d后病斑扩大至直径2.5~3.2 cm,病斑表面会产生大量黑色小颗粒。后期病斑愈合连成大斑块,病部常深入到果肉,果实表面附着白色菌丝,最后果肉液化、流汁,逐渐导致全果腐烂;对照不发病(图2)。回接病原菌的芒果所产生的浸染特征与芒果炭疽病病果的病状一致,且从回接病原菌芒果中分离出了与菌株wm10形态特征一致的菌株。由此表明:引起云南芒果采后炭疽病的病原菌为炭疽菌属(Colletotrichum)。

图2 wm10的致病性验证实验Fig.2 Pathogenicity test results of wm10
2.3 分子生物学鉴定
利用引物ITS1和ITS4对wm10菌株总DNA进行PCR扩增以获得rDNA-ITS序列。PCR产物经测序得到菌株wm10的ITS序列长度为536 bp,登录号MH744668。将该序列在NCBI上进行BlastN比对,菌株wm10的ITS序列与GenBank已提交的C.gloeosporioides菌株的ITS序列(登录号:MH400757、KC816034、HQ874882)相似性为99%。通过N-J法进行系统发育树构建(图3),结果显示该病原菌与其他明确的C.gloeosporioides聚为同一分类,可以确定菌株wm10为胶孢炭疽病菌C.gloeosporioides,分子生物学鉴定结果与病原菌的形态鉴定结果一致。因此,引起芒果炭疽病病原菌wm10为C.gloeosporioides。
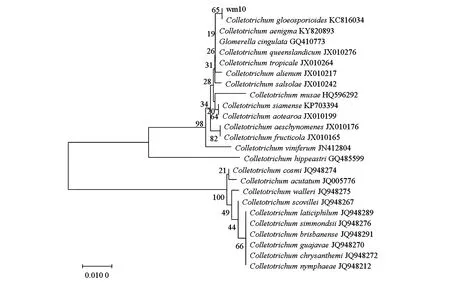
图3 基于ITS序列的系统发育树Fig.3 The phylogenetic tree based on ITS sequence
2.4 5株生防细菌对病原菌的抑制效果
通过室内平板拮抗实验结果(表1和图4)可知,菌株W-1、W-2、L-114、L-117、L-44对芒果炭疽病病原菌均有较强的抑制作用,其中抗生素溶杆菌L-44的抑制效果最强,抑制率达53.7%;抑菌效果最弱的菌株为枯草芽孢杆菌,抑制率为34.0%,但抑菌效果依然明显。

表1 5株生防细菌对芒果炭疽病病原菌的拮抗结果Table1 Antagonistic results of five biocontrol bacteria against Colletotrichum gloeosporioides
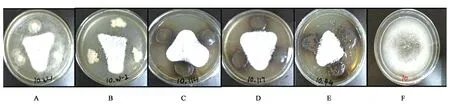
A:枯草芽孢杆菌W-1;B:枯草芽孢杆菌W-2;C:抗生素溶杆菌L-114;D:抗生素溶杆菌L-117;E:抗生素溶杆菌L-44;F:空白对照
3 讨论
本研究针对云南发病芒果的炭疽病,结合传统的形态学观察和rDNA-ITS序列分析方法对分离所得病原菌进行鉴定,鉴定胶孢炭疽病(C.gloeosporioides)为病原菌,与杨子祥等[25]从云南省干热河谷芒果园芒果炭疽病病叶上分离得到的病原菌相同。本研究结果可为云南省采后芒果病害准确鉴定和监测提供重要依据,也为后续炭疽病病害的生物防控提供了病原靶标。
炭疽病菌是一类地理分布与寄主范围都广泛的病原真菌,许多植物均有发生炭疽病害[26]。胶孢炭疽菌对储藏期芒果危害极大,导致芒果果实的腐烂,造成严重的经济损失,因此在植物病原真菌中占有较重要的地位。国外近年来也开展了芒果采后病害的生物防治研究,筛选到巨大芽孢杆菌 (Bacillusmegaterium)、魔普假丝酵母菌(Candidamembranifaciens)、木霉菌(Trichodermaasperellum) 等生防菌株用于芒果采后病害的生物防治[27-29]。抗生素溶杆菌作为新型的生防微生物资源已被应用于多种作物病害的防治,如抗生素溶杆菌已用于十字花科根肿病、番茄细菌性疮痂病等真菌、细菌病害的生物防治[30-31]。但是,抗生素溶杆菌应用于芒果采后病害还未见报道。本研究测定了5种生防细菌对该病原菌抑制效果,结果证明5种生防菌对该病原菌均有不同的抑菌效果,其中以抗生素溶杆菌菌株L-44抑制效果最为明显,但抗生素溶杆菌菌株对芒果炭疽病的生防作用机制、采后的生物防治方式以及效果评价还需进一步探究。总体而言,生防制剂具有较好的研究价值和开发应用前景,可以作为化学杀菌剂的替代品。本研究结果为芒果采后炭疽病的防治提供了一定的理论依据。
