负载零价铜的纳米多孔碳材料催化氧化罗丹明B的研究
2020-07-30王爱德冯振东覃大禹张丽娟朱丽丽张善发陶虎春
王爱德 冯振东 覃大禹 张丽娟 朱丽丽 张善发 陶虎春,†
负载零价铜的纳米多孔碳材料催化氧化罗丹明B的研究
王爱德1冯振东1覃大禹2张丽娟1朱丽丽1张善发1陶虎春1,†
1.深圳市重金属污染控制与资源化重点实验室, 北京大学深圳研究生院环境与能源学院, 深圳 518055; 2.中山大学物理学院, 广州 510275; †通信作者, E-mail: taohc@pkusz.edu.cn
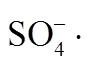
MOF材料; 纳米多孔碳材料; 零价铜; 过硫酸盐; 罗丹明B (RhB)

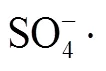
利用金属有机框架(metal organic framework, MOF)材料作为模板合成 NPCs, 已被证明是一种制备负载金属的纳米多孔碳材料(NPC@M)的有效方法[11–12]。通过在惰性气体中高温裂解 MOF 材料, 可以直接合成负载零价金属的纳米多孔碳材料。与传统方法相比, 该方法具有金属负载率高、形貌良好的优点, 有利于催化氧化反应。HKUST-1 是以Cu(II)离子为金属配位中心, 以均三苯甲酸为有机配体的MOF 材料[13], 具有合成简单、易功能化和孔径分布规则等优点, 是合成 NPC@Cu 的理想模板[13–17]。
本文通过在氩气氛围下高温裂解类 HKUST-1模板, 利用一步碳化法, 直接原位制备负载零价铜的纳米多孔碳材料(NPC@Cu), 并且将其应用在过一硫酸盐体系(peroxymonosulfate system, PMS)中, 氧化降解模拟的罗丹明 B (RhB)染料废水。探究NPC @Cu 的用量、PMS 的用量和初始 pH 值对降解反应的影响, 并分析参与降解反应的活性自由基, 探讨可能的反应机理。
1 材料与方法
1.1 仪器与试剂
主要试剂有三水合硝酸铜(Cu(NO3)2·3H2O, 广州化学试剂厂)、1,3,5-苯三甲酸(H3BTC, 上海阿拉丁生化科技股份有限公司, 98%)、无水乙醇(南京化学试剂股份有限公司)、叔丁醇(上海凌峰化学试剂有限公司)、罗丹明B (天津市科密欧化学试剂有限公司)和过硫酸氢钾复合盐(上海阿拉丁生化科技股份有限公司)等, 试剂均为分析纯, 采用去离子水配制。
主要仪器包括 pH 计(pH610, Trans Wiggens Instruments, 德国)、紫外可见光分光光度计(DR-6000, Hach Company, 美国)、超声仪(SK8200H, 上海科导超声仪器有限公司)、电子分析天平(A124S, 德国赛多利斯)、真空干燥箱(DZF-6020, 上海浦东荣丰科学仪器有限公司)和原子吸收分光光度计(TAS990, 北京普析通用)。
1.2 催化剂的制备
1.2.1 类 HKUST-1 模板的合成
按照 Chui 等[13]的方法制备类 HKUST-1 模板。首先, 称取 5.0g 的 Cu (NO3)2·3H2O (24mmol), 加入盛有 250mL 去离子水的烧杯中, 称取 10.0g(43mmol)1,3,5-苯三甲酸, 加入盛有 250mL 无水乙醇的烧杯中。超声溶解后, 先后加入盛有 250mL DMF 的 1 L 宽口玻璃瓶中。然后, 将 1 L 宽口玻璃瓶密封, 放到真空干燥箱中, 在 85℃下加热 20 小时。产生小的八面体晶体。冷却至室温后拿出该玻璃瓶, 倒出剩余反应液, 用DMF 洗涤(3×10mL)。在装有样品的三角瓶中装满二氯甲烷, 放置 3 天, 在此期间, 活化溶剂更换 3 次。最后, 通过真空170℃加热将溶剂去除, 获得MOF材料。
1.2.2 NPC@Cu的制备
按照 Pachfule 等[18]的方法制备 NPC@Cu。将活化后的类 HKUST-1 模板转移到陶瓷皿中, 并将该陶瓷皿放入管式炉内, 通氩气。以 5℃/min 的速率, 将样品从室温加热至 650℃, 然后在氩气流中恒温保持 2 小时。炉子在氩气的氛围下自然冷却到室温, 得到 NPC@Cu材料。
1.3 材料的表征
本文采用场发射扫描电子显微镜(SEM, ZEISS SUPRA® 55, 德国Carl Zeiss)检测样品的结构及形貌特征。采用 X 射线衍射仪(XRD, D8-Advance, 德国 Bruker)测定晶相结构。采用 X 射线光电子能谱仪(XPS, ESCALAB 250X, 英国 Thermo Fisher 公司)分析价态。用比表面积分析仪(ASAP 2020 HD88, 麦克默瑞提克(上海)仪器有限公司)测试比表面积。
1.4 降解罗丹明 B 实验
移取 100 mL 的罗丹明 B 溶液(0.10mmol/L)于250mL 锥形瓶中, 加入一定量的 PMS 氧化剂, 用HCl 和 NaOH 溶液(100mmol/L)调节至 pH=7, 快速加入适量催化剂后, 立即将锥形瓶放入摇床中, 在150r/min 和 25℃条件下开始降解反应。反应开始后, 按设计的时间间隔, 移取 1mL 水样于比色管中, 并立刻加入等体积的乙醇, 淬灭未反应的自由基。将水样稀释至 1/10 后, 采用紫外–可见光分光光度计在 554 nm 波长下测定其中罗丹明 B 的浓度。降解反应结束后, 用玻璃纤维膜过滤分离催化剂, 用乙醇和水反复洗涤后烘干回用。
2 结果与分析
2.1 NPC@Cu材料的表征
图 1(a)和(b)为 HKUST-1 的低倍数(500 倍)和高倍数(5000 倍) SEM 图像。从图 1(a)可以看出, 所制备的 MOF 粒径分布均匀, 基本上在 6~30μm 的范围内, 基本形态为正八面体, 分散性好。从图 1(b)可以看出, HKUST-1 表面光滑, 形状规整, 能清晰地看到八面体结构。HKUST-1 的电镜扫描图像与文献[19]一致, 表明 HKUST-1 被成功地合成。图 1(c)和(d)分别为制备的 NPC@Cu 的低倍数(1000 倍)和高倍数(10000 倍) SEM 图像。从图 1(c)可以看出, 在碳化之后, 虽然原有的结构表面被破坏, 但仍然在一定程度上保持 HKUST-1 晶体的原始形态。NPC@Cu 的大小和形状与模板材料 HKUST-1 相似, 粒径保持在 6~30μm 的范围内, 分散性好, 没有明显的团聚现象。从图 1(d)可以看出, 碳化后, 材料表面产生大量的孔隙和沟壑, 原来的 HKUST-1 结构已被破坏。
NPC@Cu 的 XRD 图谱如图 2 所示, 所得产物存在 5 个衍射峰, 最强衍射峰出现在 2=43.37°, 50.49°和 74.13°处, 均与单质铜(JCPDS-PDF#04-0836)的衍射峰相匹配, 说明主要产物含铜单质。同时, 有两个较弱的衍射峰出现在 35.58°和 38.66°处, 与 CuO 的衍射峰相吻合(JCPDS-PDF#45-0937), 说明还有部分CuO生成。
NPC@Cu 的 XPS 图谱如图 3 所示。图 3(a)为 Cu的 CuLM2 价态电子图谱, 在 568.5 和 572.3eV 处的峰分别对应 Cu 和 Cu(I)。图 3(b)为 Cu 的 Cu2p 的价态电子图谱, 在 932.7 和 933.9eV 处的峰分别对应Cu 和 Cu(II)。说明合成的材料里 Cu 的 3 种价态都存在, 与前面的 XRD 分析结果一致。
2.2 NPC@Cu/PMS 降解罗丹明 B 的影响因素
2.2.1 NPC@Cu投加量的影响
是否投加 NPC@Cu 对 PMS 降解罗丹明 B 效率的影响情况如图 4 所示。反应条件为[RhB]=0.10 mmol/L, [NPC@Cu]= 0.10 g/L, [PMS]=2.00 mmol/L,初始 pH=7.0。当体系中只存在 NPC@Cu 时, 对罗丹明 B 的去除率约为 12.07%, 说明 NPC@Cu 对 RhB有一定的吸附效果。只有 PMS 存在的条件下, 罗丹明 B 的去除率可达 74.36%, 说明PMS 能够氧化部分的 RhB, 但是降解不彻底。当体系中同时存在NPC@Cu 和 PMS 时, 罗丹明 B 的降解速率和降解率显著提高, 120min 降解率达到 99.63%。可见, NPC@Cu能够强化 PMS 的氧化能力, 提高对罗丹明 B 的降解效率[20]。
PMS 体系中催化剂投加量对罗丹明 B 降解效果的影响情况如图 5 所示。可以看出, 在 NPC@Cu 浓度从 0.05g/L 增至 0.10g/L 的过程中, RhB 降解率有显著的提升, 并且 0.05g/L 的最终降解率稳定在92%左右, 而 0.10g/L 的最终降解率为 99.13%, 基本上实现完全降解。其原因可能是, 当 PMS 充足时, 催化剂浓度的增加提供了更多的反应活性位点。但是, 在 NPC@Cu 浓度从 0.10g/L 增加至 0.25g/L的过程中, 反应速率并没有明显的提升, 最终也实现完全降解。可能的原因是, 催化剂有效活化位点已近饱和, PMS 浓度反而成为罗丹明 B 降解的限制条件[21], 因此确定 NPC@Cu 的最佳投加量为 0.10 g/L。
2.2.2 PMS投加量的影响
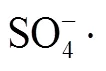
2.2.3 初始 pH 的影响

2.3 NPC@Cu 催化 PMS 降解罗丹明 B 的机理

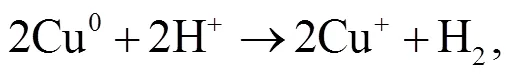
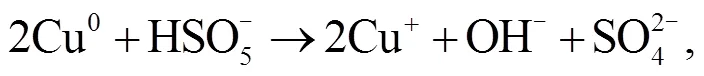
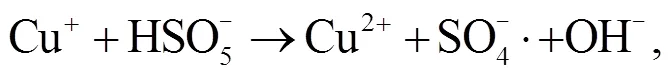
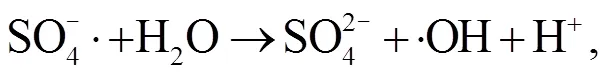
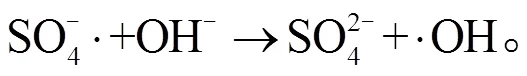


3 结论

[1] Lin Xueming, Ma Yongwen, Wang Yan, et al. Lithium iron phosphate (LiFePO4) as an effective activator for degradation of organic dyes in water in the presence of persulfate. RSC Advances, 2015, 5: 94694–94701
[2] Oh W D, Lim T T. Design and application of hetero-geneous catalysts as peroxydisulfate activator for organics removal: an overview. Chemical Enginee-ring Journal, 2019, 358: 110–133
[3] Waldemer R H, Tratnyek P G, Johnson R L, et al. Oxidation of chlorinated ethenes by heat-activated persulfate: kinetics and products. Environmental Science & Technology, 2007, 41(3): 1010–1015
[4] Malato S, Blanco J, Richter C, et al. Enhancement of the rate of solar photocatalytic mineralization of organic pollutants by inorganic oxidizing species. Ap-plied Catalysis B: Environmental, 1998, 17(4): 347–356
[5] Moreira F C, Boaventura R A R, Brillas E, et al. Electrochemical advanced oxidation processes: a re-view on their application to synthetic and real waste-waters. Applied Catalysis B: Environmental, 2017, 202: 217–261
[6] Wei Zongsu, Villamena F A, Weavers L K. Kinetics and mechanism of ultrasonic activation of persulfate: an in situ EPR spin trapping study. Environmental Science & Technology, 2017, 51(6): 3410–3417
[7] Xu Xiangrong, Li Xiangzhong. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion. Separation and Purification Technology, 2010, 72(1): 105–111
[8] Liang Chenju, Guo Yiyu. Mass transfer and chemical oxidation of naphthalene particles with zerovalent iron activated persulfate. Environmental Science & Technology, 2010, 44(21): 8203–8208
[9] Zhou Peng, Zhang Jing, Zhang Yongli, et al. Degrada-tion of 2,4-dichlorophenol by activating persulfate and peroxomonosulfate using micron or nanoscale zero-valent copper. Journal of Hazardous Materials, 2018, 344: 1209–1219
[10] Datta K K R, Reddy B V S, Ariga K, et al. Gold nanoparticles embedded in a mesoporous carbon ni-tride stabilizer for highly efficient three-component coupling reaction. Nanoparticle Catalysts, 2010, 49 (34): 5961–5965
[11] Liu Bo, Shioyama H, Jiang Hailong, et al. Metal-organic framework (MOF) as a template for syntheses of nanoporous carbons as electrode materials for supercapacitor. Carbon, 2010, 48(2): 456–463
[12] Salunkhe R R, Kaneti Y V, Kim J, et al. Nanoarchi-tectures for metal-organic framework-derived nano-porous carbons toward supercapacitor applications. Accounts of Chemical Research, 2016, 49(12): 2796–2806
[13] Chui S S Y, Lo S M F, Charmant J P H, et al. A chemically functionalizable nanoporous material [Cu3(TMA)2(H2O)3]. Science, 1999, 283: 1148–1150
[14] Huang Yuanbiao, Liang Jun, Wang Xusheng, et al. Multifunctional metal-organic framework catalysts: synergistic catalysis and tandem reactions. Chemical Society Reviews, 2017, 46(1): 126–157
[15] Lustig W P, Mukherjee S, Rudd N D, et al. Metal-organic frameworks: functional luminescent and pho-tonic materials for sensing applications. Chemical Society Reviews, 2017, 46(11): 3242–3285
[16] Zhao Meiting, Yuan Kuo, Wang Yun, et al. Metal-organic frameworks as selectivity regulators for hy-drogenation reactions. Nature, 2016, 539: 76–80
[17] Zhao Shenlong, Wang Yun, Dong Juncai, et al. Ul-trathin metal-organic framework nanosheets for elec-trocatalytic oxygen evolution. Nature Energy, 2016, 1: 1–10
[18] Pachfule P, Shinde D, Majumder M, et al. Fabrication of carbon nanorods and graphene nanoribbons from a metal–organic framework. Nature Chemistry, 2016, 8: 718–724
[19] Tan Peng, Xie Xiaoyan, Liu Xiaoqin, et al. Fabri-cation of magnetically responsive HKUST-1/Fe3O4composites by dry gel conversion for deep desul-furization and denitrogenation. Journal of Hazardous Materials, 2017, 321: 344–352
[20] Tan Chaoqun, Dong Yujie, Fu Dafang, et al. Chloram-phenicol removal by zero valent iron activated pero-xymonosulfate system: Kinetics and mechanism of radical generation. Chemical Engineering Journal, 2018, 334: 1006–1015
[21] Pu Jiayi, Wan Jinquan, Wang Yan, et al. Different Co-based MOFs templated synthesis of Co3O4nanopar-ticles to degrade RhB by activation of oxone. RSC Advances, 2016, 6(94): 91791–91797
[22] Chu Wei, Lau T K, Fung S C. Effects of combined and sequential addition of dual oxidants (H2O2/S2O82–) on the aqueous carbofuran photodegradation. Journal of Agricultural and Food Chemistry, 2006, 54(26): 10047–10052

[24] Liang Bingqing, Pang Daolin, Jin Chao, et al. Photo-oxidative degradation of poly(p-dioxanone) under ul-traviolet light source. Polymer Degradation and Sta-bility, 2012, 97(11): 2162–2169
[25] Wen Gang, Wang Shengjun, Ma Jun, et al. Oxidative degradation of organic pollutants in aqueous solution using zero valent copper under aerobic atmosphere condition. Journal of Hazardous Materials, 2014, 275: 193–199
[26] Muthukumari B, Selvam K, Muthuvel I, et al. Pho-toassisted hetero-Fenton mineralisation of azo dyes by Fe(II)-Al2O3catalyst. Chemical Engineering Jour-nal, 2009, 153: 9–15
[27] Zhao Jinying, Zhang Yaobin, Quan Xie, et al. En-hanced oxidation of 4-chlorophenol using sulfate radicals generated from zero-valent iron and peroxy-disulfate at ambient temperature. Separation and Purification Technology, 2010, 71(3): 302–307
Study on the Catalytic Oxidation of Rhodamine B by Nanoporous Carbon Materials Loaded with Zero Valence Copper
WANG Aide1, FENG Zhendong1, QIN Dayu2, ZHANG Lijuan1, ZHU Lili1, ZHANG Shanfa1, TAO Huchun1,†
1. Shenzhen Key Laboratory for Heavy Metal Pollution Control and Reutilization, School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; 2. School of Physics, Sun Yat-sen University, Guangzhou 510275; †Corresponding author, E-mail: taohc@pkusz.edu.cn
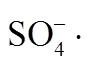
MOF materials; nanoporous carbon materials; zero-valent copper; persulfate; Rhodamine B (RhB)
10.13209/j.0479-8023.2020.033
深圳市基础研究项目(JCYJ20180503182130795)和流域生态工程学学科建设资金(深发改[2017]542号)资助
2019–05–13;
2019–05–22
