乙醇淬火对纳米CuO光催化剂的改性研究
2020-07-27胡陆国胡正发王银海
胡陆国,胡正发,2,肖 扬,王银海,赵 慧
(1. 广东工业大学 物理与光电工程学院,广东 广州 510006;2. 东源广工大现代产业协同创新研究院,广东 河源 517000)
CuO是一种窄带隙(1.59 eV)的p型过渡金属氧化物[9],广泛应用在锂离子电池[10]、光催化剂[11-12]、超级电容器[13]和传感器[14]领域。 近年来,不同形貌纳米CuO的合成已被广泛报道,例如纳米球[15]、纳米棒[16]、纳米阵列[17]和纳米管[18]。 此外,纳米氧化铜的合成方法也多种多样,例如沉淀法[19]、溶胶–凝胶法[20],水热合成法[21]和电化学法[22]。
虽然CuO的应用广泛,但由于其较低的光催化活性,单独用作光催化剂仍然不常见。在大多数文献中,CuO仅用作复合光催化剂的敏化剂,例如CuO/TiO2[23]、CuO/ZnO[24]和CuO/CeO2[25]。关于对纳米CuO进行表面修饰的报道也很少报道。
淬火工艺已经使用了数百年,用以改变材料的物理和化学性质。例如,淬火后将铁转化为耐腐蚀的高强度钢。我们之前已经研究了这种淬火工艺对纳米材料的表面改性。光催化反应主要发生在半导体光催化剂的表面,表面氧空位等缺陷常常有利于提高光催化活性,但体内缺陷不一定有利于光催化性能的提升,所以快速淬火方法能够在表面形成缺陷,从而提高光催化性能。陈世豪等[26]报道,经过乙醇淬火可以在TiO2纳米晶体的表面引入一些氧空位和羟基。肖扬等[27]也报道了一种通过乙醇淬火来改变SrTiO3表面环境的方法,该方法可增强SrTiO3在紫外光、可见光和红外光的吸收和光催化性能。
本文中,通过将纳米CuO(Nano-CuO)加热至高温,然后快速将其浸入无水乙醇中进行淬火对其表面进行修饰。结构分析表明,淬火后的CuO(QCuO)表面存在大量的氧空位,同时可能存在CuOCu2O异质结以及Cu-CuO/Cu2O肖特基异质结。 通过Q-CuO降解罗丹明B(RhB)染料,发现Q-CuO表现出更强的光催化活性。
1 实验
1.1 实验试剂
氧化铜纳米颗粒(99.6%,颗粒约40 nm)和无水乙醇均购自麦克林生化科技有限公司,所用试剂均为分析纯。试验所用的RhB溶液使用超纯水配制。
1.2 Q-CuO的合成
Q-CuO的合成过程如图1所示。用电子天平称量Nano-CuO 2 g,然后将其放入烧结舟中。当马弗炉加热到800 ℃时,将盛有Nano-CuO的烧结舟转移到马弗炉中,并在800 ℃保持20 min。打开马弗炉后,立即将烧结舟取出,并将Nano-CuO浸入室温条件下的40 mL无水乙醇中进行快速淬火。最后,将淬火的样品过滤,然后在80 ℃下干燥3 h,备用。

图 1 Q-CuO制备示意图Fig.1 Experimental procedure for absolute ethanol quenching of QCuO
1.3 样品表征
X射线衍射(XRD)图谱由XD-2型X射线衍射仪(普析通用仪器公司,北京)获得,管电压36 kV,管电流20 mA,2θ范围为10°至70°,扫描步长0.02°。用UV-3600 plus分光光度计(SHIMADZU,东京,日本)记录样品200~900 nm的紫外−可见漫反射吸收谱。样品的形貌和微观结构通过场发射扫描电子显微镜(FESEM,日立SU8220)和场发射透射电子显微镜(FETEM,Talos F200S)表征。电子顺磁共振光谱(electron paramagentic resonance, EPR)使用EMXplus-10/12光谱仪在室温下获得。X射线光电子能谱(XPS)在ESCALAB 250Xi仪器上用150 W Al Kα (hv=1486.6 eV)激发源进行测量,以C 1s作为参考(284.8 eV)。
1.4 光催化测试
RhB是一种红色有机染料,在光催化测试中被广泛用作模拟污染物。通过在500 W 汞灯模拟的紫外−可见光照射下监测水溶液中RhB的分解来评估制备的样品的光催化活性。将灯放置在圆柱形的耐热玻璃容器中,并通过循环水冷却将反应温度维持在约27 ℃。石英管用作光催化反应器。将催化剂(0.03 g)与RhB水溶液(40 mL,2×10−5mol/L)混合。在黑暗中搅拌30 min以达到催化剂和RhB溶液之间的吸附平衡,之后打开汞灯,将混合物暴露于紫外−可见光照射下。维持剧烈的磁力搅拌,以使催化剂悬浮在RhB溶液中。每20 min通过紫外可见光分光光度计测量离心后的RhB溶液在553 nm处的吸收峰强度来确定该RhB溶液的浓度。
2 结果与讨论
2.1 Q-CuO的表征
图2为制备样品的X射线衍射图。Nano-CuO的衍射图在32.48°, 35.49°, 38.69°, 48.66°, 53.41°, 58.25°,61.46°, 66.14°和68.01°C出现衍射峰,分别对应于氧化铜晶体的(110), ( 1¯11) , (111), (2 ¯02), (020), (202),( 1¯13 ), (022, 3 ¯11)和(220)晶面(JCPDS 80-1916)。QCuO在36.5°, 43.3°, 50.43°处出现3个新峰,分别对应于Cu2O的(111)晶面(JCPDS 77-0199)和铜的(111),(200)晶面(JCPDS 85-1326)。这表明通过乙醇淬火形成了Cu2O和Cu(具体的含量将在之后的XPS分析中进行计算),清晰的衍射峰表明样品的结晶度很高。
实验用废水取自河南一林造纸厂麦草浆制浆造纸废水处理站曝气池。该厂废水采用Biolak工艺处理。从表观上看,该废水样色度偏深,有恶臭味,含杂质多,水质见表1。
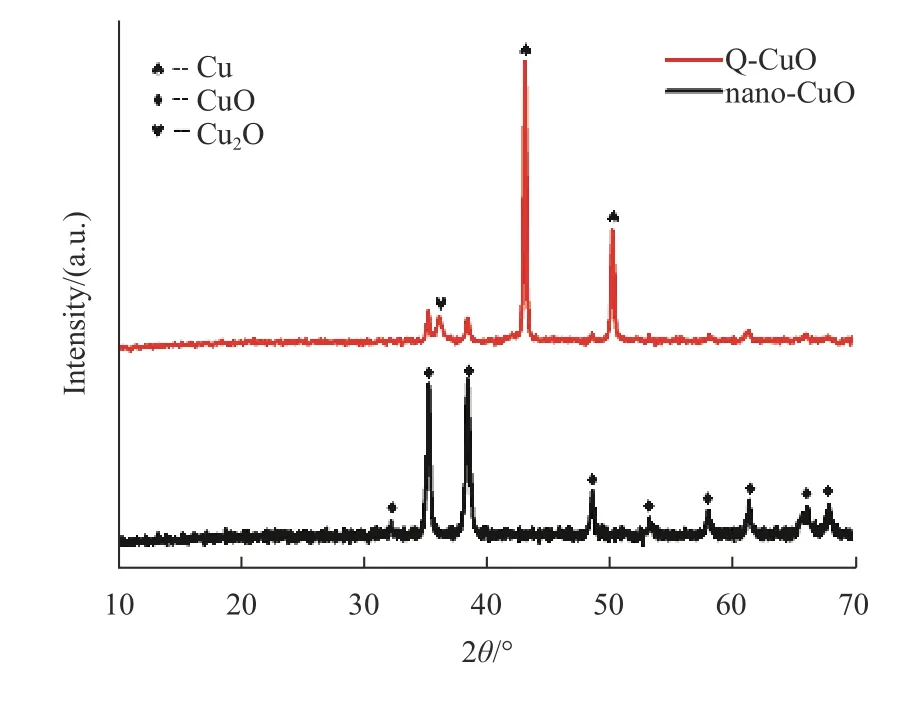
图 2 Q-CuO和nano-CuO样品的XRDFig.2 XRD patterns of the Q-CuO and nano-CuO samples
通过测量Nano-CuO和Q-CuO的紫外可见光漫反射吸收谱对其光学特征进行了表征,如图3所示。Nano-CuO的吸收边约为800 nm,对应于CuO的带隙(1.55 eV)[9]。Q-CuO样品的吸收边约为570 nm,对应于2.18 eV的带隙。这个结果与Liu等报道的Cu2O(2.17 eV)的带隙相近[28]。

图 3 nano-CuO和Q-CuO的紫外可见光漫反射吸收谱Fig.3 UV-vis absorption spectra of nano-CuO and Q-CuO
Nano-CuO和Q-CuO样品的形貌通过FE-SEM和FE-TEM进行了表征,如图4所示。图4(a)~(b)清楚地显示了Nano-CuO和Q-CuO的形貌,乙醇淬火后的QCuO观察到了明显的团聚现象。图4(c)和4(e)显示了Nano-CuO的TEM图像和HR-TEM图像。图中测量出的0.25 nm的晶格间距与CuO的(1 ¯11)晶面间距匹配的很好。图4(d)和4(f)显示了Q-CuO的TEM图像和HRTEM图像,可知Q-CuO的晶格间距为0.25 nm。同时,可以从Q-CuO的HR-TEM图像中清楚地观察到局部晶格紊乱(图4(f),虚线),这可能是高浓度氧空位的引入引起的[29]。

图 4 Nano-CuO(a, c, e)和Q-CuO(b, d, f)的FE-SEM图像(a, b);TEM图像(c, d);HR-TEM图像(e, f)Fig.4 FE-SEM images (a, b), TEM images (c, d) and HR-TEM images (e, f) of the nano-CuO (a, c, e) and Q-CuO (b, d, f)
为了进一步确认Q-CuO中氧空位的存在,进行了电子顺磁共振(EPR)光谱测试。EPR对包含未配对电子的顺磁性物质高度敏感,已被广泛用于表征氧空位。该测试在室温下进行,分析结果如图5所示。在其EPR光谱中观察到一条平直线,表明Nano-CuO不包含任何顺磁性信号。相反,在Q-CuO中观察到强EPR信号(y因子为2.05),这可能归因于Q-CuO中氧空位上的捕获电子。该值与Motaung等在研究ZnO纳米结构的铁磁和气敏特性时获得的氧空位g因子相近[30],也与Wencka等对铁绿锈和水铁矿砂的磁性和EPR研究的结果一致[31]。结果显示通过淬火修饰,氧化铜中出现了氧空位。
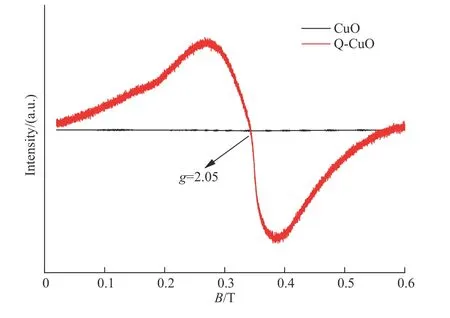
图 5 Nano-CuO和Q-CuO室温下的EPR谱Fig.5 EPR spectra at room temperature of the nano-CuO and QCuO
X射线光电子能谱(XPS)被用来表征材料表面元素化学价态的变化。Nano-CuO的Cu 2p3/2和2p1/2XPS峰分别位于934和953.95 eV处,如图6(a)所示,这是CuO中Cu-O键的典型特征[32]。 对于Q-CuO,Cu 2p XPS光谱显示出不同的特征,其中Cu 2p3/2和2p1/2峰分别移至932.55和952.4 eV(峰位移动约1.45 eV)。Nano-CuO的Cu LVV俄歇峰位于918 eV处,如图6(b)所示,这是CuO中Cu2+的典型特征。对于Q-CuO,Cu LVV俄歇峰移动到了较低能量917.6 eV处(峰位移动约0.4 eV)。Cu 2p光谱和Cu LVV 俄歇谱表明QCuO中存在Cu2O和Cu晶体[32],与图2所示的XRD结果相符。为了测定Q-CuO中Cu,Cu2O,CuO的含量,对QCuO的Cu 2p3/2谱进行了分峰拟合,结果如图6(d)所示,取它们各自的峰面积作为相对含量,可得CuO的百分比含量为37.5%,Cu2O的百分比含量为35.4%,Cu的百分比含量为27.1%。
如图6(c)所示,O 1s谱除了主峰(529.2 eV)以外,还有具有较高的结合能的肩峰,这是典型的CuO样品的O 1s谱,与文献[33-34]数据报道结果一致。结合能较低的主峰归因于CuO中的Cu-O键。据之前的报道,在531.3 eV附近的肩峰与氧空位的浓度有关[35]。对于Q-CuO,O 1s XPS光谱显示出不同的特征,其中O 1s主峰移动到了529.4 eV处(峰位移动约0.2 eV)。同时,与nano-CuO相比,Q-CuO在O 1s XPS光谱中肩峰的比例更大。这表明Q-CuO包含更多的氧空位,与EPR结果相符。

图 6 Nano-CuO和Q-CuO的Cu 2p XPS谱(a),Cu LVV俄歇谱(b),O 1s XPS谱(c);Q-CuO的Cu 2p3/2分峰谱(d)Fig.6 The Cu 2p XPS spectra (a), Cu LVV Auger XPS spectra (b), O 1s XPS spectra (c) of the nano-CuO and Q-CuO; Cu 2p3/2 XPS spectra (d) of the Q-CuO
众所周知,无水乙醇是一种缺氧环境。当在无水乙醇中淬火nano-CuO时,无水乙醇会消耗CuO晶体表面的氧原子,从而导致晶体表面产生氧空位。使用标准的Kroger-Vink表示法,高温下氧空位的形成可描述为[36]
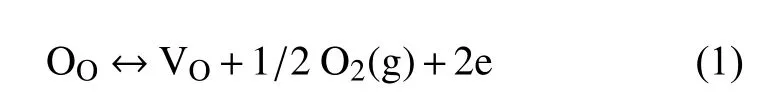
其中,OO代表晶格氧,VO代表氧空位。同时,为了维持Q-CuO中的区域电荷平衡,会伴随有Cu2O和Cu的生成。
2.2 光催化降解试验
为了评估所制备的Q-CuO和Nano-CuO的光催化活性,研究了其在紫外−可见光(汞灯模拟)照射下对RhB溶液的光降解。结果如图7所示,其中T、C和C0分别表示照射时间、瞬时RhB浓度和RhB原始浓度。1–C/C0用于表示RhB的降解率。可以看出,所制备的Q-CuO与Nano-CuO相比表现出更强的紫外−可见光光催化性能。对于Q-CuO和Nano-CuO,RhB在230 min后的降解率分别约为92%和71%(空白对照组降解率为48%,RhB在紫外−可见光下会发生自降解)。为了定量分析RhB降解的反应动力学,通过兰格缪尔-修斯伍德动力学模型(–ln(C/C0)=kt)拟合了图7中的实验数据,如图8所示,其中k为伪一阶速率常数[37]。两个样品的–ln(C/C0)与时间t均具有良好的线性相关性,说明本文选择的模型是合适的。Nano-CuO、 QCuO和空白对照组的相应k值分别计算为4.97×10–3、9.98×10–3和2.64×10–3min–1。这些结果表明,Q-CuO显示出优于nano-CuO的光催化活性。

图 7 紫外−可见光下nano-CuO和Q-CuO对RhB水溶液的光降解Fig.7 Photodecomposition of RhB aqueous solution with nano-CuO and Q-CuO under UV-Vis light
2.3 光催化机理解释
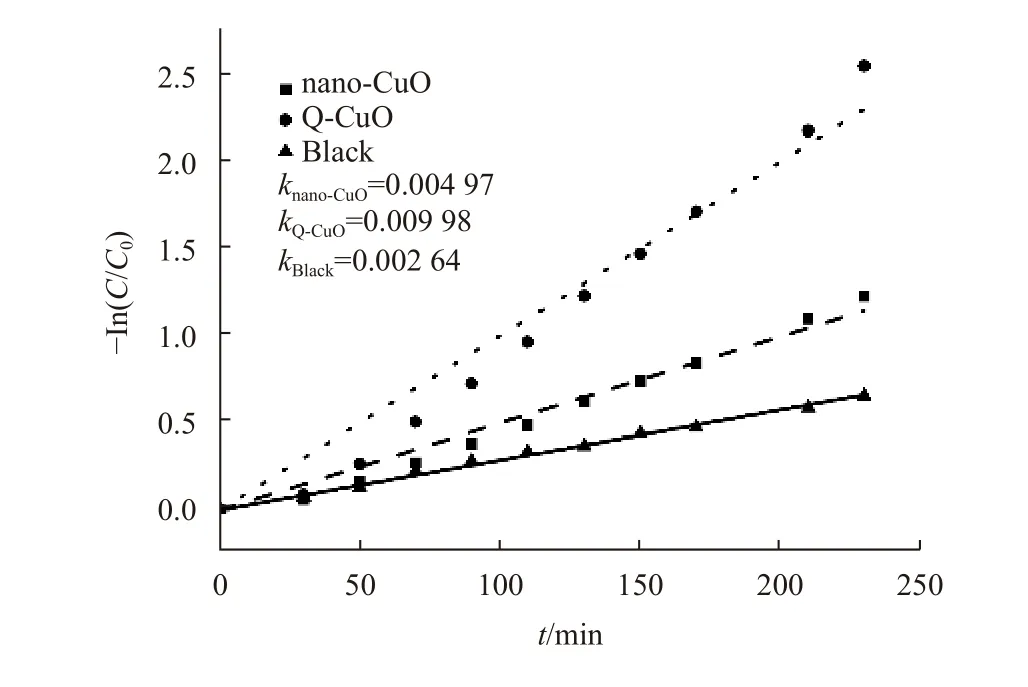
图 8 RhB浓度的-ln(C/C0)与光照时间的关系Fig.8 -ln (C/C0) of the RhB concentration as a function of UV-vis light irradiation time
通过SEM测试可知经过无水乙醇淬火后QCuO有团聚现象,如图4(b)所示。众所周知,团聚现象会导致材料参与光催化反应的有效表面积减小,降低材料的光催化性能。尽管如此,与nano-CuO相比,Q-CuO还是表现出相对较高的光催化性能,造成这种结果的原因可能有以下3点:(1) 通过快速的无水乙醇淬火,氧化铜表面出现了高浓度的氧空位。众所周知,光催化剂表面的氧空位会促进生成超氧负离子,超氧负离子是中间活性物质,它可进一步生成·OH或H2O2用以分解RhB,同时自身也可作为氧化剂氧化分解RhB,因此,氧化物表面的氧空位数量将会极大地影响超氧离子的产生量,进而影响最终活性物质·OH或H2O2的产生量,最终影响光催化剂的光催化活性[38]。(2) XRD和XPS的表征表明,通过快速的无水乙醇淬火,由于乙醇的还原性,淬火样品中产生了Cu2O和Cu,这可能会形成CuO-Cu2O异质结,如图9所示,据报道,CuO的导带、价带能级分别为0.46 eV和2.16 eV (vs.NHE), Cu2O的分别为–0.28 eV和1.92 eV (vs. NHE)[39],NHE表示标准氢电极(normal hydrogen electrode)。光照时,Cu2O价带电子被激发到导带,因为能级差异会进一步流向CuO的导带,而CuO的价带空穴会由于能级差异流向Cu2O的价带,这会提高淬火样品的电荷−空穴分离效率。(3) Cu与CuO-Cu2O也可能会形成肖特基异质结,如图9所示,由于金属Cu具有较高的功函数,电子将会从氧化物流向Cu,也会提高电荷−空穴分离效率。由于这3个原因,Q-CuO显示出优于Nano-CuO的光催化活性。
3 结论
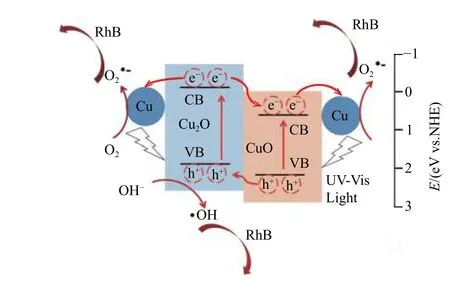
图 9 所形成异质结的能带图和电荷分离过程Fig.9 Schematic band diagram and charge separation process of the heterojunctions
本文提出用乙醇淬火这一简便有效的方法来修饰纳米CuO的表面。经表面修饰的氧化铜相比修饰前在紫外–可见光照射下对RhB溶液的降解表现出更高的光催化活性。在快速乙醇淬火后,高浓度的氧空位在Q-CuO的表面形成,CuO-Cu2O异质结和Cu与CuO-Cu2O的肖特基异质结也可能形成,从而促进了电荷空穴分离,增强了光催化活性。乙醇淬火是一种有效的方法,这种方法能够在金属氧化物的表面形成高浓度氧空位,甚至形成异质结,从而提升金属氧化物的表面活性。由于是快速淬火过程,因此产生的氧空位仅仅存在于氧化物的表面而不能迁移到氧化物的晶体内部,这也是这种方法的最大特点。
