一种阳离子交换磁性多壁碳纳米管复合材料及其蛋白质的吸附性能研究
2020-07-27贺茂芳胡娅琪唐一梅张育珍
贺茂芳*,张 博,胡娅琪,唐一梅,张育珍
(西安医学院药学院,西安医学院药物研究所,陕西西安 710021)
碳纳米管(Carbon Nanotubes,CNTs)是由石墨片曲卷形成的一种无缝纳米管,包括单壁碳纳米管(Single-wall Carbon Nanotubes,SWCNTs)和多壁碳纳米管(Multi-wall Carbon Nanotubes,MWCNTs)。CNTs不仅具有高模量、高强度、导电性好、比表面积大、表面易修饰等优点,而且具有较强的吸附活性[1]。因此,CNTs被广泛应用于分析科学和生物医学等领域,如生物、环境样品前处理[2 - 4],生物传感器[5,6],蛋白质、DNA和药物转运载体等[7,8]。
CNTs作为固相萃取吸附剂是其重要应用之一。CNTs具有较强的疏水性能,其表面的大π键能与具有共轭结构的分子以非共价键结合,从而产生吸附活性。同时,CNTs的比表面积高达3 000 m2/g,此外,其制备工艺成熟,直径和长度可控且表面易修饰[9,10]。因此,CNTs被作为吸附剂广泛应用于生物、环境样品前处理中。例如,尿液中β2-agonists的固相分散微萃取[11]、血清中血红蛋白的分离富集[12]、水样中多环芳烃的固相分散微萃取[13]等。然而,由于CNTs的尺寸小、疏水性强,CNTs在水溶液中的分散性差、易团聚,而且通过传统的离心、过滤等方法难以实现液固分离。同时,CNTs通过范德华力、疏水作用力等与生物分子相互作用,导致其选择性差,难以实现对目标物的特异性识别,极大地限制了CNTs在生物分离方面的应用[14]。
将CNTs负载在刚性基质表面同时进行亲水改性是解决这一问题的有效途径。例如,周等[12]采用层层组装法将羧基化MWCNTs固定在石英棉上,建立了在线固相萃取碱性蛋白质的方法。Du等[15]将MWCNTs键合在SiO2表面,再包覆聚合物,实现了对细胞色素c的分离富集。将CNTs与Fe3O4磁性纳米粒子复合,制得的磁性碳纳米管具有分散性好、比表面积大、吸附性能好、易于实现液固分离等优点,是一种应用前景十分广泛的纳米载体[16]。因此,本研究首先制备了磁性多壁碳纳米管(Magnetic Multi-wall Carbon Nanotubes,mMWCNTs),然后通过静电自组装法将亲水聚合物聚丙烯酸(Polyacrylic Acid,PAA)修饰在其表面。经过PAA修饰的mMWCNTs(Fe3O4@MWCNTs@PAA)在pH=6.0的缓冲液中表现出阳离子交换性能,对碱性蛋白质具有较高的吸附容量和选择性。最终,Fe3O4@MWCNTs@PAA成功应用于鸡蛋清中溶菌酶(Lys)的分离纯化,获得了较高的纯度。本文的研究成果为CNTs的表面改性提供了新途径,拓宽了CNTs在生物分离方面的应用。
1 实验部分
1.1 仪器与试剂
Cary 60紫外-可见分光光度计(美国,安捷伦公司);SB-5200DT型超声清洗仪(宁波新芝生物科技股份有限公司);TENSOR 27傅立叶红外光谱仪(德国,布鲁克公司);H-7650透射电子显微镜(日本,Hitachi);K-Alpha X射线光电子能谱仪(美国,Thermo Fisher);TS-211BQ型恒温振荡器(上海岛析实业有限公司);100 mL高压反应釜(天津市兰博实验仪器设备有限公司);JJ-1型增压电动搅拌器(上海司乐有限公司)。
FeCl3(分析纯,成都艾科达化学试剂有限公司),乙二醇(分析纯,天津市科密欧化学试剂有限公司),氨基化多壁碳纳米管(长度50 μm,外径8~15 nm,江苏先丰纳米材料科技有限公司),聚丙烯酸(PAA,分析纯,上海麦克林生物试剂有限公司),Lys(>98%,上海阿拉丁生化科技股份有限公司),卵清蛋白(OVA,>98%,Sigma-aldrich),牛血清白蛋白(BSA,>98%,上海阿拉丁生化科技股份有限公司)。
1.2 PAA修饰的磁性碳纳米管(Fe3O4@MWCNTs@PAA)的制备
1.2.1 磁性碳纳米管的制备通过水热法制备Fe3O4@MWCNTs,具体合成路线如下:1.4 g FeCl3溶解于75 mL乙二醇和3.6 mL水中,在超声处理下将0.4 g MWCNTs悬浮于上述溶液中,静置10 min后再超声处理10 min,再加入3.6 g NaAc,在室温下搅拌30 min,最后将所得混合物转移到聚四氟乙烯反应釜中加热至200 ℃反应16 h。反应结束后冷却至室温,依次用水和醇交替洗涤合成产物3次,将得到的固体在40 ℃下真空干燥6 h,即得Fe3O4@MWCNTs。
1.2.2 PAA修饰磁性碳纳米管将2 g的PAA溶解于50 mL 0.1 mol/mL的pH=7.0磷酸盐缓冲液,再加入0.5 g Fe3O4@MWCNTs,超声使其分散均匀,然后常温下机械搅拌反应12 h,将产物依次用水和醇交替洗涤3次,最后在50 ℃下真空干燥6 h,即得到Fe3O4@MWCNTs@PAA。
1.3 Fe3O4@MWCNTs@PAA对蛋白质的吸附性能研究
1.3.1 吸附方法及吸附容量的计算称取10.0 mg Fe3O4@MWCNTs@PAA于10 mL离心管中,加入5.0 mL蛋白质溶液,超声分散1 min,然后于25 ℃、200 r/min的恒温振荡器中反应2 h,最后用强磁铁将Fe3O4@MWCNTs@PAA吸在管壁,收集吸附后的蛋白质溶液,用0.45 μm滤膜过滤后,采用紫外分光光度计测定λ=280 nm处的吸光度,通过标准曲线法算吸附后蛋白质溶液的浓度(ce,mg/mL),并计算吸附容量(Q):
(1)
式中,Q为吸附容量(μg/mg),c0为吸附前蛋白质溶液的初始浓度(mg/mL),ce为吸附后蛋白质溶液的平衡浓度(mg/mL),V0为蛋白质溶液的体积(mL),m为吸附剂的质量(mg)。
1.3.2 吸附时间的影响称取10.0 mg Fe3O4@MWCNTs@PAA于10 mL离心管中,向其中加入5.0 mL浓度为0.5 mg/mL 的蛋白溶液(用pH=7.0的磷酸盐缓冲液配制),设定吸附时间为5 min、10 min、20 min、40 min、60 min、120 min(平行三份),吸附结束后,测定不同时间的吸附容量。
1.3.3 pH的影响称取10.0 mg Fe3O4@MWCNTs@PAA于10 mL离心管中,向其中加入5.0 mL浓度为0.5 mg/mL蛋白溶液(分别用pH=5.0、6.0、7.0、8.0、9.0、10.0的缓冲液配制),设定吸附时间为120 min(平行三份),吸附结束后,测定不同pH时的吸附容量。
1.3.4 静态等温吸附线在最佳的吸附时间和缓冲液pH的条件下,将10.0 mg Fe3O4@MWCNTs@-PAA分散于浓度为0.1 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL蛋白溶液中(每种浓度三份平行),吸附结束后,测定吸附容量。以吸附容量Q对ce作图,绘制静态等温吸附线,并利用Langmuir方程对吸附等温线进行拟合,以计算饱和吸附容量。
(2)
式中,Q为吸附容量(μg/mg),c0为蛋白质溶液的起始浓度(mg/mL),ce为吸附平衡时蛋白质溶液的浓度(mg/mL),Kd是解离常数(mg/mL),Qm是饱和吸附容量(μg/mg)。
1.4 Fe3O4@MWCNTs@PAA对鸡蛋清中蛋白质的分离
取新鲜的生鸡蛋,分离蛋清与蛋黄,取5.0 mL蛋清,向其中加入95 mL pH=6.0的磷酸盐缓冲液,室温下搅拌30 min,于4 ℃下10 000 r/min离心15 min,取上层清液作为鸡蛋清样品。
称取100 mg Fe3O4@MWCNTs@PAA加入到3.0 mL鸡蛋清样品中,25 ℃、150 r/min持续振荡反应2 h。反应结束后,将Fe3O4@MWCNTs@PAA用pH=6.0的缓冲液2.0 mL依次清洗两次,最后加入1.0 mL含有0.5 mol/L NaCl的磷酸盐缓冲溶液(pH=8.0)洗脱6 h。将吸附前的鸡蛋清样品、吸附后的样品及洗脱液进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
2 结果与讨论
2.1 Fe3O4@MWCNTs@PAA的制备与表征
如图1所示,本实验首先将Fe3O4与氨基化的MWCNTs结合,使MWCNTs具有磁性;然后通过静电吸引力使PAA与MWCNTs表面的氨基结合,从而将PAA修饰在MWCNTs表面。Fe3O4@MWCNTs表面修饰PAA后,引入大量羧基,有利于提高离子交换容量,因此获得高吸附容量的离子交换吸附剂。将制得的Fe3O4@MWCNTs@PAA分散在水中,在外加磁场的作用下可迅速实现液固分离(图2),说明Fe3O4@MWCNTs@PAA的磁响应性好,将其用于磁性分散固相萃取中,操作简便,分离效率高。

图2 Fe3O4@MWCNTs@PAA的分散液未加磁场(A),加磁场后(B)Fig.2 The suspension of Fe3O4@MWCNTs@PAA without (A) and with (B) a magnetic field

图1 Fe3O4@MWCNTs@PAA的合成路线示意图Fig.1 The preparation route of Fe3O4@MWCNTs@PAA
吸附剂红外光谱如图3。620 cm-1为Fe-O-Fe的特征吸收峰,证明了Fe3O4的存在;1 650 cm-1为N-H的伸缩振动峰,1 053 cm-1为C-N的伸缩振动,2 920 cm-1为C-H非对称伸缩振动,2 851 cm-1为C-H的对称伸缩振动,1 462 cm-1为C-H面内弯曲振动,证明了氨基化碳纳米管的存在。因此,Fe3O4@MWCNTs的制备是成功的。自组装PAA后,由于C=O的吸收峰与N-H的吸收峰重叠,因此未出现新的吸收峰。为了进一步验证材料的制备是否成功,我们通过透射电镜和X射线光电子能谱对Fe3O4@MWCNTs和Fe3O4@MWCNTs@PAA进一步表征。由透射电镜图可以观察到,Fe3O4磁性微球均匀地分散附着在线状的MWCNTs表面,粒径约为200 nm(图4A);与PAA反应后,在MWCNTs表面可以明显地观察到聚合物涂层(图4B)。X射线光电子能谱(图5)分析显示,Fe3O4@MWCNTs表面的C含量和O含量分别为76.6%和16.7%,和PAA反应后,C含量和O含量分别升高至78.2%和18.1%,这一结果表明PAA成功修饰在Fe3O4@MWCNTs的表面。
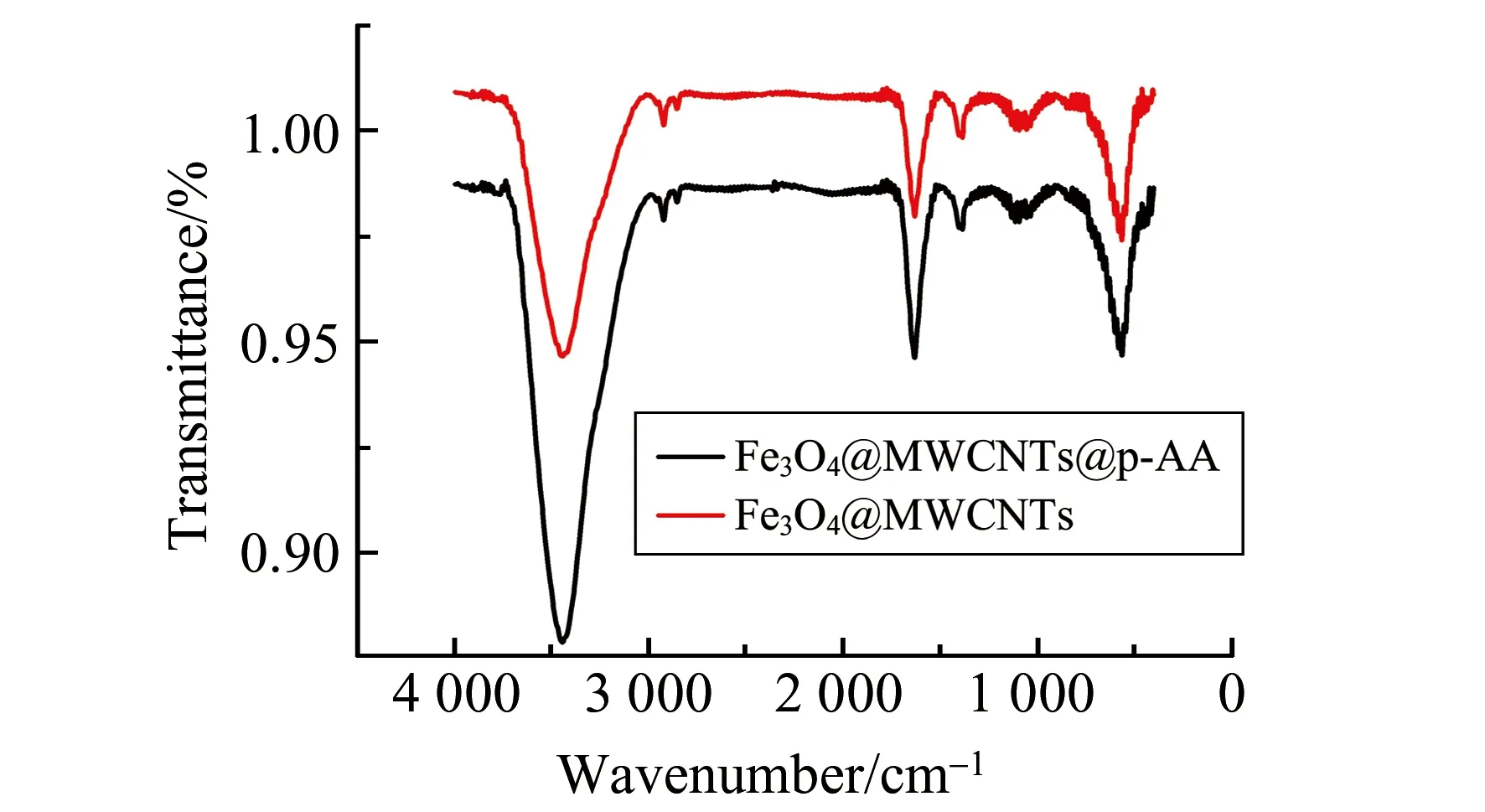
图3 Fe3O4@MWCNTs和Fe3O4@MWCNTs@PAA的红外光谱图Fig.3 Fourier transform infrared (FT-IR) spectra of Fe3O4@MWCNTs and Fe3O4@MWCNTs@PAA
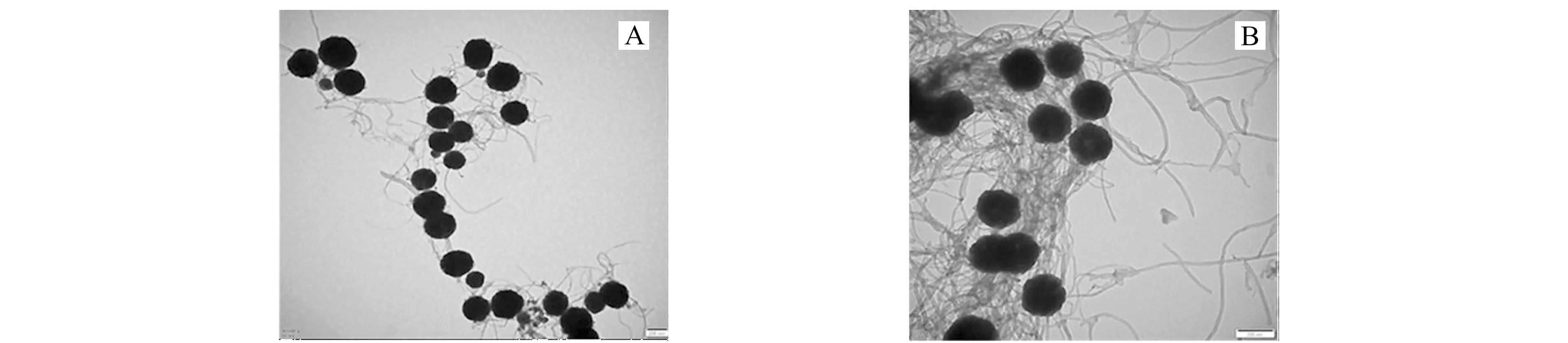
图4 透射电镜图。(A)Fe3O4@MWCNTs,放大40 000倍;(B)Fe3O4@MWCNTs@PAA,放大70 000倍Fig.4 Transmission electron microscopy (TEM) images.(A)Fe3O4@MWCNTs with 40 000 amplification;(B) Fe3O4@MWCNTs@PAA with 70 000 amplification

图5 X射线光电子能谱图。(A)Fe3O4@MWCNTs;(B)Fe3O4@MWCNTs@PAAFig.5 X-ray photoelectron spectra(XPS).(A):Fe3O4@MWCNTs;(B):Fe3O4@MWCNTs@PAA
2.2 Fe3O4@MWCNTs@PAA对蛋白质的吸附性能
2.2.1 pH对蛋白质吸附容量的影响在离子交换色谱中,pH值对吸附容量的影响是pH值对蛋白质和吸附剂表面电荷共同作用的结果。本文以Cyt c和Lys为模型蛋白,研究了pH=5.0~10.0之间Fe3O4@-MWCNTs@PAA对蛋白质的吸附量(图6)。Fe3O4@MWCNTs@PAA的外层是PAA分子,其pKa约为5.0,当吸附体系的pH在5.0~10.0之间时,PAA主要以酸根离子形式存在,吸附剂表面带负电荷;Lys的等电点约为11,Cyt c的等电点约为10,故当pH<10.0时,Cyt c和Lys均带正电荷。当吸附体系的pH由5.0~8.0逐渐增大时,由于PAA是弱酸,随着溶液pH的增大,吸附剂表面解离出的酸根离子增加,吸附剂表面所带负电荷密度也逐渐加大;但由于pH增大,越来越接近蛋白质的等电点,导致Cyt c和Lys所带的正电荷逐渐减少。因此,当吸附体系的pH为6.0时,Fe3O4@MWCNTs@PAA对Cyt c和Lys的吸附量达到最大值,此时静电吸引力发挥主导作用。而当吸附体系的pH由8.0~10.0继续增大时,Cyt c和Lys所带的正电荷进一步减少,故其主要以分子形式存在,由于MWCNTs对蛋白质具有疏水作用力,吸附剂对蛋白质的吸附量又逐渐加大。为了提高吸附剂对碱性蛋白质的选择性,本研究选择pH=6.0时吸附,此时静电吸引力发挥主导作用。
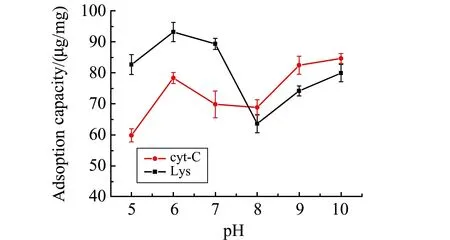
图6 pH对Lys和Cyt c的吸附容量的影响Fig.6 Effect of pH on the adsorption capacityfor Lys and Cyt c
2.2.2 时间对蛋白质吸附容量的影响为了提高分离纯化效率,以Lys和Cyt c为模型蛋白对吸附时间进行了研究。如图7所示,当吸附时间达到1 h以上时,吸附量升高不再明显。因此,该吸附剂对蛋白质具有较快的吸附动力学,其最佳吸附时间为1 h。

图7 吸附时间对Lys和Cyt c吸附容量的影响Fig.7 Effect of the adsorption time on the adsorption capacity for Lys and Cyt c
2.3 静态吸附等温线
为了研究Fe3O4@MWCNTs@PAA对碱性蛋白质的吸附容量和选择性,本实验在最佳吸附时间和pH值条件下,测定了Fe3O4@MWCNTs@PAA对碱性蛋白质(Lys和Cyt c)和对酸性蛋白(BSA)的静态吸附等温线,如图8。由图可知,Fe3O4@MWCNTs@PAA对蛋白质的吸附量随着蛋白质溶液浓度的增大而逐渐增大,最后达到饱和。但是,Fe3O4@MWCNTs@PAA对Lys和Cyt c吸附容量要远高于BSA。这与吸附剂表面的电荷性质以及蛋白质的等电点有关:当溶液的pH值为6.0时,Lys和Cyt c带净的正电荷,Fe3O4@MWCNTs@PAA表面带负电荷,二者发生静电吸引作用,因而Fe3O4@MWCNTs@PAA对Lys和Cyt c具有较高的吸附容量;而pH=6.0时,BSA带净的负电荷,与Fe3O4@MWCNTs@PAA发生静电排斥作用,因此Fe3O4@MWCNTs@PAA对其基本不产生吸附。因此,Fe3O4@MWCNTs@PAA对碱性性蛋白具有较高的吸附选择性。
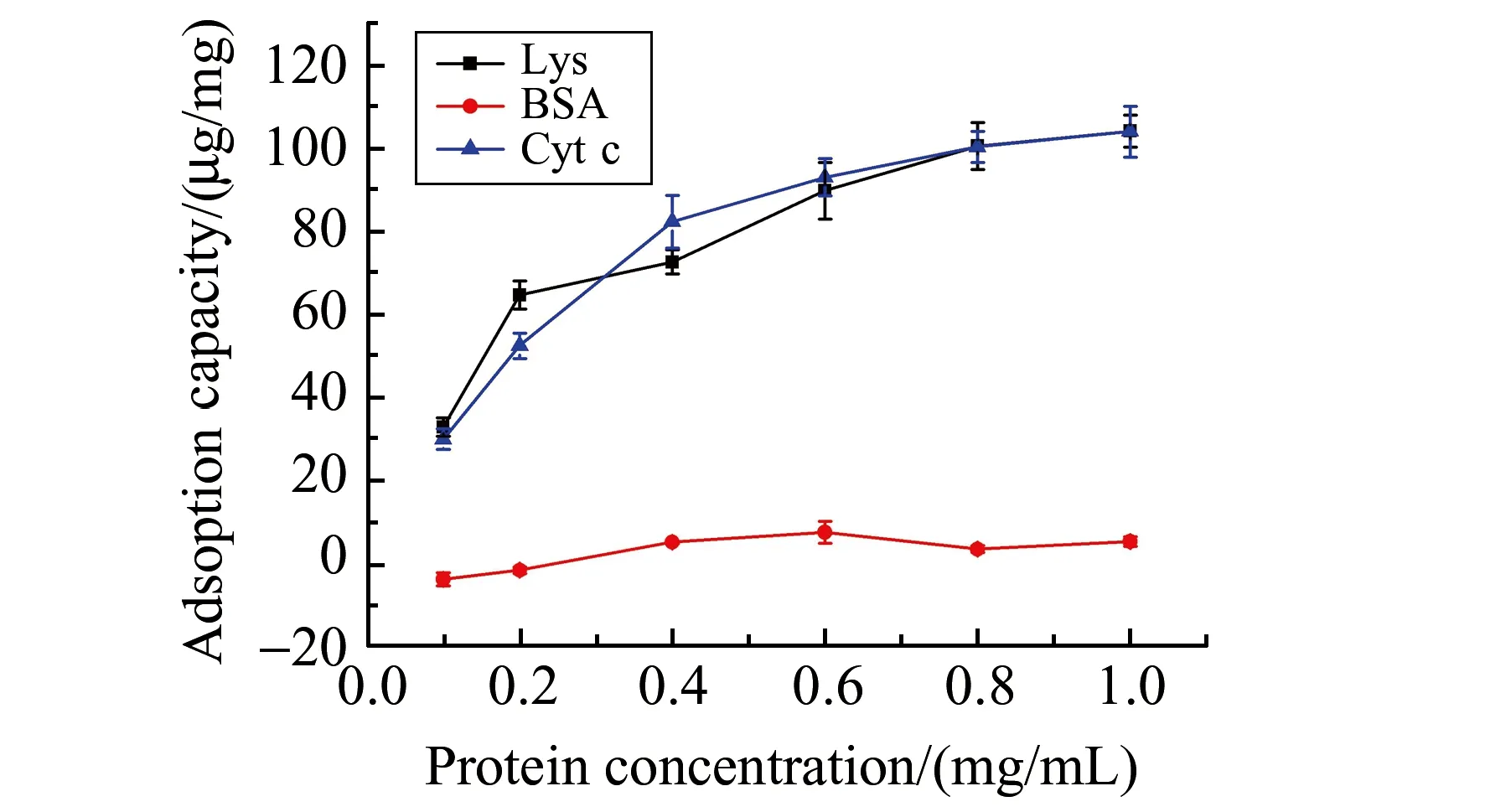
图8 Fe3O4@MWCNTs@PAA对蛋白质的静态吸附等温线Fig.8 Adsorption isotherms of Fe3O4@MWCNTs-@PAA for protein
经Langmuir拟合发现,对于Lys和Cyt c,其ce/Q与ce之间存在良好的线性关系,线性方程分别为ce/Q=0.00421ce+0.36(r=0.993)、ce/Q=0.00489ce+0.52(r=0.985),因此Fe3O4@MWCNTs@PAA对Lys和Cyt c属于典型的Langmuir单分子层吸附。经计算,Fe3O4@MWCNTs@PAA对Lys和Cyt c的最大吸附容量分别为237.5 μg/mg和204.5 μg/mg。相比于用羧基化碳纳米管直接进行固相萃取[12],Fe3O4@MWCNTs@PAA对碱性蛋白质具有更高的吸附容量,这是由于PAA的引入使碳纳米管表面具有更高密度的羧基。因此,将聚合物大分子修饰在材料表面是提高吸附容量的有效方法。
2.4 实际样品分析
鸡蛋清中含有丰富的蛋白质,除了Lys(pI=11)以外,其他蛋白质(OVA,pI=4.6;卵类粘蛋白,pI=4.0;伴清蛋白,pI=6.6)均为酸性蛋白,而且,Lys的含量只占鸡蛋清中总蛋白质含量的3.5%[17]。因此,鸡蛋清是最易得的、适合于测试阳离子交换选择性的生物样本。将Fe3O4-@MWCNTs@PAA用于鸡蛋清中Lys的分离纯化,结果如图9。相比于未经Fe3O4@MWCNTs@PAA吸附的鸡蛋清样品(条带2),经过Fe3O4@MWCNTs@PAA吸附后的鸡蛋清样品中只有Lys条带变浅(条带3),说明只有Lys被吸附;而在洗脱液中(条带4),仅能观察到Lys的条带,说明Lys被Fe3O4@MWCNTs@PAA 从鸡蛋清中分离纯化出来。因此,本文制备的阳离子交换磁性吸附剂具有一定的实用价值。
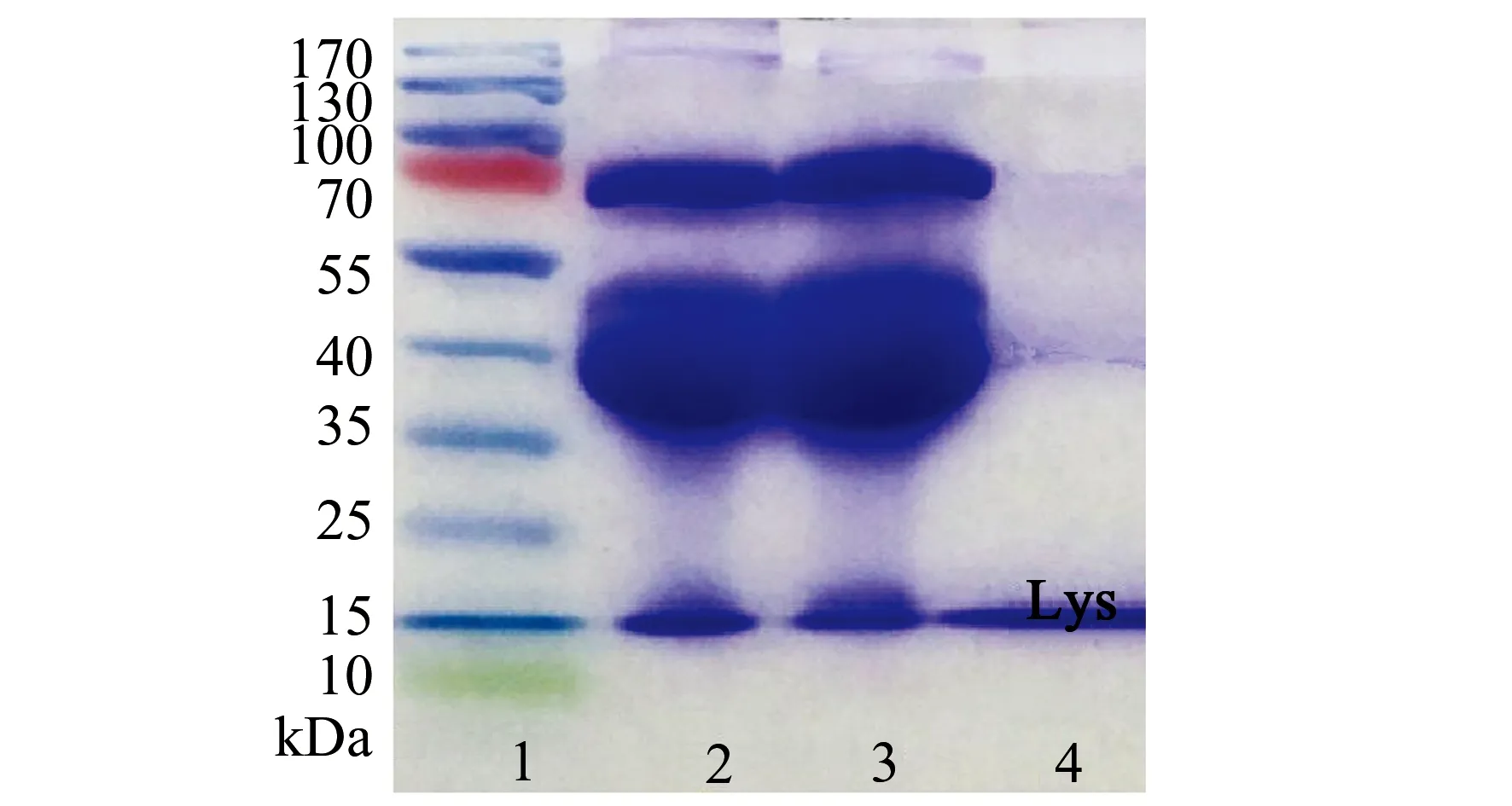
图9 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分析Fig.9 SDS -PAGE analysislane:1.protein marker,lane;2.egg white before adsorption,lane;3.egg white after adsorption,lane;4.the elution.
3 结论
成功制备了Fe3O4@MWCNTs并将PAA通过静电自组装法修饰在其表面,得到了一种新型阳离子交换磁性吸附剂。这种制备方法操作简单、反应条件温和无毒,并且得到了较高的离子交换容量和蛋白质吸附容量。同时,该磁性纳米吸附剂在蛋白质分离纯化方面具有操作简便、快速,选择性好等优点。因此,该阳离子交换磁性吸附剂在生物大分子的分离纯化方面具有良好的应用前景。
