长链非编码RNA KCNMB2-AS1在胃癌中的表达及机制研究
2020-07-27唐银炳陆佳伟谢黎张伟亚邹晨祁卫东马圭张文波蒋鹏程
唐银炳 陆佳伟 谢黎 张伟亚 邹晨 祁卫东 马圭 张文波 蒋鹏程
江苏大学附属人民医院普外科(江苏镇江212002)
胃癌是全球第5 大常见的恶性肿瘤,是癌症死亡的第3 大原因,尽管近年来其发病率呈现下降趋势,但在东亚地区仍有明显增加[1]。由于起病隐匿、早期非侵入性诊断方法相对缺乏[2],大多数胃癌患者在确诊时就已属于中、晚期。晚期胃癌的治疗效果有限,中位生存时间约为1年[3]。因此,探索一种对于胃癌有效的诊断标志物和治疗靶点具有重要意义。
长链非编码RNA 是一类长度大于200 个核苷酸[4]、本身不编码蛋白质或仅能编码很短的多肽[5]的功能性RNA分子。lncRNA 在众多肿瘤组织中存在异常表达,包括HOTAIR、GAS5、H19 等在内的大量lncRNA 分子被证实与结直肠癌、肝癌、乳腺癌等多种恶性肿瘤的发生发展有关[6-8]。研究发现,lncRNA 可通过引导或阻碍转录因子结合、参与表观遗传学修饰、介导miRNA 沉默等方式,发挥促癌或抑癌作用[9-10]。
KCNMB2-AS1 是一个定位于染色体3q26.32,长度为2 055 bp 的lncRNA 分子。TANG 等[11]通过TCGA数据库分析发现KCNMB2-AS1在子宫内膜癌中存在差异表达,由KCNMB2-AS1等5个lncRNA 建立的风险评分模型可以有效预测子宫内膜癌患者的生存,ROC 曲线分析显示其AUC 为0.978。然而KCNMB2-AS1 在胃癌发生发展中的作用目前尚不明确。笔者通过预实验筛查发现KCNMB2-AS1 在胃癌组织和细胞中高表达。本研究通过扩大样本量进一步检测KCNMB2-AS1 在胃癌组织及血浆中的表达水平并分析其与临床病理特征的关系,同时探究其对胃癌细胞生物学功能的影响,探讨可能的作用机制,为胃癌的分子诊断及潜在的靶向治疗提供理论依据。
1 资料与方法
1.1 临床标本收集2015年4月至2019年6月期间于江苏大学附属人民医院普外科行手术切除并经病理检查证实为胃癌患者的肿瘤及癌旁对照组织(距肿瘤边缘>5 cm)82 例,其中男60 例,女22 例,年龄29 ~82 岁,中位年龄66.5 岁。肿瘤长径≤5 cm 54 例,>5 cm 28 例;淋巴结转移阴性35例,阳性47例;Ⅰ~Ⅱ期34例,Ⅲ~Ⅳ期48例。所有患者术前均未接受化疗、放疗及其他抗癌治疗。同时选取胃癌病例31 例进行血浆KCNMB2-AS1 检测。其中,男24 例,女7 例,年龄47~77 岁,中位年龄63 岁。肿瘤长径≤5 cm 20 例,>5 cm 11 例;淋巴结转移阴性12 例,阳性19 例;Ⅰ~Ⅱ期12 例,Ⅲ~Ⅳ期19 例。随机收集同期于我院进行体检的无肿瘤病史的健康者血浆31 例作为对照。胃癌患者和健康者性别、年龄等差异均无统计学意义。所有受试者均知情同意,本研究获得江苏大学附属人民医院伦理委员会的批准。
1.2 主要试剂、仪器及实验方法
1.2.1 试剂及仪器胃癌细胞AGS 购自中国科学院上海生命科学研究员细胞资源中心。RNA 提取试剂盒TRIZOL 购自上海生工生物科技有限公司。逆转录试剂盒Hieff First Strand cDNA Synthesis Super Mix for QRT-PCR 及荧光定量PCR 试剂盒Hieff qPCR SYBR Green Master Mix 购自上海翊圣生物科技有限公司。siRNA-KCNMB2-AS1 和阴性对照小干扰RNA 购自上海吉玛制药技术有限公司。转染试剂Lipofectamine 2000 购自Invitrogen 公司。Annexin V-FITC/PI 细胞凋亡检测试剂盒购自碧云天试剂公司。
1.2.2 RNA提取、逆转录及实时荧光定量PCR按Trizol 说明书采用苯酚-氯仿抽提法,分别提取组织、血浆及胃癌细胞中总RNA,经紫外分光光度计检测,A260/A280 在1.9 ~2.1 之间者为合格样品。按RT-PCR 试剂盒说明书配制逆转录反应体系。采用Random 6 及Oligo-dT 双引物法反转录细胞内的RNA。逆转录完成后,以1 μL cDNA 配制qPCR 体系,qPCR 扩增条件设定为:95 ℃30 s、95 ℃10 s、59 ℃20 s、72 ℃34 s,扩增40 个循环。采用-△Ct、-△△Ct和2-△△Ct计算目的基因的相对表达量。其中组织和细胞以β-actin 为内参,血浆样本以U6 为内参。
1.2.3 细胞转染取对数生长期的AGS 细胞接种于6 孔板中,接种密度以过夜培养后融合度达60%~80%为准。按照Lipofectamine 2000 说明书,以无血清1640 培养基配制转染试剂及si-RNA 工作液,分别向胃癌细胞中转染siRNA-KCNMB2-AS1 小干扰RNA(siRNA#1 组,siRNA#2 组)及阴性对照小干扰RNA(si-NC 组)。转染6 h 后更换为含10%胎牛血清的完全培养基。
1.2.4 细胞计数、克隆形成在细胞计数实验中,细胞转染48 h 后,分3 组以1 × 104/孔的浓度接种于24 孔,每组做6 个复孔。在37 ℃、5%CO2培养箱中培养,培养基每3 天更换1 次,每24 h 消化1 个复孔并计数,每孔重复3 次,取平均值,连续计数6 d,绘制细胞生长曲线;在克隆形成实验中,同样在细胞转染48 h 后,以1 000 个/孔的浓度分3 组接种于6 孔板,置于培养箱中培养,每天观察细胞生长情况,3 d 换1 次液。培养10 d 后弃掉旧培养液,磷酸盐缓冲液(PBS)清洗3 遍,4%多聚甲醛固定,静置30 min,0.5%结晶紫染色5 min,PBS 清洗2 次,自然风干后拍照并计算克隆形成数目。
1.2.5 细胞凋亡检测细胞转染48 h 后,1×Binding buffer 重悬细胞并调整细胞密度至2 × 105/mL,依次加入5 μL 的Annexin V-FITC、5 μL PI 摇匀,避光静置15 min,流式细胞仪检测细胞凋亡。
1.2.6 细胞迁移、侵袭迁移细胞转染48 h 后调整密度为1×105/mL,以100 μL/孔接种于Transwell小室上室,下室中每孔加入750 μL 完全培养基。培养24 h 后,4%多聚甲醛固定30 min,0.5%结晶紫染色15 min,棉签擦去上室面残余细胞,在显微镜下计算下室面细胞数量。侵袭实验与迁移实验步骤类似,不同在于Transwell 小室上室采用基质胶包被。
1.3 统计学方法所有数据均采用SPSS 24.0统计软件进行分析,采用GraphPad Prism 7.0 软件分析制图。计量资料以均数±标准差表示,组间比较采用t检验或方差分析(ANOVA),计数资料组间比较采用χ2检验。采用Kaplan-Meier 分析KCNMB2-AS1 表达水平与胃癌患者生存率的相关性。采用ROC 曲线评估血浆KCNMB2-AS1 表达水平对于胃癌患者的诊断价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 胃癌组织中KCNMB2-AS1 的表达及临床意义QRT-PCR结果显示,82例胃癌组织中KCNMB2-AS1 的相对表达量高于癌旁对照组织,差异有统计学意义(P<0.05,图1A、B)。以KCNMB2-AS1表达中位数0.740 为界值,将胃癌患者分为高表达组(n=41)和低表达组(n=41)。胃癌患者组织KCNMB2-AS1 表达量与临床病理特征相关性分析结果显示,其表达水平与肿瘤大小、淋巴结转移和TNM 分期呈正相关(P<0.05,表1;图1C、D、E),而与年龄、肿瘤分化程度及浸润深度等无关(P>0.05,表1)。Kaplan-Meier 分析显示,KCNMB2-AS1高表达组患者较低表达组生存率更低(HR=1.963 95%CI:1.028~3.749,P<0.05,图1F)。
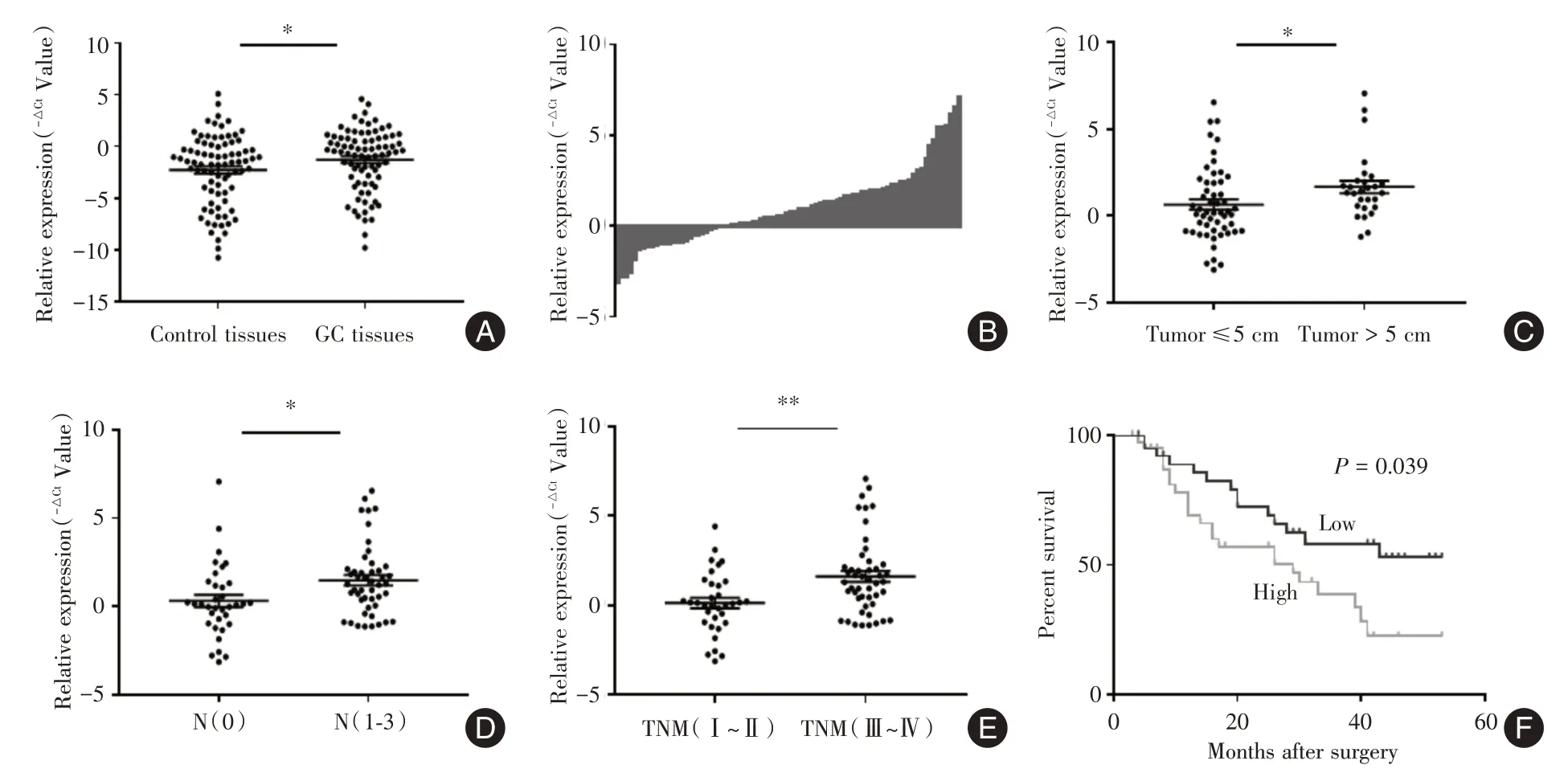
图1 KCNMB2-AS1 在胃癌及癌旁组织中的表达及临床意义Fig.1 The expression and clinical significance of KCNMB2-AS1 in gastric cancer comparing with adjacent control tissues
2.2 血浆KCNMB2-AS1的表达及临床意义QRTPCR 结果显示,31 例胃癌患者血浆中KCNMB2-AS1的表达水平高于31例健康体检者,差异有统计学意义(P<0.001,图2A)。胃癌患者血浆KCNMB2-AS1 表达量与临床病理特征相关性分析结果显示,其表达水平与肿瘤大小、淋巴结转移和TNM分期呈正相关(P<0.05,图2B、C、D)。血浆KCNMB2-AS1水平诊断胃癌的ROC 曲线下面积为0.865(95%CI:0.777 ~0.953,P<0.001,图2E),灵敏度为87.1%,特异度为74.2%,该指标具有较好的诊断价值。
2.3 敲减KCNMB2-AS1对细胞增殖、迁移、侵袭及凋亡等生物学行为的影响本研究针对KCNMB2-AS1 设计了两种siRNA,转染AGS 细胞48 h 后QRTPCR 结果证实两种siRNA 的敲减效果满意,其中siRNA#1 的敲减效率更好(P<0.05,图3A)。细胞计数及克隆形成实验显示,敲减KCNMB2-AS1 抑制AGS 细胞的增殖(P<0.01,图3B、C)。Transwell小室实验显示,敲减KCNMB2-AS1 抑制AGS 细胞的迁移及侵袭能力(P<0.01,图3D、E)。流式细胞仪分析显示,敲减KCNMB2-AS1 促进AGS 细胞的凋亡(P<0.01,图3F)。

表1 胃癌患者癌组织中KCNMB2-AS1 的表达与临床病理特征的关系Tab.1 The relationship between the expression of KCNMB2-AS1 in cancer tissues and clinicopathological characteristics of gastric cancer patients 例
2.4 敲减KCNMB2-AS1 对肿瘤相关基因表达的影响QRT-PCR 结果显示敲减KCNMB2-AS1 后,上皮间质转化(epithelial-mesenchymal transition,EMT)相关标志物发生显著改变,其中间质标志Ncadherin、Fibronectin 1 表达下调,转录因子Twist1、Slug、ZEB1 的表达亦受到抑制(P<0.01,图4),而CDK4、P53、P57、VEGF、EGFR等无明显变化。此外,抑癌基因PTEN 的表达明显上调(P<0.01,图4),提示KCNMB2-AS1 可能通过PTEN 影响胃癌细胞的生物学行为。
3 讨论
本研究结果显示KCNMB2-AS1 在胃癌组织和血浆中表达上调,并与肿瘤大小、淋巴结转移、TNM 分期密切相关。组织KCNMB2-AS1 的高表达提示胃癌患者生存率降低,或可作为胃癌患者的预后指标。血浆KCNMB2-AS1 诊断胃癌的ROC 曲线下面积为0.865,提示其具有较好的诊断价值。体外功能学实验显示,敲减KCNMB2-AS1 抑制胃癌细胞的增殖、迁移和侵袭能力,并诱导胃癌细胞凋亡,在细胞水平进一步证实KCNMB2-AS1 在胃癌的发生发展中起着调控作用。
为了探讨KCNMB2-AS1 调控胃癌细胞生物学表型的分子机制,本研究对与细胞周期、细胞凋亡、血管生成、迁移和侵袭等肿瘤相关的基因进行筛查。QRT-PCR 结果显示敲减KCNMB2-AS1 显著抑制N-cadherin、Fibronectin 1 等EMT 相关间质标志物的表达,而对其他肿瘤相关基因的表达无明显影响,提示KCNMB2-AS1 可能主要通过EMT 途径影响胃癌细胞的表型恶化。进一步对EMT关键转录因子进行分析,发现KCNMB2-AS1 主要通过影响Twist1、Slug 及ZEB1 的变化来实现对EMT 过程的调控,而该过程与Snail无明显关系。EMT是指上皮源性细胞转化为具有间质表型细胞的过程,在癌症的发生、进展过程中发挥着关键作用[12-13]。其通常表现为转录因子Twist1、Snail、Slug、ZEB1和间质标志物N-cadherin、Vimentin、Fibronectin 1等的表达上调,而上皮标志物E-cadherin 表达下调,上皮源性细胞失去细胞极性,细胞黏附能力下降、迁移运动能力增强,导致肿瘤的发生发展和远处转移[13-14]。众多研究[15]已表明lncRNA 的异常表达可促进EMT 的形成,从而调控肿瘤的进展。由此,笔者认为KCNMB2-AS1 可能通过EMT 途径影响胃癌细胞的生物学行为。
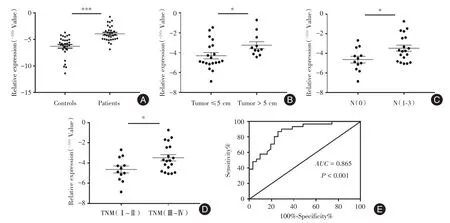
图2 KCNMB2-AS1 在胃癌患者及健康体检者血浆中的表达及临床意义Fig.2 The expression and clinical significance of KCNMB2-AS1 in plasma of gastric cancer patients comparing and healthy subjects
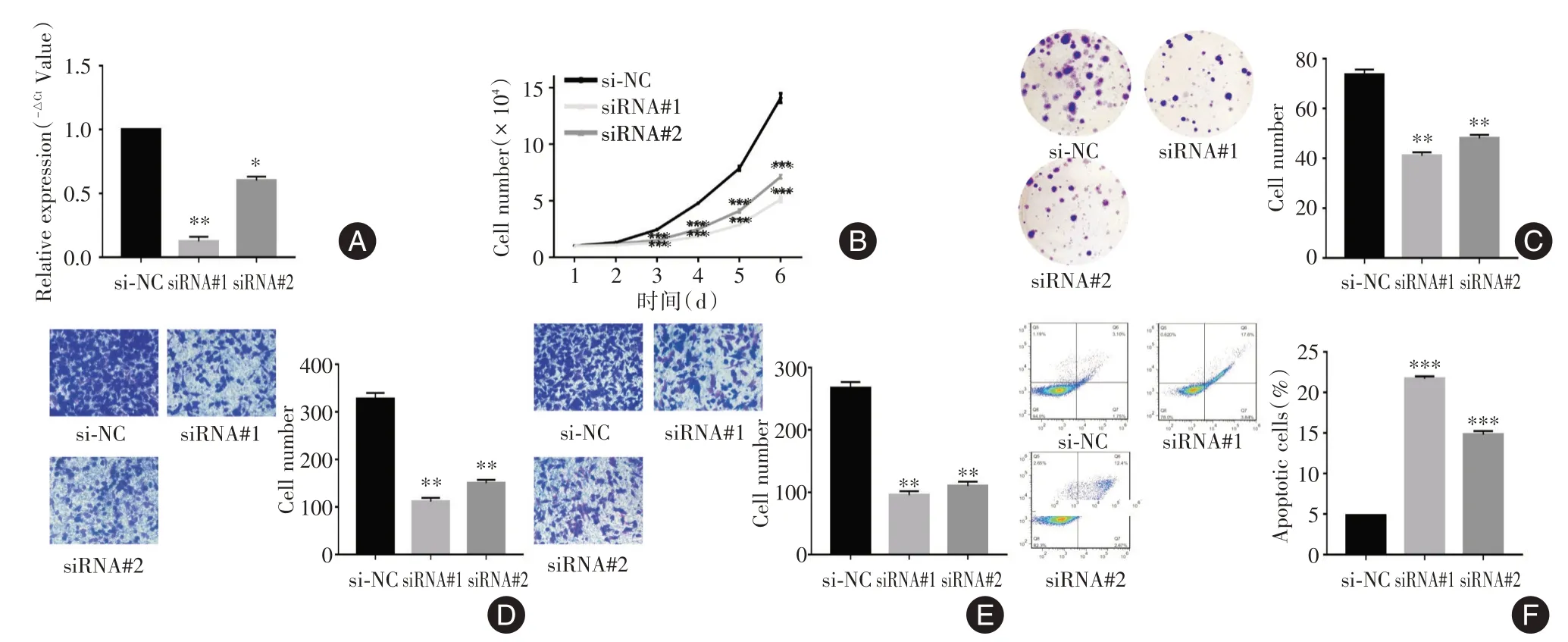
图3 敲减KCNMB2-AS1 对胃癌细胞增殖、迁移、侵袭及凋亡等生物学行为的影响Fig.3 The effects of KCNMB2-AS1 knockdown on the biological behaviors of gastric cancer cells,such as proliferation,migration,invasion and apoptosis
lncRNAs 调控EMT 的路径不尽相同,研究[16]发现lncRNA ATB 通过与miRNA 竞争性结合诱导肿瘤细胞的EMT,有研究[17]表明MEG3 可以调节组蛋白H3 的甲基化、募集PRC2 进而调控肺癌细胞的EMT,WU 等[18]认为NKILA 抑制乳腺癌细胞EMT 过程与其阻断NF-κB 信号有关。本研究通过QRT-PCR 进一步探讨了KCNMB2-AS1 调控EMT的潜在上游分子。结果显示敲减KCNMB2-AS1 后抑癌基因PTEN(phosphatase and tensin homolog)的表达明显升高。PTEN基因定位于染色体10q23.3,由9 个外显子组成,编码403 个氨基酸构成的蛋白质。PTEN 蛋白是一种与tensin 序列相近的磷脂酰肌醇磷酸酶,可以通过拮抗PI3K-AKT-mTOR 信号通路抑制肿瘤的发生[19],此外PTEN 在细胞核内亦发挥不依赖PI3K-AKT及蛋白激酶活性的作用,PTEN 水平的细微变化可导致癌症易感性和肿瘤的进展,这些发现提示PTEN在与肿瘤相关的多种调节机制中起着关键作用[20]。有研究[21-22]表明PTEN 可以通过影响Twist、Snail、Slug 和ZEB1 等诱导EMT 过程。近些年来lncRNAs 通过PTEN 调控肿瘤EMT 过程的分子机制逐渐被阐明,ZENG 等[23]发现lncRNA GAS5 通过miR-21/PTEN 轴抑制口腔鳞状细胞癌的EMT,而在非小细胞肺癌和胃癌中,FAL1 可以通过PTEN/AKT 轴促进EMT 的发生,因此,笔者认为KCNMB2-AS1 对于胃癌细胞EMT 的调控可能由PTEN所介导。
综上,KCNMB2-AS1通过诱导EMT过程参与胃癌的发生发展,可能成为胃癌潜在的诊断指标和治疗靶点。此外,PTEN 可能作为KCNMB2-AS1 下游靶点调控胃癌细胞EMT,后续研究将进一步探讨KCNMB2-AS1、PTEN 与EMT 之间的关系,以阐明KCNMB2-AS1在胃癌发生发展中的具体作用机制。

图4 敲减KCNMB2-AS1 对胃癌细胞肿瘤相关基因表达的影响Fig.4 The effect of KCNMB2-AS1 knockdown on tumorrelated gene expression in gastric cancer cells
