朱砂根种子组织培养与愈伤组织的诱导
2020-07-24侯欣跃谢钰鑫于复欣马宇田路艳
侯欣跃 谢钰鑫 于复欣 马宇田 路艳

摘 要:目的:研究药用观赏植物朱砂根种子组织快繁技术和试管苗不同部位愈伤组织诱导,为其转基因、毛状根诱导、有效药用成分研究与朱砂根产业化生产苗木提供依据。方法:选用当年采收,籽粒饱满,没有残缺或畸形,没有病虫害的种子为材料,考察不同基本培养基、植物激素对朱砂根种子发芽诱导、继代及愈伤组织诱导。结果:1/2MS+6-BA1.0mg/L+NAA0.05mg/L培养基配方比较适用于朱砂根种子初代培养;MS+6-BA1.0mg/L+NAA0.1mg/L培养基配方比较适用于继代培养。不同外植体中,朱砂根茎段有利于促进愈伤组织形成。
关键词:朱砂根;种子;组织培养;愈伤组织
中图分类号 S567.19文献标识码 A文章编号 1007-7731(2020)13-0025-04
朱砂根(Ardisia crenata Sims),又名大罗伞、富贵籽,是紫金牛科(Myrsinaceae)紫金牛属(Ardisia)观赏药用植物[1]。在我国,主要零星分布于西藏东南部至台湾,湖北至海南岛等热带与亚热带地区[2]。作为传统药用植物,朱砂根具有祛风除湿、祛痰止咳、降血压、抗癌抑菌、抗HIV和抗肿瘤等重大功效[3]。朱砂根自然繁殖缓慢,扦插和压条繁殖系数相对较低,播种繁殖易产生性状分离,阻碍了朱砂根的产业化开发和利用。植物组织培养在离体条件下获得再生完整植株,生长周期短,繁殖率高,并能保持优良品种的遗传特性,是拯救濒危植物、生产具有经济价值产品、实现工厂化生产的重要技术方式。黄美娟等[4]报道了朱砂根茎段组织培养和快速繁殖的培养条件;丁力等[5]研究了不同植物激素对朱砂根愈伤组织诱导不定芽的影响;陈俊晖等[6]建立了金边朱砂根的组培快繁体系;蔡长福等[7]探讨了朱砂根组织培养防褐化的技术措施。朱砂根组织培养成苗过程比较漫长,获取无菌苗的外植体材料一般为带芽茎段[8-9],以种子为外植体材料的研究较少。带芽茎段含真菌、细菌较多,消毒不彻底极易污染或在组培过程中极易褐化死亡。朱砂根的种子数量繁多、取材方便、消毒容易、褐化率低,是最理想的外植体材料。本研究以朱砂根当年结实种子为外植体材料,通过不同的消毒方法、不同浓度细胞分裂素、生长素的组合使用,开展朱砂根种子离体培养和诱导愈伤组织形成的研究,初步建立朱砂根种子离体快繁技术和方法,为朱砂根工业化生产苗木、野生资源保护与次生代谢化学成分研究奠定基础。
1 材料和方法
1.1 试验材料与处理 实验在潍坊学院生物与农业工程学院重点实验室进行。从潍坊广发花卉市场购买朱砂根盆栽(带果实),采摘当年籽粒饱满、没有病虫害的健壮种子。无菌播种前对种子进行处理,从植株上摘取朱砂根的成熟果实,去掉果皮和果肉,在洗衣粉溶液中浸泡30min,搓洗干净,然后用纱布包住,流水下冲洗5~6h,用無菌水冲洗3遍,置于无菌瓶中用无菌水浸泡24h(每隔12h换水1次)。
1.2 试验方法
1.2.1 消毒时间试验 将处理好的朱砂根种子置于超净工作台上,先用75%酒精消毒20s,无菌水漂洗3~4次;用0.1%HgCl2(升汞)浸泡4min,无菌水漂洗3~4次,再用0.1%HgCl2(升汞)浸泡2、3、4、5、6min,无菌水漂洗5次,无菌滤纸吸干水分后将种子接种到1/2MS培养基上,每瓶接种3粒,共接种10瓶,2次重复。观察种子的萌发情况、褐化情况与污染情况,30d后统计发芽率、褐化率与污染率。
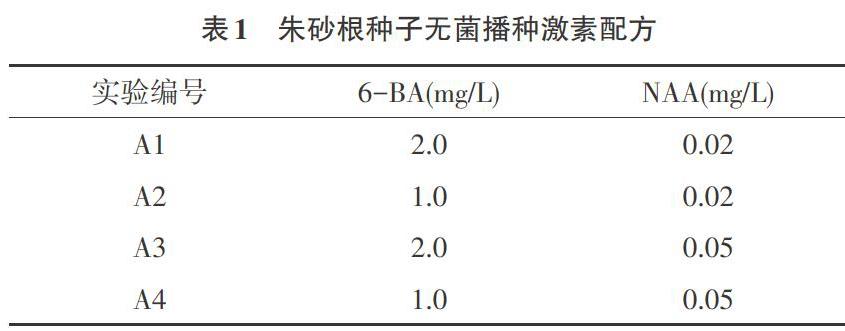
1.2.2 种子无菌接种培养基的筛选 以1/2MS培养基为基本培养基,将种子接种到不同激素配方的培养基上(表1)。培养条件:温度(25±1℃),光照12h/d,光照强度1000lx,光照12h/d。50d后观察试管苗生长情况。
1.2.3 朱砂根种子试管苗继代培养基筛选 将生长健壮的种子试管苗剪成1.5~2.0cm长的带芽茎段,接种到继代培养基中,注意形态学上下端不要颠倒,每瓶接种2~3个,继续培养。以MS培养基为基础培养基,附加不同浓度植物激素组合配方(表2)。观察茎段和丛生芽生长情况,30d后统计丛生芽增殖系数。培养条件:温度(25±1℃),光照12h·d-1,光照强度2000lx,光照12h/d。
1.2.4 试管苗不同外植体愈伤组织诱导 以MS+6-BA0.2mg/L+NAA1.0mg/L+2,4-D0.5mg/L为基本培养基,接种朱砂根无菌苗的根、茎段和嫩叶,观察愈伤组织的生长情况,30d后统计出愈率和愈伤组织增殖系数。培养条件:温度(25±1℃),光照12h·d-1,光照强度2000lx,光照12h/d。
1.3 数据统计 采用Excel2010和SPSS20.0统计软件对试验数据进行统计分析。
启动率(%)=(发芽的种子数/试验种子总数)×100;褐化率(%)=(褐化的种子数/试验种子总数)×100;污染率(%)=(污染的种子数/试验种子总数)×100;出愈率(%)=(出现愈伤组织数/外植体接种数)×100。丛生芽增殖系数=(再生丛生芽数/接种数)×100;愈伤组织增殖系数=(30d时愈伤体积/接种时愈伤体积)×100。
2 结果与分析
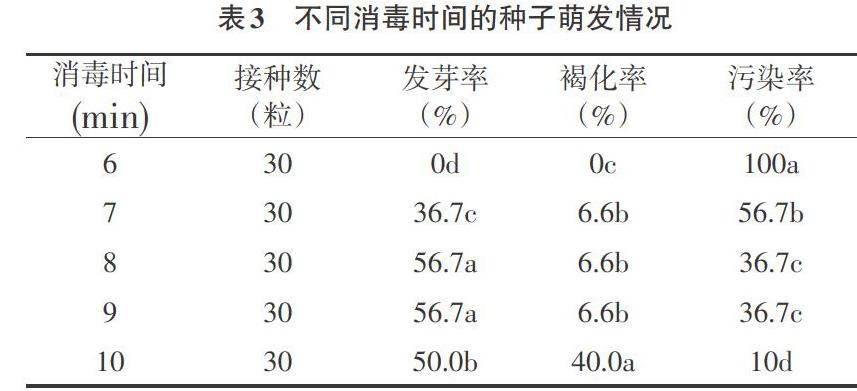
2.1 不同消毒时间对种子无菌萌发的影响 无菌接种后第2d开始观察不同消毒时间处理后种子的生长情况。由表3可以看出,灭菌时间不同,消毒效果不同,污染率不同。种子接种3~7d后,污染的种子周围培养基开始出现水渍状菌圈,随后种子表面长出霉菌。菌圈颜色加深,表现为黄白色、白色、黑色,黑色居多、菌毛较长,形成较大菌圈,培养基表面形成一层墨绿色菌层。在此期间,若发现接种的种子未全部污染,可将未污染种子及时转移进新培养基中继续观察。种子接种10d后若种子开始长菌污染,主要原因为种子内生菌污染或培养过程污染。
消毒时间6min,种子全部污染。延长消毒时间到7min,种子发芽率为36%,污染率最高54%,将时间延长到8、9min,发芽率相同污染率接近,将时间延长至10min,污染率有所下降,种子周围培养基轻微黄色,并且未发芽未污染种子所占比重有所增加。结果表明,灭菌时间过短消毒不彻底,污染率增加,灭菌时间过长则产生毒害作用,降低种子活性,种子褐化死亡,影响发芽。因此选用75%酒精消毒20s,无菌水漂洗3~4次,用0.1%HgCl2消毒总时长达到8~9min,朱砂根种子发芽率为56.7%,污染率36.7%,消毒效果较好。
2.2 不同激素组合对种子发芽的影响 多数种子在接种10d后开始萌发,根点变绿,慢慢突破种皮,伸长成绿色胚根(图1A)。接种50d后开始长出第1片叶,90d后朱砂根试管苗株高平均4.5cm,生长健壮。不同浓度和配比的激素组合,对朱砂根种子发芽具有显著影响。由表4可知,A4培养基1/2MS+6-BA1.0mg/L+NAA0.05mg/L发芽率比较高,发芽率可达到77.78%,A2培养基1/2MS+6-BA1.0mg/L+NAA0.02mg/L种子发芽率为70.59%以上,A2大部分朱砂根种子发芽时间早于A4。NAA浓度相同,相对低浓度的6-BA有利于种子萌发,6-BA浓度相同,相对高浓度NAA有利于种子萌发。
2.3 不同激素组合对试管苗继代培养的影响 朱砂根试管苗茎段接种10d后,茎段顶端保留小叶开始生长,15d后侧芽开始生长,茎段切口产生愈伤组织,30d后侧芽长出新叶(图1C),60d后长成新的试管苗(图1D)。不同激素组合对试管苗的继代培养影响显著。由表5可见,MS+6-BA1.0mg/L+ NAA0.1mg/L比较适合朱砂根试管苗继代诱导芽生长,侧芽启动率为88.42%,明显高于其他处理。在本研究中,经过一段时间培养,继代苗会在茎段和培养基接触处出现褐化现象,影响试管苗的生长发育。在培养基中加入少量活性炭、及时更换培养基可以有效抑制褐化现象。
2.4 朱砂根试管苗不同部位愈伤组织诱导与继代培养 愈伤组织分化难易程度与植物不同部位有着密切关系。15~20d后,大部分外植体切口处开始出现愈伤组织(图1E)。茎段切口出现白色略带米黄色愈伤组织,愈伤组织结构紧密;叶片颜色变得鲜绿并开始膨大,未出现愈伤组织,部分叶片边缘切口发黑;根部膨大,愈伤组织不明显,部分根段周围培养基发黄。由表6可见,朱砂根的茎段相对于根与叶更适合诱导愈伤组织,褐化少,愈伤组织分裂能力强,长势好。愈伤组织接种到继代培养基,10d后愈伤组织不断膨大生长,由白色略带黄绿色逐渐转变为白色,白色愈伤组织结构松散。愈伤组织生长迅速,外层愈伤组织容易褐化,有的分化出小苗(图1F)。下一次继代培养时可以将外层松散愈伤组织切除,继代培养基中加入少量活性炭,可有效抑制褐化。
3 结论与讨论
3.1 结论 本次研究结果可知,无菌播种前,种子用75%酒精消毒20s,0.1%HgCl2(升汞)分2次消毒,消毒总时长达8~9min消毒效果最好。细胞分裂素与生长素不同浓度配比影响朱砂根种子萌发和芽苗的继代培养。培养基1/2MS+6-BA1.0mg/L+NAA0.05mg/L适合于朱砂根种子无菌播种培养,种子发芽率可达到77.78%;培养基MS+6-BA1.0mg/L+NAA0.1mg/L适合于种子试管苗继代培养,诱导率为88.42%。在朱砂根组织培养过程中,及时更换培养基,加入少量活性炭可有效抑制组织褐化。不同外植体中,朱砂根茎段比较适合促进愈伤组织形成,诱导率为83.33%,同时愈伤组织生长状况良好。
3.2 讨论
3.2.1 消毒方法 外植体的无菌消毒是植物离体培养技术成功的关键。植物材料不同,采用的消毒剂的种类和浓度不同。胡海英等[10]对金莲花种子采用无毒级杀菌消毒剂爱力克与75%乙醇配合消毒, 消毒效果最佳;蔡长福等[7]从消毒液的种类和浓度等方面,探讨了朱砂根外植体消毒的有效方法。本研究对原有的朱砂根种子消毒处理方法进行改进,有效提高了消毒效果。增加流水冲洗时间至5~6h,置于无菌瓶中用无菌水浸泡24h,增加75%酒精消毒时间至20s,能够消灭大部分的细菌,同时不影响种子的活性。HgCl2作消毒剂,种子消毒过程中消毒时间过久会出现毒害现象,影响种子萌发[11]。本研究将升汞消毒时间分成2段,减缓了升汞对种子的毒害作用,起到很好的消毒效果。除此之外,本研究采用增加升汞浓度、升汞与吐温配用等消毒措施,均没有取得良好效果。朱砂根外植体污染率高,与朱砂根生长环境避光阴湿、微生物活性強,果实坚硬、种子含有内生菌等因素有关,增加了消毒难度。
3.2.2 植物激素 朱砂根种子无菌培养过程中,植物激素起到重要作用。植物不同生长时期,所需的激素种类和浓度不同。本研究主要探讨了6-BA,NAA 2种植物激素对朱砂根种子与丛生芽诱导的影响。研究发现,种子萌发时期NAA生长素需要量低于幼苗时期。在种子离体培养过程中7d内需要重点观察,若出现污染及时转移培养基补救可以有效降低污染率。关于朱砂根无根苗接种到培养基中,切段不带顶芽叶腋中的小芽生长较快,带顶芽生长缓慢,研究结果与马明东等[8]的结果相似。7d继代培养,幼苗生长缓慢,腋芽数量少,随着继代次数增加,单株试管苗腋芽数量也开始增多,可逐渐达成扩繁效果。
3.2.3 愈伤组织因素 组织培养过程中,植物细胞损伤、无菌环境等条件会促进愈伤组织形成。愈伤组织是由植物细胞分化的薄壁细胞,可进行脱分化形成新植株。朱砂根组织培养中形成的愈伤组织大多呈现黄白色。在促进朱砂根形成愈伤组织过程中,朱砂根不同外植体愈伤组织诱导其茎段产生愈伤组织产量高于叶与根,与黄素华等[12]的研究结果相似。叶片和根段愈伤组织分化能力弱,切口受创相对面积大,伤口处分泌的酚类化合物被氧化为醌,醌通过非酶促反应产生有色物质而导致组织褐变,易向培养基内释放褐化物质,使培养基变黄。导致细胞失去愈伤组织分化能力,褐化死亡。茎段分裂能力最强,褐化少分化愈伤组织时间短,适用于诱导愈伤组织[13]。
参考文献
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1979:70.
[2]陈彬豪.观果地被——朱砂根[J].中国花卉园艺,2014(3):48
[3]邓素芳.福建朱砂根离体培养及RAPD分析[D].福州:福建农林大学,2007.
[4]黄美娟,刘小辉,邓娅玲,等.朱砂根的组织培养和快速繁殖[J].植物生理学通讯,2007(06):1149-1150.
[5]丁力,孔祥海,邱丰艳,等.富贵籽愈伤组织诱导不定芽的研究[J].龙岩学院学报,2012,30(5):67-71.
[6]陈俊晖,漆子钰,骆亮,等.金边朱砂根组培学特性及种子离体快快繁体系的建立[J].江苏农业科学,2017,45(17):50-53.
[7]蔡长福,卢丽俐,苏庆桂,等.朱砂根组织培养防褐化探讨[J].福建林业科技,2013,40(01):99-102.
[8]马明东,刘均利,蒲尚饶.朱砂根的组织培养与植株再生[J].中国中药杂志,2009,34(16):2043-2046.
[9]胡菊.发根农杆菌介导朱砂根遗传转化体系的建立及发根中三萜皂苷的检测[D].雅安:四川农业大学,2015.
[10]胡海英,李瑜.金莲花种子无菌播种及离体培养技术[J].江苏农业科学,2016,44(07):230-233.
[11]杨玉芳,王玄,赵红霞,等.金莲花组织培养和快繁体系建立的研究[J].中国农学通报,2011,27(8):136-139.
[12]黄素华,陈清坤,林小婷,等.朱砂根皂苷高产愈伤组织的诱导与筛选[J].湖北农业科学,2017,56(12):2359-2361.
[13]徐文华,徐文军,李艳玲.藏药桃儿七种子离体培养条件优化研究[J].中药材,2019,42(04):725-729. (责编:王慧晴)
