宜兴市稻田表层土壤生物固氮量的空间分异特征①
2020-07-24徐梦洁庄舜尧
王 鑫,姚 尧,徐梦洁*,庄舜尧
宜兴市稻田表层土壤生物固氮量的空间分异特征①
王 鑫1,姚 尧1,徐梦洁1*,庄舜尧2
(1南京农业大学公共管理学院,南京 210095;2土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008)
通过对水稻土的系统采样,利用乙炔还原法估算宜兴市稻田土壤的生物固氮量;采用地统计学方法,对稻田土壤的生物固氮量空间变异特征进行分析。结果表明:研究区单位面积生物固氮量范围为0.75 ~ 46.85 g/m2,均值8.04 g/m2。采用普通克里格法对采样数据进行了空间插值,稻田土壤的生物固氮量总体呈带状分布,高值区位于研究区西南和东南方向靠近丘陵地区,低值区则位于研究区西北和东北方向地势平坦的区域。地统计学中的变异系数和块金值均表明稻田土壤的生物固氮量属中等空间变异,即研究区内稻田土壤的生物固氮量受到结构性变异和随机变异的共同影响。可见,人为经营活动与自然环境共同影响着稻田土壤的生物固氮量。
水稻土;生物固氮量;空间变异特征;地统计学方法;普通克里格插值
氮是生命的核心元素,自然界中氮主要以惰性的氮气(N2)形式存在,绝大部分生物不能直接利用,必须通过固氮作用将N2转化为活性氮才能加以利用[1]。生物固氮是主要的固氮方式,其速率受多种因素影响,与土壤有效氮浓度也存在着密切关系[2]。近年来,以化肥方式输入生态系统的氮量激增,这些新输入氮并不能被完全利用[3],从而导致农业氮污染等环境问题。因此,研究生物固氮对生态系统氮收支、农牧业应用和环境氮污染的治理都具有重要意义[2]。目前对生物固氮的研究主要集中在生物固氮形式、固氮菌种类、作用机理与基因等微观方面[4-5]:如李玉文[6]在外来大豆根瘤菌和土著根瘤菌中筛选出固氮效果最佳的根瘤菌菌株,以提高大豆产量和品质;有些研究详细地介绍了自生固氮、共生固氮和联合共生固氮3种固氮方式的特点和适用性[7-8];还有一些研究深入到生物分子层面,如陈华清等[9]研究发现的H与D等6个生物固氮系统中固氮所必需的基因。研究者在微观生物固氮方式及固氮基因等方面做了大量的研究,得出了不少兼具理论和实践意义的成果。
但是,对生物固氮的空间分异研究较少,已有研究主要集中在固氮微生物的空间分布差异和固氮速率的空间差异上。王丽娜等[10]研究发现不同种类固氮微生物在亚热带水库的空间分布存在着差异。孙秀茹[11]指出滩涂地不同空间位置上土壤的生物固氮速率存在着差异。除此之外,还有部分文献研究了不同土地利用方式对生物固氮量的影响[12-13]。因此,本研究建立在已有的研究基础上,借助地统计学分析和空间分析方法研究和揭示生物固氮量及其空间变异特征。
江苏省宜兴市是典型的水稻种植区,地处太湖流域西部,地势较高,是太湖水补给的重要流经地[14]。宜兴市拥有发达的经济、密集的人口、较高的农耕集约化程度,在化肥、农药上的投入也要高于全国平均水平;市内降水丰沛,河网密布,易导致污染流入太湖水体[15]。因此,研究宜兴市稻田土壤的生物固氮可以为水稻减施氮肥提供参考,从而降低太湖环境污染风险。本研究以宜兴市稻田土壤为研究,采用系统网格法采集土壤样品,并利用乙炔还原法测定生物固氮量,结合地统计学和GIS分析生物固氮量的空间分异,进而估算生物固氮总量,研究稻田土壤生物固氮量的空间分异和规律。
1 材料与方法
1.1 研究区概况
宜兴市地处31°07′ ~ 31°37′N、119°31′ ~ 120°03′E。地貌形态多样,其中60% 为平原,其余为丘陵和渎区,土壤类型以水稻土、黄棕壤和潮土为主[16]。宜兴市全年四季分明,温暖湿润,年平均气温16.3 ℃,年平均降水量为1 294 mm。水资源丰富,北接滆湖,东临太湖。截至2015年宜兴市耕地面积528.71 km2,主要作物为一年两熟制的水稻及油菜、蔬菜等。
1.2 采样点布设
参照宜兴市土壤类型分布图和2015年土地利用空间数据,以2 km × 2 km网格在宜兴市布设采样点,并导出采样点坐标[17],采样点分布如图1所示。根据坐标实地取样,记录编号。采样时在每个坐标点所在1 m × 1 m的正方形区域内的中心点和四个角各取一份表层(0 ~ 20 cm)土样,混合均匀后带回实验室[16],并且在中心点处用环刀多取一份土样,测定其容重,用于后续单位面积氮总量估算。
1.3 试验设计与数据采集
试验中盆栽种植水稻方法是将事先处理好的水稻土壤样品放入试验盆(规格为10 cm × 10 cm × 35 cm),每个盆内放入30 cm深的土壤样品。在水稻移栽前进行一个星期的淹水处理,并施一定量的复合肥作为基肥,施肥总量按照当地施肥水平N 270 kg/hm2,且N︰P2O5︰K2O=2︰1︰1,基肥施氮量为设计施氮量的50%,分蘖肥和穗肥施氮量均为设计施氮量的25%[17]。水稻移栽时,每个盆内移栽两株秧苗,秧苗移栽后1个月内,连续淹水管理(保持淹水层3 ~ 5 cm),以后间隙淹水管理(淹水–湿润管理)。
本研究采用乙炔还原法测定水稻土的生物固氮量,乙炔还原法可以对土壤的生物固氮潜力进行估算。该方法的原理是土壤固氮酶可以将C2H2还原成C2H4,因此可根据C2H4产生量来确定生物固氮量[18-21]。在水稻生长期内每周从盆栽水稻盆钵中取土,用乙炔还原法测定土壤的生物固氮速率。从盆栽水稻盆中取土时,用小土钻取整个盆栽土壤厚度的土壤,同时称取1份土壤样品测定其含水量,测定多下来的土壤回到各自盆中,重复3次。盆栽试验是与当时的田间水稻种植同步进行,从水稻移栽后开始采样,持续到水稻烤田期,每周一次,共13次。在烤田期后,稻田生物固氮量较低,试验不再测定。利用每周数据累加来计算整个水稻生长季的生物固氮量。
1.4 空间分析方法
克里格(Kriging)法是国际上公认的空间插值方法,也是地统计学的主要方法。该方法是基于变量相关性和变异性,考虑被描述对象的空间相关性质,在有限区域内对区域化变量的取值进行线性无偏最优估计,使预测结果更接近实际情况[22]。
本研究采用了ArcGIS 10.2、GS+9.0软件进行了半方差函数理论模型的拟合和空间分布图绘制,采用SPSS 22.0进行了统计分析。本研究的地图数据主要有研究区的1︰50 000土壤图、1︰100 000土壤地形图、研究区行政区划图和2015年土地利用空间数据。其中2015年土地利用空间数据来源于地理国情监测云平台和北京数字空间科技有限公司,该数据经过验证土地利用一级类型综合评价精度达到94.3% 以上,二级类型分类综合精度达91.2% 以上,达到研究要求。
2 结果与分析
2.1 描述性分析
采用以平均值加减3倍标准差为阈值的方法对148个原始数据进行判别后剔除了9个异常值,并计算各指标的统计特征(表1)。
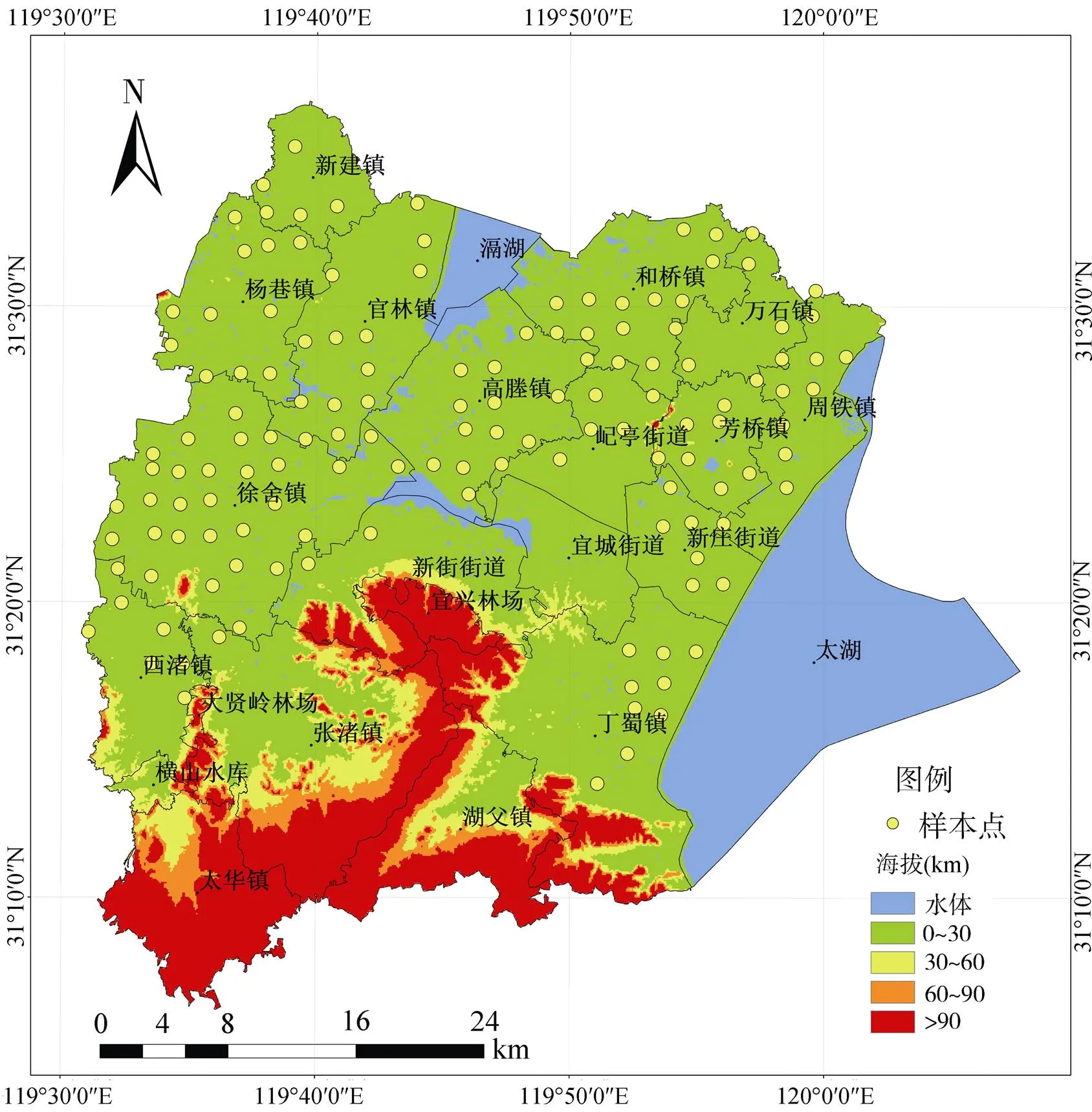
图1 研究区域采样点分布图
稻田土壤生物固氮量最大值20.28 g/m2,是最小值(0.75 g/m2)的27倍左右,差异较大;中位数与平均值相差显著,表明水稻土壤生物固氮量的中心趋向分布不一致;变异系数CV为73.37% 和标准差5.48表明稻田土壤生物固氮量属于中等空间变异程度[23]。
K-S检验结果表明研究区内稻田土壤生物固氮量数据并非正态分布,其偏度达到0.996。为了消除由比例效应带来的估值误差,使得插值结果更为准确,根据研究区内稻田土壤生物固氮量原始数据的偏斜性,对数据进行对数转换。转换后数据的偏度降为 –0.272,峰度为–0.509,K-S检验的显著性大于0.05,近似正态分布(表2),下一步可以进行地质统计学的分析。

表2 稻田土壤生物固氮量经对数转换后的一般统计特征
首先,借助GS+9.0软件计算获取普通克里格插值法中最优拟合模型[24],相关结果见表3。其中决定系数越接近1.0,残差越小则表示拟合的模型效果越好[25]。指数函数为最优拟合模型,其决定系数2最高为0.705。

表3 稻田土壤生物固氮量的半方差函数理论模型及相关参数
块金系数介于25% ~ 75%,属于中等程度空间相关性,即生物固定量的空间变异是受到结构性变异和随机性变异同时作用而产生的结果[26]。具体而言,研究区稻田土壤生物固氮量是受到结构性变异和随机变异的共同影响,既受到母质、水稻土类型等结构性因素影响,也受到人为因素如施肥量、耕作方式、土地利用变化等影响。研究区生物固氮量变程为16 920 m,大于采样间距2 000 m,表明采样方案能满足空间变异分析的要求。
其次,土壤属性的空间分布特征可以分解为由系统因素引起的固定全局趋势和随机因素引起的短距离变异。随机因素引起的小尺度变异可以通过块金效应和空间自相关距离的模型获得。因此,去除全局趋势则能更好地满足空间自相关规律。如图2所示,全局趋势图中,轴表示稻田土壤的生物固氮量,轴和轴分别表示东西方向和南北方向的地理坐标,可以通过采样点的空间位置与生物固氮量高低投影到表示东西方向上稻田土壤生物固氮量的全局趋势,同样的,表示南北方向上的稻田土壤生物固氮量的全局趋势。总体来看,研究区稻田土壤生物固氮量在东西方向和南北方向都曲线变化较为缓慢,且形态不显著,不能直接从趋势图中判断趋势的阶数,通过变异函数拟合以及交叉验证法对0、1、2和3阶趋势依次进行去除,选取插值效果较好的趋势参数见表4[27]。
利用Kriging模型对元素进行空间插值时,必须符合一定的评判标准才能进行。通常空间预测值的平均误差ME和标准化平均误差越接近0,表明模拟结果越好;平均标准误差ASE和均方根误差RMSE越接近,模拟效果越好;标准化均方根误差RMSSE越接近于1,模拟效果越好[28]。根据上述标准综合选择最佳拟合模型。最后,以指数模型为最佳拟合模型对固氮量进行普通克里格插值。10 m × 10 m的网格下绘制研究区稻田土壤生物固氮量的空间分布图(图3)。

图2 稻田土壤生物固氮量的空间趋势示意图
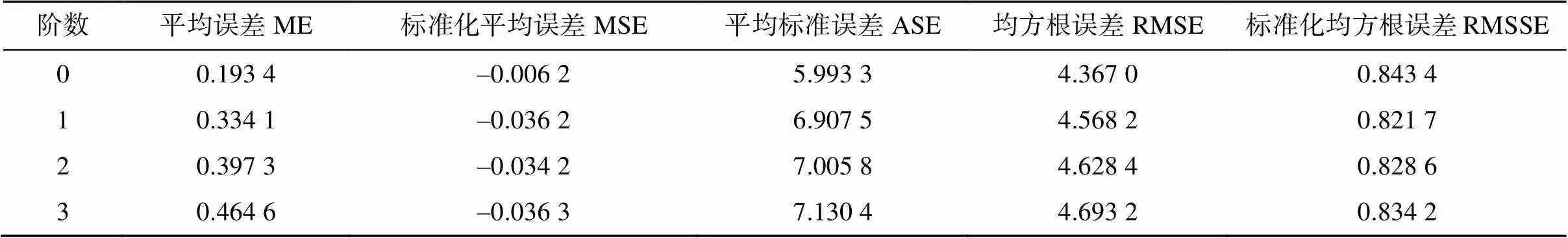
表4 克里金插值模型测试结果
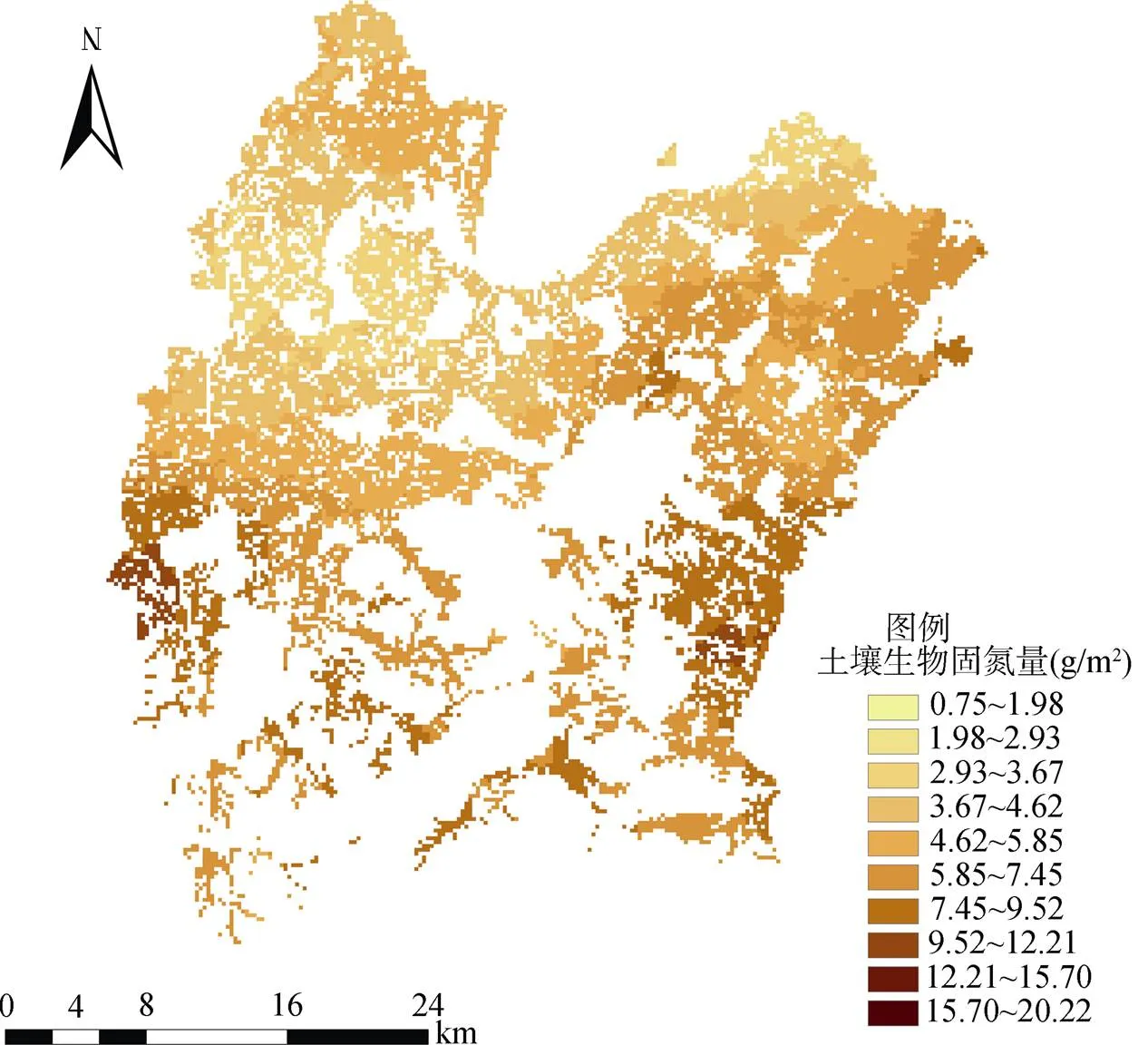
图3 普通克里格方法估测区域稻田土壤生物固氮量的空间分布
稻田土壤生物固氮量总体呈带状,生物固氮量的高值区位于研究区西南和东南方向靠近丘陵地区的水稻土,低值区则位于研究区西北和东北方向地势平坦的区域。由于南高北低的地势,施氮量会影响土壤生物固氮的能力导致南面上游稻田所施部分氮肥积聚到北边下游,影响了下游稻田的生物固氮能力,造成了该种空间分布趋势。并且,普通克里格方法预测的稻田土壤生物固氮量范围都在0.75 ~ 20.22 g/m2,比实际范围(0.75 ~ 20.28 g/m2)小,但十分接近实际范围,说明普通克里格插值方法能够很好地反映整个研究区的空间分布特征。
对研究区采样点的土壤生物固氮量的估测值与实测值之间进行Pearson相关系数分析,了解克里格插值方法获得的稻田土壤生物固氮量的估测值与实测值以及方法之间的相互联系。普通克里格插值方法得到的稻田土壤生物固氮量的预测结果与实测值达到统计意义上的极显著相关水平,即普通克里格插值方法对稻田土壤生物固氮量的预测结果是有效的。
2.2 稻田土壤生物固氮总量的估算
土壤生物固氮量作为土壤属性的组成部分,其含量在空间上是连续渐变的,理论上可以突破类型界限,因此可以通过制作单位面积稻田土壤生物固氮量的空间分布图,利用GIS空间分析功能计算土壤生物固氮量的总量。本研究借鉴Batjes[29]所采用的土壤类型的研究方法,在获得单位面积稻田土壤生物固氮量的分布图后,将研究区内稻田分为不同基本面积单元,在不同基本面积单元下,对研究区稻田土壤生物固氮总量进行估算。采用普通克里格插值的结果,将稻田分为10 m × 10 m、100 m × 100 m、225 m × 225 m的不同基本面积单元,估算出研究区稻田土壤生物固氮量(表5)。
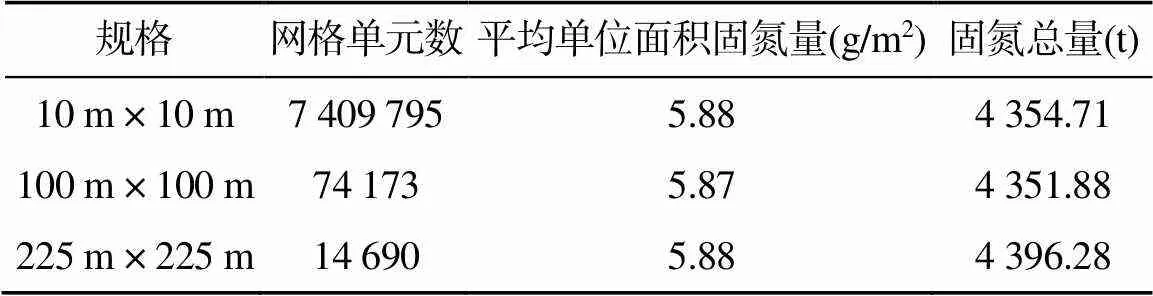
表5 稻田土壤生物固氮量总量的计算结果
表5中固氮总量由每个栅格单元固氮量累加而成,平均单位面积固氮量为固氮总量除以栅格总面积。从表中可以看出在不同尺度网格单元下,平均单位面积稻田土壤生物固氮量基本一致。因为3种栅格尺度下固氮总量相差不大,栅格总面积差异也很小,所以平均单位面积固氮量与尺度的变化之间不存在相关性。研究区稻田土壤生物固氮总量大约在4 351.88 ~ 4 396.28 t,有研究[30]表明2010年我国农田生物固氮量达460万t,研究区农田面积约占全国农田面积的0.06%,计算得出研究区生物固氮量约为2 794.79 t,远低于本研究估算出的稻田土壤生物固氮量,这可能是由于研究区的水稻田呈现斑块状,且土地利用变化较大,加之近几年研究区为保护太湖生态环境,减少氮肥使用,导致稻田土壤生物固氮作用增强,生物固氮总量增加。
3 讨论
稻田土壤的生物固氮能力取决于土壤中微生物固氮菌的数量与活性,而土壤微生物会受到土壤性质及环境的影响。孙冰洁等[31]深入探究农田土壤理化性质对微生物群落的影响,发现土壤密度越小微生物群落较大,孔隙、pH和有机质等对生物群落的规模影响较为复杂,需要结合具体的环境因素和微生物种类加以分析。车荣晓等[2]从分子、个体和群落3种尺度研究了土壤有效氮与生物固氮量之间的关系。结果表明环境中的生物固氮速率与有效氮浓度表现出了负相关,而在不同的尺度下有效氮与固氮微生物的群落和结构之间关系较为复杂还需要进一步进行研究。为了研究不同的水稻土亚类对生物固氮量的影响,因此根据中国土壤发生系统(Genetic Soil Classification of China,GSCC)将宜兴市稻田土壤划分为11个亚类,包括潴育型水稻土、漂洗型水稻土和脱潜型水稻土等,其中潴育型水稻土和漂洗型水稻土是研究区稻田的主要土壤亚类。不同的水稻土亚类在生物固氮量上存在一定的差异(表6),但是亚类间差异检验结果表明水稻土亚类对生物固氮量的影响并不显著(= 0.97,>0.05)。
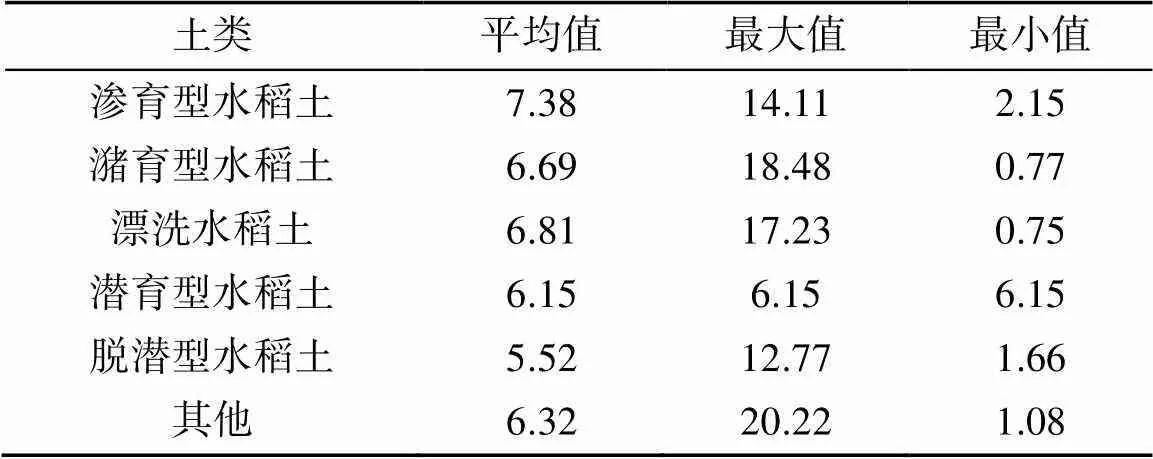
表6 不同种类稻田土壤生物固氮量的一般统计特征(g/m2)
除不同亚类外,为研究pH对研究区内稻田土壤的生物固氮量产生的影响,对研究区内稻田土壤生物固氮量与pH进行Pearson相关分析,两者呈显著负相关(= –0.008,<0.01)。依据pH对研究区内水稻土生物固氮量进行划分(表7),不同的pH间差异不显著(=1.00)。就本研究而言,弱酸性(pH 5.5 ~ 6.5)水稻土总体固氮量平均值最大;中性水稻土固氮量的上限值最高(20.22 g/m2);酸性较强范围下生物固氮效果较差。土壤的其他性质可能也会对土壤生物固氮量产生影响,但具体的影响和作用机理仍需要进一步探究。

表7 不同pH稻田土壤生物固氮量统计(g/m2)
宜兴市稻田的人为经营方式和经营强度各不相同[32],不同的经营方式会造成土壤物理和化学性质的差异[33-34],该种差异最终会影响固氮微生物的生存环境[35-36],造成生物固氮量的差异。龚冬琴[37]以我国南方水稻种植区为研究区进行长期观测和实验,发现连续免耕在黏壤土类和黏土类0 ~ 10 cm表层土壤有机质表现出了相反的变化趋势,黏土类土壤总体有机质含量降低;10 ~ 20 cm土层,两种质地土壤有机质含量均明显低于表层土壤。胡心意[38]的研究表明,对稻田投入不同种类的有机物料和耕作不同的深度会对稻田土壤内磷脂脂肪酸含量和生物多样性产生影响,即深耕和秸秆还田显著提高了土壤真菌、革兰氏阴性菌和土壤总磷脂脂肪酸含量。综上所述,水稻土亚类、土壤pH和人为经营活动的差异会影响研究区内水稻土生物固氮量,但具体影响方式与作用机理和除此之外的其他影响因素仍待探究。
4 结论
本研究利用地统计学中的普通克里格法,结合水稻盆栽试验所获取数据,分析了江苏省宜兴市2015年生物固氮量的空间分异和总固氮量,得到如下结论:研究区内稻田土壤生物固氮量介于0.75 ~ 20.28 g/m2,平均固氮量7.48 g/m2,差异明显;普通克里格预测生物固氮量范围在0.75 ~ 20.22 g/m2,略小于实际范围,但预测值与实测值Pearson系数呈极显著正相关,表明预测结果有效。研究区内生物固氮量与水稻土的空间分布特征一致,均呈条带状分布;研究区生物总固氮量估算值为4 351.88 ~ 4 396.28 t,且与尺度无显著相关性。人为经营活动与自然环境共同影响着稻田土壤的生物固氮能力。
[1] Cheng Q. Perspectives in biological nitrogen fixation research[J]. Journal of Integrative Plant Biology, 2008, 50(7): 786–798.
[2] 车荣晓, 邓永翠, 吴伊波, 等. 生物固氮与有效氮的关系:从分子到群落[J]. 生态学杂志, 2017, 36(1): 224–232.
[3] 李锐. 不同基础地力对水稻产量和肥料利用效率的影响[D]. 武汉: 华中农业大学, 2011.
[4] 张武, 杨琳, 王紫娟. 生物固氮的研究进展及发展趋势[J]. 云南农业大学学报(自然科学), 2015, 30(5): 810– 821.
[5] 徐鹏霞, 韩丽丽, 贺纪正, 等. 非共生生物固氮微生物分子生态学研究进展[J]. 应用生态学报, 2017, 28(10): 3440–3450.
[6] 张欣. 大豆根瘤菌及生物固氮的研究与应用[D]. 哈尔滨: 东北林业大学, 2011: 1–40.
[7] 余叔文, 汤章城. 植物生理与分子生物学[M]. 北京: 科学出版社, 1998.
[8] 王桂华. 微生物肥料浅谈[J]. 大理科技, 2000(1): 29–32.
[9] 陈清华, 韩云蕾, 马尧, 等. 生物固氮基因簇结构与进化研究进展[J]. 中国农业科技导报, 2013, 15(4): 129– 138.
[10] 王丽娜, 陈辉煌, 刘乐冕, 等. 亚热带分层水库固氮微生物时空分布格局[J]. 生态学报, 2016, 36(18): 5827– 5837.
[11] 孙秀茹. 崇明东滩湿地土壤生物固氮速率沿潮滩水淹梯度分布特征[D]. 上海: 华东师范大学, 2018.
[12] 向蓉燕, 谢标, 秦俊, 等. 中国农业生态系统生物固氮量的时空分布[J]. 湖北农业科学, 2013, 52(18): 4333– 4336.
[13] 葛露露, 孟庆权, 林宇, 等. 滨海沙地不同固氮树种叶片氮、磷重吸收与生物固氮的耦合关系[J]. 水土保持学报, 2019, 33(1): 134–138, 144.
[14] 徐辰星, 濮励杰, 朱明, 等. 基于序贯高斯条件模拟的土壤重金属含量预测与不确定性评价——以宜兴市土壤Hg为例[J]. 土壤学报, 2018, 55(4): 999–1006.
[15] 刘红江, 郭智, 郑建初, 等. 太湖地区氮肥减量对水稻产量和氮素流失的影响[J]. 生态学杂志, 2017, 36(3): 713–718.
[16] 沈世华, 荆玉祥. 中国生物固氮研究现状和展望[J]. 科学通报, 2003, 48(6): 535–540.
[17] 江苏省土壤普查办公室编著. 江苏土壤[M]. 北京: 中国农业出版社, 1995: 1-500.
[18] 张圣民, 许明祥, 张志霞, 等. 黄土高原不同地貌类型区农田土壤有机碳采样布点方法研究[J]. 自然资源学报, 2018, 33(4): 634–643.
[19] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
[20] 李香兰, 徐华, 曹金留, 等. 水分管理对水稻生长期CH4排放的影响[J]. 土壤, 2007, 39(2): 238–242.
[21] Hartmann A, Burris R H. Regulation of nitrogenase activity by oxygen in Azospirillum brasilense and Azospirillum lipoferum[J]. Journal of Bacteriology, 1987, 169(3): 944–948.
[22] 姚拓, 龙瑞军, 王刚, 等. 兰州地区盐碱地小麦根际联合固氮菌分离及部分特性研究[J]. 土壤学报, 2004, 41(3): 444–448.
[23] Haahtela K, Kari K, Sundman V. Nitrogenase activity (acetylene reduction) of root-associated, cold-climate azospirillum, enterobacter, klebsiella, and pseudomonas species during growth on various carbon sources and at various partial pressures of oxygen[J]. Applied and Environmental Microbiology, 1983, 45(2): 563–570.
[24] 朱红霞, 陈效民, 杜臻杰. 基于地统计学的土壤氮素与pH的空间变异性研究[J]. 土壤通报, 2010, 41(5): 1086–1090.
[25] Robertson G P. GS+: Geostatistics for the environmental science[M]. Plainwell: Gamma Design Software, 2001.
[26] 胡碧峰. 基于地统计学与GIS的区域土壤重金属污染评价与不确定性分析[D]. 杭州: 浙江大学, 2017: 1–40.
[27] Batjes N H. Effects of mapped variation in soil conditions on estimates of soil carbon and nitrogen stocks for South America[J]. Geoderma, 2000, 97(1): 135–144.
[28] 李小曼, 刘勤, 徐梦洁, 等. 苏南村镇土壤重金属空间变异性研究[J]. 土壤通报, 2016, 47(1): 179–185.
[29] Batjes N H. Total carbon and nitrogen in the soils of the world[J]. European Journal of Soil Science, 1996, 47(2): 151–163.
[30] 徐淑伟. 张宣葡萄产区生态地球化学环境评价[D]. 保定: 河北农业大学, 2009: 1–38.
[31] 孙冰洁, 张晓平, 贾淑霞. 农田土壤理化性质对土壤微生物群落的影响[J]. 土壤与作物, 2013, 2(3): 138–144.
[32] 康甜甜. 基于灰靶模型的宜兴市耕地质量评价[D]. 南京: 南京农业大学, 2016: 5–35.
[33] 方畅宇, 屠乃美, 张清壮, 等. 不同施肥模式对稻田土壤速效养分含量及水稻产量的影响[J]. 土壤, 2018, 50(3): 462–468.
[34] 韩上, 武际, 夏伟光, 等. 耕层增减对作物产量、养分吸收和土壤养分状况的影响[J]. 土壤, 2018, 50(5): 881– 887.
[35] 董春华. 施肥及轮作对红壤稻田微生物特性的影响研究[D]. 长沙: 湖南农业大学, 2014.
[36] 路丹, 雷静, 韦燕燕, 等. 短期免耕和垄作对稻田土壤微生物群落及多样性指数的影响[J]. 西南农业学报, 2015, 28(4): 1670–1674.
[37] 龚冬琴. 南方稻区连续免耕对土壤性质及流域水文水质的影响[D]. 杭州: 浙江大学, 2014: 1–28.
[38] 胡心意. 有机物料和耕作深度对稻田耕层土壤生物学性状的影响[D]. 杭州: 浙江农林大学, 2018: 1–40.
Study on Spatial Characteristics of Biological Nitrogen Fixation of Rice Paddy Soils in Yixing City
WANG Xin1, YAO Yao1, XU Mengjie1*, ZHUANG Shunyao2
(1 College of Public Administration, Nanjing Agricultural University, Nanjing 210095, China; 2 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)
The spatial characteristics of biological nitrogen fixation (BNF) of rice paddy soils in Yixing city was studied using the acetylene reduction method and geostatistics method. Soil samples were collected systemically with a grid of 2 km×2 km. Results showed that BNF rate ranged from 0.75 to 46.85 g/m2with an average of 8.04 g/m2. The raw data was logarithmically transformed to meet a normal distribution and then an optimized Kriging method was employed to describe the spatial distribution of BNF. BNF showed a belt distribution in the study region. The high value of BNF occurred in the southwest and southeast areas while the low value in northwest and northeast areas of the study region. The variation coefficient and nugget value showed a medium spatial variation of the BNF. Generally, BNF of paddy soils was influenced simultaneously by the artificial management and natural condition.
Rice paddy soils; Biological nitrogen fixation; Spatial characteristics; Geostatistics; Kriging method
S151.9
A
10.13758/j.cnki.tr.2020.03.028
王鑫, 姚尧, 徐梦洁, 等. 宜兴市稻田表层土壤生物固氮量的空间分异特征. 土壤, 2020, 52(3): 618–624.
国家科技基础性工作专项(2015FY110700)资助。
(xmj@njau.edu.cn)
王鑫(1993—),男,安徽岳西人,硕士研究生,主要从事地理信息方面的研究。E-mail: 837335333@qq.com
