一种牦牛曲拉干酪素的结构及功能性质
2020-07-23何林枫蔡丽莎杨宽曾珍李诚
何林枫 蔡丽莎 杨宽 曾珍 李诚


摘要:為了研究牦牛曲拉干酪素的结构及功能性质,以牦牛曲拉为原料,将胃蛋白酶、木瓜凝乳酶、酵母凝乳酶复配成复合凝乳酶,用混合凝乳酶制备牦牛曲拉干酪素,对牦牛曲拉干酪素的基本成分、氨基酸组成、蛋白质组成、红外光谱特性、圆二光谱特性、变性温度等进行分析,并模拟食品加工体系中的不同温度、pH值,观察其对牦牛曲拉干酪素功能性质的影响。结果表明,牦牛曲拉干酪素中谷氨酸含量最高,必需氨基酸含量占总氨基酸含量的42%;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate -polyacrylamide gel electrophoresis, SDS-PAGE)测定结果表明,牦牛曲拉干酪素蛋白质的相对分子质量主要分布在25 000~37 000。用红外光谱分析检测得到-NH、C=O等特征官能团,用圆二色光谱鉴定得出,牦牛曲拉干酪素是无规则卷曲型蛋白质,其中α-螺旋占11.3%,β-折叠占26.8%,β-转角占23.3%,无规则卷曲占38.6%。研究结果还表明,牦牛曲拉干酪素的热稳定性较高,变性温度达到123 ℃左右。牦牛曲拉干酪素的主要功能特性如下:当温度接近50 ℃时,具有优良的溶解性、乳化性、发泡稳定性;在较高温度(50~70 ℃)下,持油性、发泡能力明显增强;在pH值为3~11条件下,除等电点(pH值=4.6)外,有较优良的功能特性;在中性条件下,干酪素溶液的表观黏度最大,最小凝胶含量最低。
关键词:牦牛;曲拉;干酪素;结构性质;功能性质
中图分类号:TS252.53文献标识码:A文章编号:1000-4440(2020)03-0709-11
Structural and functional properties of casein made from yak Qula
HE Lin-feng,CAI Li-sha,YANG Kuan,ZENG Zhen,LI Cheng
(College of Food Science, Sichuan Agricultural University, Yaan 625014, China)
Abstract:To characterize the structural and functional properties of casein made from yak Qula by complex rennin containing pepsin, chymopapain and yeast rennin, the basic components, amino acid composition, protein composition, infrared spectroscopy, circular dichroism and denaturation temperature of the casein were studied. Different temperatures and pH values in food processing system were simulated to observe the effects on functional characteristics of casein made from yak Qula. The results showed that the content of glutamic acid was highest in casein, and the content ratio of essential amino acids to total amino acids was 42%. The results of sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) indicated that the relative molecular weight of casein protein in yak gula mainly ranged from 25 000 to 37 000. The functional groups such as carbonyl and imino groups were detected by infrared spectrum analysis. The results of circular dichroism chromatography showed that casein was a kind of random coil protein, and it was found that the α-helix accounted for 11.3%, the β-fold accounted for 26.8%, the β-corner accounted for 23.3%, and the random coil accounted for 38.6%. In addition, casein showed high thermal stability with the denaturation temperature of 123 ℃. The main functional characteristics of casein made from yak Qula are as follows: the casein has excellent solubility, emulsification and foaming stability when the system temperature is close to 50 ℃; the oil-holding and foaming capacity of casein are significantly enhanced at relatively higher temperature(50-70 ℃); when the pH value was 3.0-11.0, except for the isoelectric point(pH=4.6), the casein has excellent functional properties; the rheological properties are optimal under neutral condition.
Key words:yak; Qula; casein; structural properties; functional properties
牦牛是在贫瘠的高原地区经过长期自然选择和适应后形成的一种特殊牛种,其分泌的乳汁中含有丰富的蛋白质、脂肪等,且含量显著高于其他牛种,这些营养成分对人体的生理活动都有非常重要的作用[1]。在牦牛乳中,酪蛋白含量高达34.28~45.79 g/L,约为普通牛乳的1.5倍,因而牦牛乳可作为优良的乳源应用到乳品加工中[2]。中国的牦牛主要生长在西藏、青海、新疆、四川、甘肃和云南6个省(区),数量达到了世界总数的94%。中国西部人民(本研究中主要指藏族)仅提炼牦牛乳的脂肪部分进行食用,而将脱脂牦牛乳在自然条件下经乳酸菌发酵产酸后凝固、结块、风干得到的产品曲拉并未被充分利用[3-4],造成大量优质动物蛋白质资源的浪费。干酪素又名酪蛋白,是一种性能独特的天然蛋白质基础原料,在国外主要以鲜乳为原料生产得到[5],而国内由于乳资源匮乏、成本高昂且在运输过程中容易造成鲜乳腐败变质,因此目前干酪素产业发展较慢,基本没有形成市场化[6]。以牦牛曲拉为原料,经碱溶脱脂、凝乳沉淀、干燥粉碎等工序,即可得到牦牛曲拉干酪素[7]。干酪素可以作为食品添加剂或品质改良剂广泛应用于食品、医药、轻工等领域。国外相关报道显示,干酪素的功能特性可以通过物理、化学手段得到提升[8],从而为进一步开发新型功能性干酪素提供了思路。目前,国内外关于牦牛的研究主要集中在牦牛群落、牦牛奶中细菌多样性方面,其副产品的开发和利用尚未见系统报道[9]。
本研究以牦牛曲拉干酪素为研究对象,对干酪素进行产品品质分析,包括基本成分测定、氨基酸组成测定、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)分析、红外光谱分析、圆二色光谱(Circular dichroism, CD)分析、热力学性质分析等,并模拟食品加工中的不同酸碱度、加热温度等条件,探索其对牦牛曲拉干酪素功能性质的影响,以期为用复合酶制备的牦牛曲拉干酪素在食品工业中的应用提供一定参考,从而扩大曲拉干酪素的应用范围,增加牦牛产业的附加值。
1材料与方法
1.1材料与试剂
曲拉,购自四川甘孜藏族自治州泸定县;小牛皱胃酶(酶活性≥20 000 U/g),购自美国Sigma-Aldrich科技公司;胃蛋白酶(酶活性≥800 000 U/g),购自上海瑞永生物科技有限公司;木瓜凝乳酶(酶活性≥20 000 U/g),购自广西庞博生物工程有限公司;酵母凝乳酶(酶活性≥60 000 U/g),购自DSM有限公司。
SDS-PAGE凝胶制备试剂盒、蛋白marker,购自美国Bio-Rad公司;NaOH、HCl、KBr、石油醚、乙醚,购自成都市科隆化学品有限公司;浓盐酸为优级纯,购自上海源叶生物科技有限公司;玉米油、大豆油,购自中粮国际(北京)有限公司四川分公司;试验用水为超纯水,由笔者所在实验室自制。
1.2仪器与设备
KDN-1全自动凯氏定氮仪,购自上海仪田精密仪器有限公司;Mini-PROTEAN Tetra电泳槽、Bio-Rad Powerpac Basic电泳仪,购自美国Bio-Rad公司;S433D全自动氨基酸分析仪,购自德国Sykam公司;NicoletIS10傅里叶变换红外光谱仪,购自赛默飞世尔科技(中国)有限公司;Chirascan-plus圓二色光谱仪,购自英国应用光物理公司;Q200MDSC差示扫描量热仪、DHR-1旋转流变仪,购自美国TA仪器[沃特世科技(上海)有限公司];RCD-1A高速均质乳化机,购自常州越新仪器制造有限公司;MICROMAX高速离心机,购自美国Thermo公司;V-1200可见分光光度计,购自上海美谱达仪器有限公司。
1.3试验方法
1.3.1牦牛曲拉干酪素的制备工艺流程:原料粉碎→碱液溶解→过滤→离心分离→巴氏杀菌→冷却→凝乳→洗涤→烘干→成品。
牦牛曲拉经42 ℃鼓风干燥后粉碎过筛,按照1∶11(g∶ml)的料液比加入蒸馏水后,缓缓滴加质量分数为16%的氢氧化钠溶液,于65 ℃水浴锅中搅拌溶解30 min,溶解后用100目滤布过滤除杂,于4 000 r/min离心20 min,倒出上清液,先用盐酸调节上清液的pH值至6.3,再添加1%复合酶(酶胃蛋白酶、木瓜凝乳酶、酵母凝乳酶的质量比为0.60∶0.18∶0.22),在复合酶添加量为1%、温度为45 ℃、凝乳时间为30 min、CaCl2添加量为1%(质量分数)的条件下凝乳,将所得凝乳水洗、脱水、造粒、干燥后备用[10]。
1.3.2牦牛曲拉干酪素基本成分的测定水分含量的测定参照GB5009.3-2016《食品中水分的测定》;脂肪含量的测定参照GB/T 5009.6-2016《食品中脂肪的测定》;蛋白质含量的测定参照GB 5009.5-2016《食品中蛋白质的测定》。
1.3.3牦牛曲拉干酪素中氨基酸组成的测定牦牛曲拉干酪素中氨基酸组成的测定参照GB5009.124-2016《食品中氨基酸的测定》,采用氨基酸自动分析仪进行测定;色氨酸含量的测定参照GB/T 15400-2018《饲料中色氨酸的测定》,采用分光光度法进行测定。
1.3.4十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析SDS-PAGE分析参考管方方等[11-12]的报道,并稍作改动。电泳样品的制备过程:称取0.2 g牦牛曲拉干酪素粉末于具塞三角瓶中,加入20 ml浓度为0.1 mol/L的NaOH溶液,水浴煮沸溶解,然后用0.1 mol/L样品缓冲液定容到100 ml。将制备好的样品和上样缓冲液混合,按照样品、缓冲液体积比为1∶1的比例配制成1 ml溶液后摇匀,用沸水浴加热5 min制得电泳样,于4 ℃冰箱保存备用。
SDS-PAGE分析所用12%分离胶和4%浓缩胶的配制方法参照试剂盒说明书。电泳条件:5 μl Marker上样量,10 μl样品上样量,保持150 V恒压至蛋白质染液进入分离胶,保持120 V恒压至蛋白质染液停在分离胶底部,关闭电源。电泳结束后,依次对电泳胶片进行固定、染色、脱色,然后用凝胶成像系统对凝胶进行拍照分析。
1.3.5傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析将2.0 mg牦牛曲拉干酪素粉末与预先干燥的0.2 g溴化钾混合研磨后压片,用NicoletIS10型傅里叶变换红外光谱仪测定红外光谱,扫描范围为400~4 000 cm-1,分辨率为4 cm-1,扫描次数为32次。
1.3.6圆二色光谱分析参考孔繁华等[13]的方法,用Chirascan-plus型圆二色光谱仪测定光谱,配制浓度为0.5 mg/ml的样品溶液,记录的光谱数据是3次样品扫描光谱数据各自减去缓冲光谱数据的平均值。测定参数如下:扫描波长为190~250 nm,扫描速率为100 nm/min,比色皿光径为1 mm,数据间隔为1.0 nm,带宽为2.0 nm,扫描次数为3次。
1.3.7差示扫描量热法(Differential scanning calorimetry,DSC)分析参考Wee等[14]的方法,对牦牛曲拉干酪素進行热变性分析。取10.0 mg样品于坩埚中密封,以空坩埚作为空白对照,置于Q200MDSC型差示扫描量热仪中,在温度为20~190 ℃、氮气流速为50 ml/min的条件下记录其热力学曲线。
1.3.8牦牛曲拉干酪素的功能性质分析参考胡涛等[15]的方法,将牦牛曲拉干酪素配制成质量浓度为1.0 mg/ml的溶液,在室温下低速搅拌3 h。分别移取100 ml 1.0 mg/ml牦牛曲拉干酪素溶液,在2 min内用浓度为1.0 mol/L的HCl或NaOH调节pH值至3~11,分别置于不同温度(40~80 ℃)的水浴中加热30 min,得到用不同条件处理的待测溶液。
1.3.8.1溶解性的测定参考Du等[16]的方法,将待测溶液分别离心(20 min、3 500 r/min),并在280 nm波长下测定上清液中的蛋白质含量,按照式(1)计算其溶解度:
溶解度=上清液中蛋白质含量总蛋白质含量×100%(1)
1.3.8.2乳化性的测定(1)乳化活力指数(Emulsifying activity index, EAI)及乳化稳定性(Emulsion stability, ES)的测定。参照Jiang等[17]的方法,分别取6 ml待测溶液加入离心管中,再加入2 ml玉米油,用高速均质机于20 000 r/min分散1 min,获得乳浊液,取50 μl乳浊液,加入5 ml质量浓度为0.1 g/L的SDS溶液,用涡旋混合仪混合5 s后,在500 nm处测定吸光度,记为A0;将乳浊液静置10 min后,再次测定吸光度,记为A10。EAI(m2/g)、ES(%)分别根据式(2)、式(3)进行计算:
式中,C为样品溶液的质量浓度(g/ml),θ为乳液中油相的体积比率,本研究中取0.25,A0为乳液静置0 s时的吸光度,A10为乳液静置10 min时的吸光度。
(2)乳化能力(Emulsion capacity, EC)的测定。参考Mir等[18]的方法测定牦牛曲拉干酪素的乳化能力。分别取20 ml待测溶液加入容量为250 ml的不同烧杯中,再分别加入20 ml玉米油,用高速均质机分散2 min后,将分散液转移至50 ml离心管中,于4 000 r/min离心10 min,立刻测量油层体积V0 (ml)。EC的计算公式如下:
1.3.8.3发泡性能的测定参考Lonchamp等[19]的方法并稍作修改,对牦牛曲拉干酪素样品的发泡性能进行评价。分别取20 ml待测溶液置于250 ml烧杯中,选用刀片式搅拌机,于20 000 r/min搅拌1 min,立即读出泡沫体积V1(ml),静置30 min后再次测量泡沫体积V2(ml),其发泡性(Foaming capability, FC)及发泡稳定性(Foaming stability, FS)分别按照式(5)、式(6)计算:
式中,V1为0 min时泡沫总体积,V2为30 min时泡沫总体积。
1.3.8.4持油性的测定参考Vioque等[20]的方法,称取质量为m0(0.5 g左右)的牦牛曲拉干酪素于离心管内,记录离心管和样品的质量为m1,接着加入少量大豆油,在涡旋混合仪上混合1 min后,再加入少许大豆油进行混合。分别在40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃水浴锅中反应30 min,冷却后于4 000 r/min离心20 min,弃去上层油,称取离心管和样品质量,记为m2。若没有出现油状物,则继续加油搅拌离心,直至出现少量大豆油为止。持油性按照式(7)计算:
持油性=m2-m1m0×100%(7)
1.3.8.5流变特性的测定(1)黏度的测定。将待测溶液分别置于烧杯中,在室温下用DHR-1型旋转流变仪进行牦牛曲拉干酪素溶液黏度的测定,采用“peak hold”模式,剪切速率为300 s -1,数据采集时间为120 s,锥板直径为40 mm,记录牦牛曲拉干酪素溶液在剪切速率为300 s-1时的表观黏度曲线。
(2)最小凝胶含量的测定。参照Mundi等[21]的方法并略作修改,测定牦牛曲拉干酪素的最小凝胶含量。称取不同质量的牦牛曲拉干酪素并分别溶于100 ml磷酸缓冲液中,配制成不同含量(10%~25%)的溶液,并用1.0 mol/L HCl或1.0 mol/L NaOH调节pH值至6.0、7.0、8.0、9.0、10.0、11.0。取5 ml溶液,在100 ℃水浴锅中反应1 h后用流动水使之冷却,并储存在4 ℃冰箱中过夜,使凝胶成形。牦牛曲拉干酪素的最小凝胶含量可以定义为把样品旋转后所形成的凝胶没有滑落或掉落时的最小样品含量。
1.3.9数据分析所有试验数据均为3次重复的结果,用Origin 9.1软件进行作图分析。
2结果与分析
2.1牦牛曲拉干酪素的基本成分
由表1可知,本试验制备的牦牛曲拉干酪素产品基本成分(脂肪、水分、蛋白质、酪蛋白)含量符合GB31638-2016《食品安全国家标准酪蛋白》的要求,表明该牦牛曲拉干酪素产品的质量较好,具有开发利用价值。
2.2牦牛曲拉干酪素的氨基酸组成
蛋白质的基本组成是氨基酸,因而蛋白质的品质在很大程度上取决于氨基酸的组成[22]。由表2可知,牦牛曲拉干酪素产品中的总氨基酸质量分数为83.44%,其中谷氨酸质量分数高达16.09%,总氨基酸中必需氨基酸占42.00%,可见氨基酸组成合理,必需氨基酸含量丰富。由于牦牛曲拉干酪素有较平衡的氨基酸组成,因此可以作为蛋白质类营养强化剂应用在食品工业中。
人体必需氨基酸用*标注,其中组氨酸(His)为婴儿必需氨基酸。
2.3牦牛曲拉干酪素的蛋白质组分
用SDS-PAGE分离出的谱带均为蛋白质的亚基谱带,如图1中的泳道2所示,在25 000~37 000相对分子质量范围内,电泳条带较深,说明检测产品的主成分为25 000~37 000大小的蛋白质,分别是α-酪蛋白、β-酪蛋白;在15 000~20 000相对分子质量范围内出现了颜色较浅的条带,分别是为κ-酪蛋白、γ-酪蛋白。α-酪蛋白、β-酪蛋白这个2个组分没有完全被分开的原因可能是由于该牦牛曲拉干酪素产品是经凝乳酶凝乳形成的,酪蛋白组分之间通过疏水键形成三维网状结构,并通过凝乳过程中加入的Ca2+的架桥作用形成凝乳,蛋白质组分之间存在交联作用,所以不能完全被分离[23]。李晓晖[24]研究酪蛋白分子的主要亚基组成发现,其主要成分为α-酪蛋白(含量约为75%)、β-酪蛋白(含量约为22%),其中α-酪蛋白的相对分子质量约为27 000,β-酪蛋白的相对分子质量约为24 000;其次为κ-酪蛋白、γ-酪蛋白(二者总含量约为3%)。此外,在该产品中未检测到明显的低相对分子质量(<14 000)蛋白质条带,说明该产品在制备过程中没有发生明显的水解作用,蛋白质没有被破坏,得到的产品纯度较高。
2.4牦牛曲拉干酪素的红外光谱分析
用傅里叶变换红外光谱仪对牦牛曲拉干酪素进行官能团检测分析。由图2可知,牦牛曲拉干酪素在3 649 cm-1附近有N-H的伸缩振动吸收峰;在2 963 cm-1附近有C-H的飽和振动吸收峰;在1 500~1 700 cm-1处为酰胺Ⅰ带和酰胺Ⅱ带的吸收谱区;在1 654 cm-1处的吸收峰是蛋白质R-CO-NH2中C=O的伸缩振动引起的典型吸收峰,其吸收峰强,表明此区域是酪蛋白分子二级结构发生变化的敏感区域;在1 536 cm-1附近有C-H弯曲振动吸收峰、C-N伸缩振动吸收峰,主要是由α-螺旋、β-折叠、β-转角及无规则卷曲效应相互叠加而出现的;在1 200~1 400 cm-1附近有酪蛋白分子酰胺Ⅲ带的特征吸收谱区,其吸收峰位于1 232 cm-1位置,符合酪蛋白的特征吸收规律。
2.5牦牛曲拉干酪素的圆二色光谱分析
远紫外(190~250 nm)CD常用来反映肽键的圆二色性,不同蛋白质所具有的二级结构或多肽所产生谱带的信息、吸收强弱均不同,由此可以反映蛋白质或多肽链的结构信息。由图3可知,牦牛曲拉干酪素的圆二色光谱曲线在195 nm附近形成1个负峰,在222 nm附近有1个不明显的肩峰,说明本酪蛋白胶束中的α-螺旋含量很低,属于无规则卷曲型蛋白质。许铭珠[25]在研究酪蛋白时也提出,酪蛋白是一种典型的无规则卷曲型蛋白质,与本研究结果一致。由CD-Pro软件计算结果可知,牦牛曲拉干酪素中的α-螺旋占11.3%,β-折叠占26.8%,β-转角占23.3%,无规则卷曲占38.6%,其中无规则卷曲比例最高,α-螺旋比例最低。
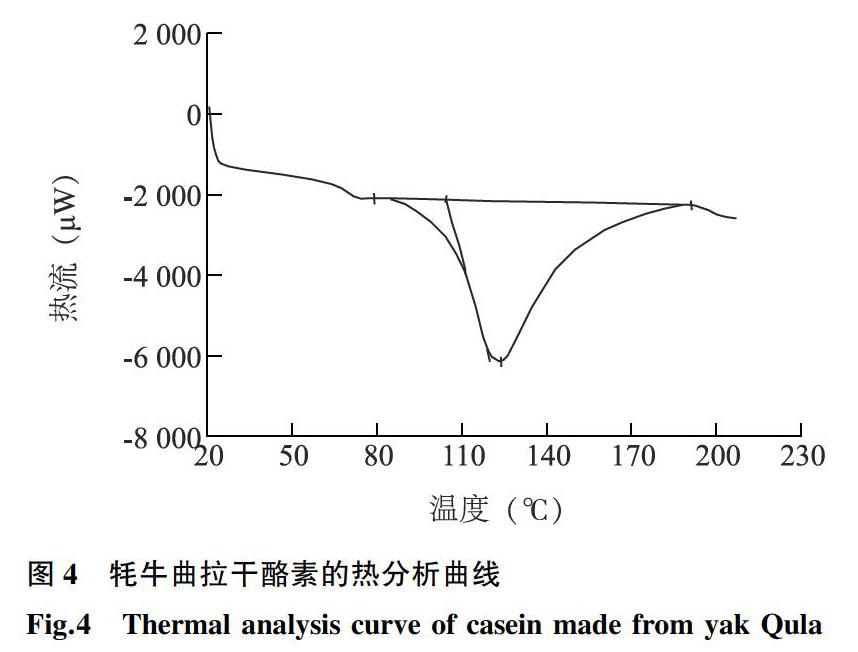
2.6牦牛曲拉干酪素的热变性
由于加热能够使蛋白质的结构发生变化而导致其功能受到影响,因此研究食品中蛋白质的热稳定性对于蛋白质的合理利用具有重要意义。蛋白质在加热过程中由于吸收了热量,分子会由有序状态转变为无序状态,多肽链因此展开,当达到蛋白质变性温度时,在热分析图谱上就会出现1个吸热峰,该峰值对应的温度即为该蛋白质的热变性温度,由峰面积便可以确定该蛋白质的变性热焓[26]。采用差示扫描量热仪对本研究中制备的牦牛曲拉干酪素进行热力学分析。从图4可以看出,牦牛曲拉干酪素热分析曲线在123 ℃附近出现1个主要的吸热峰,该温度可能是酪蛋白的变性温度,变性热焓值较大,为165.1 J/g,表明被测样品中未变性蛋白质的含量较高。由于蛋白质的稳定性与蛋白质变性温度的高低密切相关,变性温度越高,表明蛋白质的热稳定性越好。因此可见,该干酪素具有较好的热稳定性,可以应用到食品加工业中。
2.7牦牛曲拉干酪素的功能性质
2.7.1溶解性蛋白质的溶解度是重要的理化特性,常与其他功能特性如发泡能力和乳化特性相关[27]。由图5可以看出,在恒定的pH值条件下,当温度从40 ℃上升到60 ℃时,牦牛曲拉干酪素的溶解度整体上逐渐提高;当温度超过60 ℃时,牦牛曲拉干酪素的溶解度下降。随着温度的上升,会使蛋白质分子在水溶液中的构象展开,当分子内部亲水基团逐渐暴露时,蛋白质的溶解度就会提高。但是温度过高时,基团暴露得过多,基团间的相互作用会破坏肽键结构,蛋白质会因此发生聚集和沉淀,从而使溶解度下降。Chen等[28]通过研究温度对脱脂乳粉蛋白质溶解度的影响也得出了类似的结论。此外,由图5还可以看出,牦牛曲拉干酪素的溶解度与pH值之间呈现“V”形关系:当pH值接近等电点(pH值=4.6)时,牦牛曲拉干酪素有最低的溶解度,可能由于此时正负电荷的平衡降低了蛋白质分子之间的静电斥力,从而使得牦牛曲拉酪蛋白开始沉淀;当pH值远离等电点(pH值<4或>7)时,由于蛋白质所带的电荷增多,分子之间的静电斥力增大,从而使得牦牛曲拉干酪素的溶解度增加。Chee等[29]和Maria等[30]分别以大豆蛋白质和脱脂腰果壳中分离的蛋白质为原料,研究蛋白质溶解度与pH值之间的关系,其研究结果与本试验得出的结果类似。本研究所得牦牛曲拉干酪素的溶解特性与多种蛋白质类似。
2.7.2乳化性本研究测定了牦牛曲拉干酪素的乳化活力指数、乳化稳定性和乳化能力等乳化性指标。
由图6可知,在低温(40 ℃、50 ℃)下,随着温度升高,牦牛曲拉干酪素的EAI值基本不变;当温度在50 ℃以上且遠离等电点时,牦牛曲拉干酪素的EAI值变化较大,表现出随着温度的上升而急剧降低的趋势。可能是由于温度升高时,蛋白质的结构逐渐被破坏,从而导致乳化活性下降。由图7可知,随着温度的升高,牦牛曲拉干酪素的ES值整体上逐渐降低,但是降低幅度比EAI值低。Britten等[31]通过研究热处理对热变性乳清蛋白和天然乳清蛋白混合物EAI、ES值的影响,也得出了同样的结论。由图8可知,当温度达到80 ℃时,EC值极低,与较高温度对牦牛曲拉干酪素溶解性的影响类似,可能由于低温处理会提高蛋白质分子的柔性和亲水性,从而使得此时的乳化性较好。然而当温度过高时,蛋白质发生聚沉,能够参与到乳化作用中的有效分子减少,形成的蛋白质乳状液易黏结而分层。
此外,蛋白质的乳化性、乳化稳定性与蛋白质亲水、亲油基团的表面分布及分子柔性有关,不同的pH值会影响蛋白质疏水基团、亲水基团和表面电荷的分布和变化。由图7、图8可知,牦牛曲拉干酪素的乳化稳定性和乳化能力在等电点附近(pH值=4.6)最低,可能由于此时的溶解度最小,能够参与乳化的可溶性蛋白质较少;而在远离等电点(pH值<4或pH值>7)条件下,牦牛曲拉干酪素的乳化能力明显提高,在偏酸性(pH值=3)条件下,牦牛曲拉干酪素整体上具有最强的乳化稳定性。Zhao等[32]、Malomo等[33]分别通过研究pH值对花生蛋白质制品、大麻籽蛋白质粉乳化特性的影响也得出了类似结论。可见,根据不同需要适当调节酸碱度可提高牦牛曲拉干酪素的乳化能力和乳化稳定性。
2.7.3发泡性蛋白质的发泡能力受到蛋白质分子的扩散速率、界面张力大小、疏水基团的分布等因素影响,泡沫的稳定性则主要取决于蛋白质溶液的流变性质。由图9可知,牦牛曲拉干酪素溶液的发泡能力大致随着温度的上升而增大,原因可能是聚合的酪蛋白胶束通过降低界面张力,促进了泡沫膜的形成,从而提升了发泡性能;当温度升高到70 ℃后,发泡能力的整体变化不大。由图10可知,当温度为50 ℃时,牦牛曲拉干酪素溶液所形成泡沫的稳定性较高,可能由于此时溶液中的可溶性蛋白质含量较其他温度下有所增加,而可溶性蛋白质在混合体系中的乳化能力明显优于不溶性蛋白质;随着温度增加至50 ℃以上,泡沫稳定性下降的原因是热处理使其黏度增加,蛋白质分子间发生相互作用,从而导致泡沫不稳定。
由图9还可以看出,牦牛曲拉干酪素的发泡能力在等电点附近(pH值为4.6)最低,可能由于在等电点处酪蛋白发生沉淀,在聚合状态下扩散较慢,从而使得发泡性降低;当pH值为6时,发泡能力有下降的趋势,可能由于在此pH值条件下,牦牛曲拉干酪素的胶凝作用较明显,从而使得发泡性较低;当远离等电点(pH值<3或pH值>7)时,牦牛曲拉干酪素的发泡能力较好。Snchez等[34]研究蛋白质和纳米颗粒得到的结果也表明,由于pH值增加,界面压力、界面膨胀特性提高,蛋白质的发泡能力会提高。此外,在等电点附近(pH值为4.6)时,泡沫的稳定性较高(图10),可能由于此时界面上存在蛋白质-蛋白质的相互作用,会使体系表面形成黏稠的膜;而远离等电点时,泡沫的稳定性会降低。结合牦牛曲拉干酪素的乳化特性可知,在高pH值和高乳化稳定性下的牦牛曲拉干酪素有较高的发泡能力,Delgado等[35]在研究pH值对棉籽粕蛋白质功能特性的影响时也得到了同样的结论。
2.7.4持油性蛋白质的持油性是指蛋白质与游离油脂相结合的能力,在食品加工过程中能将油脂等风味物质截留在食物中[33]。由图11可知,在30~70 ℃,随着温度升高,牦牛曲拉干酪素的持油性在逐渐上升,可能由于蛋白质经过适当加热后,分子会逐渐发生解离,使得肽链伸展,此时蛋白质容易与油脂小分子结合,同时此温度下油脂的流动性较低,容易被蛋白质分子截留。随着温度上升到70 ℃,牦牛曲拉干酪素的持油性达到最大值,若继续升温,持油性则明显下降。任秀艳等[36]在研究加热对玉米胚芽粕蛋白质持油性的影响时也得到类似结论。此外,赵小龙等[37]研究指出,温度过高时,油脂的流动性明显加强,整个混合体系的黏度下降,会严重影响蛋白质的持油性。酪蛋白在70 ℃左右具有良好的持油性,可以作为一种潜在的功能性原料应用到模拟干酪和乳液型食物等高脂肪含量的产品中。
2.7.5牦牛曲拉干酪素的流变特性(1)黏性。蛋白质流体的黏度主要由蛋白质粒子的水合半径(也称为流体力学半径)决定。经过不同温度和酸碱度处理后,牦牛曲拉干酪素的黏度变化如图12所示。可以看出,牦牛曲拉干酪素溶液的表观黏度整体上随着温度的上升而逐渐减小,80 ℃时的黏度最低。酪蛋白分子是一种典型的无规则卷曲型蛋白质,它在分散溶液中是以伸展开的无规则团状结构形式存在的,它暴露出的亲水基团会与水分子形成氢键。随着体系温度的升高,氢键被破坏,蛋白质分子会经历从无规则线团状到无规则线团卷曲状的变化,此时的蛋白质分子流体力学体积变小,黏度减小。此外,分子热运动受到温度的影响较大,高温会减小体系的流动阻力,体系的剪切黏度也会随之下降。
由图12还可以看出,当pH值为7时,表观黏度较大,可能是由于中性环境中的静电斥力较弱,分子间的结合紧密,而当溶液偏碱(pH值>7)时,蛋白质电荷会大量暴露,部分温度下溶液的表观黏度呈现下降趋势。De Almeida等[38]在研究pH值对蛋白质流变特性的影响时也得出类似的结论。可见,当牦牛曲拉干酪素作为食品原料或食品添加剂时,可以通过控制溶液的酸碱度、温度来控制黏度。
(2)最小凝胶含量。蛋白质的最小凝胶含量可以用来表征蛋白质的成胶能力。如表3所示,在酸碱度为中性条件下,牦牛曲拉干酪素的最小凝胶含量最低,为12%±0.15%,可能是由于此时的正负电荷平衡降低了蛋白质之间的斥力,从而增强了蛋白质凝胶的形成能力,该结果与Tan等[39]研究得到的大豆蛋白质在中性条件下的最小凝胶含量(12%)接近,说明酪蛋白与大豆蛋白质有相似的热稳定性。在偏碱性(pH值>9)条件下,牦牛曲拉干酪素的最小凝胶含量较高,可能由于蛋白质在碱性条件下溶解性较好,蛋白质与蛋白质之间的相互作用增强,从而减弱了蛋白质凝胶的形成能力。
3结论
本研究用复合酶制备得到牦牛曲拉干酪素,该干酪素的蛋白质含量为86.64%±1.09%,其中酪蛋白含量占总蛋白含量的96.72%±1.14%,蛋白质亚基的相对分子质量主要分布在25 000~37 000,变性温度达到123 ℃左右。在牦牛曲拉干酪素的二级结构中,α-螺旋占11.3%,β-折叠占26.8%,β-转角占23.3%,无规则卷曲占38.6%。红外光谱分析结果显示,牦牛曲拉干酪素具有-NH、C=O等特征官能团,表明该干酪素产品的纯度较高,品质较好,热稳定性较高,保留了天然酪蛋白的胶束结构,为进一步将其应用在食品加工领域、拓宽其应用范围奠定了基础。
通过对不同温度、酸碱度条件下牦牛曲拉干酪素产品的功能特性研究发现,当温度为50 ℃时,牦牛曲拉干酪素的溶解度较高,乳化稳定性及发泡稳定性较好;当温度为70 ℃时,牦牛曲拉干酪素的持油性最佳,发泡能力增强。在等电点附近时,牦牛曲拉干酪素的发泡稳定性最高;远离等电点时,牦牛曲拉干酪素的溶解度、乳化性能、发泡性能较好,特别是在中性条件下,牦牛曲拉干酪素的表观黏度较大,最小凝胶含量最低。因此可见,在食品加工生产中,可以通过改变酸碱度、加热温度等条件来获得具有良好加工性质的牦牛曲拉干酪素,从而充分利用牦牛曲拉资源,发展牧区经济,增加牧民收入,最终实现良好的经济效益。
参考文献:
[1]LI H L, YANG C, CHEN C, et al. The use of trisodium citrate to improve the textural properties of acid-induced, transglutaminase-treated micellar casein gels[J]. Molecules, 2018, 23(7): 1632.
[2]EI-BAKRY M, DUGGAN E, ORIORDAN E D, et a1. Effect of chelating salt type on casein hydration and fat emulsification during manufacture and post-manufacture functionality of imitation cheese[J]. Journal of Food Engineering, 2011, 102(2): 145-153.
[3]王耀杰. 牦牛乳酪蛋白胶束理化性质的研究[D]. 兰州:甘肃农业大学,2013.
[4]MOSCHOPOULOU E. Characteristics of rennet and other enzymes from small ruminants used in cheese production[J]. Small Ruminant Research, 2011, 101(1/2/3): 188-195.
[5]王琳琳,韩玲,敏文祥,等. 干酪素加工工艺研究进展[J]. 食品与发酵工业,2016,42(5):277-282.
[6]李凤林,兰文峰. 乳与乳制品加工技术[M]. 北京:中国轻工业出版社,2010: 240-243.
[7]HOLT C, CARVER J A, ECROYD H, et al. Invited review: caseins and the casein micelle: their biological functions, structures, and behavior in foods[J]. Journal of Dairy Science, 2013, 96(10): 6127-6146.
[8]CARTER B, PATEL H, BARBANO D M, et al. The effect of spray drying on the difference in flavor and functional properties of liquid and dried whey proteins, milk proteins, and micellar casein concentrates[J]. Journal of Dairy Science, 2018, 101(5):3900-3909.
[9]YAN Z, YINGYING C, MIN Y, et al. Bacterial diversity and community in Qula from the Qinghai-Tibetan Plateau in China[J]. Peer J, 2018, 6: 6044.
[10]何林楓,李燕涛,李诚,等. 混料设计优化牦牛“曲拉”凝乳酶干酪素的工艺及产品的性质分析[J]. 食品与发酵工业,2020,46(6):172-179.
[11]管方方. 牛乳中掺假大豆蛋白的SDS-PAGE方法研究[D]. 上海:上海应用技术学院,2015.
[12]李林强,朱莉莉,万威,等. 牛羊乳热处理蛋白质变性程度比较及机理分析[J]. 西北农林科技大学学报(自然科学版),2016,44(11):149-154,160.
[13]孔繁华,曹雪妍,康世墨,等. 基于多重光谱技术的木糖醇与牛乳酪蛋白相互作用及对酪蛋白结构的影响[J]. 食品科学,2019,40(16):75-82.
[14]WEE M S M, LOUD D E, TAN V W K, et al. Physical and sensory characterisation of noodles with added native and denatured pea protein isolate[J]. Food Chemistry, 2019, 294: 152-159.
[15]胡濤,丁波,顾利,等. 曲拉制酪蛋白酸钠的工艺研究及功能性评价[J]. 食品工业科技,2019,40(19):61-66.
[16]DU M X, XIE J H, GONG B, et al. Extraction, physicochemical characteristics and functional properties of Mung bean protein[J]. Food Hydrocolloids, 2018, 76: 131-140.
[17]JIANG S J, ZHAO X H. Transglutaminase-induced cross-linking and glucosamine conjugation of casein and some functional properties of the modified product[J]. International Dairy Journal,2011, 21(4): 198-205.
[18]MIR N A, RIAR C S, SINGH S. Effect of pH and holding time on the characteristics of protein isolates from Chenopodium seeds and study of their amino acid profile and scoring[J]. Food chemistry, 2019, 272: 165-173.
[19]LONCHAMP J, CLEGG P S, EUSTON S. Foaming, emulsifying and rheological properties of extracts from a co-product of the Quorn fermentation process[J]. European Food Research and Technology, 2019, 245(9): 1825-1839.
[20]VIOQUE J, SNCHEZ-VIOQUE R, CLEMENTE A, et al. Partially hydrolyzed rapeseed protein isolates with improved functional properties[J]. Journal of the American Oil Chemists Society, 2000, 77(4): 447-450.
[21]MUNDI S, ALUKO R E. Physicochemical and functional properties of kidney bean albumin and globulin protein fractions[J]. Food Research International, 2012, 48(1): 299-306.
[22]SELLE Y D, MOSS P H, WANG A F, et al. Influence of starch sources and dietary protein levels on intestinal functionality and intestinal mucosal amino acids catabolism in broiler chickens[J]. Journal of Animal Science and Biotechnology, 2019, 10(3): 658-672.
[23]SANDRA S M, ALEXANDER M, DALGLEISH D G. The rennet coagulation mechanism of skim milk as observed by transmission diffusing wave spectroscopy[J]. Journal of Colloid and Interface Science, 2013, 308(2): 364-373.
[24]李晓晖. 牛乳中酪蛋白的结构特性及其应用[J]. 食品工业,2001(1):29-31.
[25]许铭珠. 葡萄皮花青素提取物与蛋白质的相互作用及其对色素稳定性的影响[D]. 无锡:江南大学,2015.
[26]PRUCHNIK H, BONARSKA-KUJAWA D, Z·YLKA R, et al. Application of the DSC and spectroscopy methods in the analysis of the protective effect of extracts from the blueberry fruit of the genus Vaccinium in relation to the lipid membrane[J]. Journal of Thermal Analysis and Calorimetry, 2018, 134(1): 679-689.
[27]CHEN W J, LV R L, WANG W J, et al. Time effect on structural and functional properties of whey protein isolate-gum acacia conjugates prepared via Maillard reaction[J]. Journal of the Science of Food and Agriculture, 2019, 99(10): 4801-4807.
[28]CHEN C, MICHAEL M, PHEBUS R K, et al. Short communication: radio frequency dielectric heating of nonfat dry milk affects solubility and whey protein nitrogen index[J]. Journal of Dairy Science, 2013, 96(3): 1471-1476.
[29]CHEE K L, LING H K, AYOB M K. Optimization of trypsin-assisted extraction, physic-chemical characterization, nutritional qualities and functionalities of palm kernel cake protein[J]. LWT-Food Science and Technology, 2012, 46(2): 419-427.
[30]MARIA Y, CHI T T, LIEN H H, et al. Isolation and characterization of protein isolated from defatted cashew nut shell: influence of pH and NaCl on solubility and functional properties[J]. LWT-Food Science and Technology, 2014, 55(2): 621-626.
[31]BRITTEN M, GIROUX H J, JEAN Y, et al. Composite blends from heat-denatured and undenatured whey protein: emulsifying properties[J]. International Dairy Journal, 1994, 4(1): 25-36.
[32]ZHAO Q, XIONG H, SELOMULYA C, et al. Effects of spray drying and freeze drying on the properties of protein isolate from rice dreg protein[J]. Food and Bioprocess Technology, 2013, 6(7): 1759-1769.
[33]MALOMO S A, ALUKO R E. Conversion of a low protein hemp seed meal into a functional protein concentrate through enzymatic digestion of fibre coupled with membrane ultrafiltration[J]. Innovative Food Science and Emerging Technologies, 2015, 31: 151-159.
[34]SNCHEZ C S, PATINO J M R. Interfacial, foaming and emulsifying characteristics of sodium caseinate as influenced by protein concentration in solution[J]. Food Hydrocolloids, 2005, 19(3): 407- 416.
[35]DELGADO E,VALVERDE-QUIROZ L, LOPEZ D, et al. Characterization of soluble glandless cottonseed meal proteins based on electrophoresis, functional properties, and microscopic structure[J]. Journal of Food Science, 2019, 84(10): 2820-2830.
[36]任秀艷,王孟云,曹戈,等. 玉米胚芽粕蛋白功能特性研究[J]. 食品科技,2014,39(6):187-192.
[37]赵小龙,刘大川. 棉籽分离蛋白的功能特性研究[J]. 中国油脂,2015,40(1):27-30.
[38]DE ALMEIDA N M, DE MOURA BELL J M L N, JOHNSON L A. Properties of protein produced by countercurrent, two-stage, enzyme-assisted aqueous extraction[J]. Journal of the American Oil Chemists Society, 2014, 91(6): 1077-1085.
[39]TAN E S, YING-YUAN N, GAN C Y. A comparative study of physicochemical characteristics and functionalities of pinto bean protein isolate (PBPI) against the soybean protein isolate (SPI) after the extraction optimisation[J]. Food Chemistry, 2014, 152: 447-455.
(责任编辑:徐艳)
