生物质废弃物发酵过程中菌群多样性及秸秆降解菌的筛选
2020-07-23尹萌孙寓姣李洁徐上崴赵娟娟
尹萌 孙寓姣 李洁 徐上崴 赵娟娟

摘要:利用16s rRNA高通量测序技术研究了生物质废弃物玉米秸秆、畜禽粪便、活性污泥混合物在不同氧含量条件下发酵过程中微生物的群落特征变化,同时采用选择培养基筛选对秸秆具有降解能力的菌株,以寻找能在秸秆还田中具有较大应用潜力的菌种资源。高通量测序结果表明:在秸秆、畜禽粪便、污泥共发酵体系中,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)占据绝对优势,不同氧含量堆肥条件下发酵体系营养结构、微生物群落结构不同,氧含量较低的条件更有利于秸秆的降解。通过纯培养方式得到的目的菌株对玉米秸秆降解效率最高可达28.9%,初步被确定为厚壁菌门中芽孢杆菌属(Bacillus),进一步证明结合高通量测序结果快速选择生物质废弃物发酵体系中秸秆降解菌具有可行性。
关键词:微生物群落;联合发酵;秸秆降解;生物质废弃物
中图分类号:S141.4文献标识码:A文章编号:1000-4440(2020)03-0591-08
Microbial diversity and screening of straw-degrading bacteria in different fermentation processes of biomass waste
YIN Meng,SUN Yu-jiao,LI Jie,XU Shang-wei,ZHAO Juan-juan
(College of Water Science, Beijing Normal University, Beijing 100875, China)
Abstract:The 16s rRNA high-throughput sequencing technology was used to study the characteristics of microbial communities during the co-fermentation of corn straw, livestock manure and sludge under different oxygen conditions. In order to find the strains with great potential in the return of straw to the field a selection medium was used to quickly screen the strains which could degrade straw. The results of high-throughput sequencing showed that Firmicutes, Bacteroidetes and Proteobacteria occupied absolute advantages in the co-fermentation system of straw, livestock manure and sludge. The nutrient structure and microbial community structure in fermentation system were different under different compositing conditions, and the condition of low oxygen content was more conducive to the degradation of straw. The highest degradation efficiency of target strain obtained by pure culture method was 28.9%, and the strain could be initially identified as Bacillus in the Firmicutes phylum. These results proved that it was feasible to select straw-degrading bacteria in co-fermentation system by combining high-throughput sequencing results.
Key words:microbial community;combined fermentation;straw degradation;biomass waste
畜禽糞便中含有大量的营养物质和丰富的矿物质,但当前中国大多数畜牧养殖场对于畜禽粪便废弃物缺乏有效的处理方法。污染源普查数据显示,全国畜禽粪便产生量由2010年的3.252×109 t上涨至2017年的3.818×109 t,但其综合利用效率仍不足60% [1]。堆肥等常见的畜禽粪便处理方式存在处理不彻底、效率低等缺点,而多项研究结果表明秸秆与粪便联合发酵可以改善发酵底物的C/N比,使发酵体系更为稳定、高效[2-3]。
污水处理厂污泥产量大,处理费用高[4]。同时活性污泥中含有大量有机质[5],因此常作为发酵底物。但堆肥污泥存在含水率高、透气性差、碳氮比低等问题,而作物秸秆凭借有机营养丰富、碳氮比含量高的特点[6],可以作为调理剂为污泥消化提供良好环境。Meng等研究结果表明污泥、蘑菇渣、小麦秸秆共堆肥不仅能提高有机质的降解率和堆肥产品的质量,而且还能促进氨的吸收,减少氨的排放[7]。
2018年中国粮食总产量超过6.57×108 t,而作物秸秆产量约为1.04×109 t,占全世界秸秆总产量的20%~30%[8]。其中,纤维素、半纤维素和木质素3种有机化合物占秸秆总固体物的80%以上[9]。由于秸秆具有复杂高能氢键晶体结构,自然情况下难以降解,成为其资源化利用的技术瓶颈,结合生物技术实现秸秆高效降解成为近些年来的研究重点。高速发展的第2代高通量测序技术可直接对混合微生物样品进行快速测序,成为解析复杂环境中微生物群落结构的重要工具[9]。Meng等[10]研究了牛粪与玉米秸秆堆肥过程中微生物群落的动态变化,Chen等[11]研究了长期秸秆还田条件下土壤细菌群落的变化。
利用玉米秸秆、畜禽粪便、活性污泥联合发酵,一方面能提高畜禽粪便、活性污泥发酵效率,解决其对环境的危害,减少其对土地资源的占用,另一方面可加快玉米秸秆腐解,促进其再生利用。生态环境中自然因素、人为因素等都会引起土壤微生物群落结构的变化,因此了解秸秆等生物质废弃物联合发酵过程中微生物群落结构的变化,对于改善农业生产、巩固生态系统稳定性等具有重要实践意义[12]。本试验以玉米秸秆、畜禽粪便、活性污泥为底物,借助高通量测序等微生物群落分析核心技术,探究不同氧含量下联合发酵过程中微生物的群落特征变化,并强化可培养菌群,通过分离培养方式筛选玉米秸秆降解菌,与新一代测序分析方法结合探究其发酵过程微生物群落结构改变与秸秆降解之间规律,为秸秆资源化、生物质废弃物再生利用提供理论依据,同时为秸秆还田再利用提供菌种资源。
1材料与方法
1.1材料
1.1.1玉米秸秆、畜禽粪便与活性污泥玉米秸秆晒干后经破碎机打碎使其粒径小于10 mm。新鲜牛粪样品、发酵1年后的牛粪土壤混合物采集于河北省某养牛场。冻存的猪粪采集于北京某养猪场。活性污泥样品采集于北京市某中水站曝气反应阶段,污泥取回后静置一段时间,倒去上清液后置于4 ℃冰箱中保存备用。
1.1.2培养基秸秆粉选择培养基:秸秆粉 5.00 g,MgSO4·7H2O 0. 50 g,KCl 0. 50 g,Na2HPO4 1.80 g,KH2PO4 0.30 g,NaCl 5.00 g,琼脂粉15.00 g,定容至1 000 ml,pH 7~8。LB培养基:NaCl 10.00 g,胰蛋白胨10.00 g,酵母提取物5.00 g,定容至1 000 ml,用于菌种分离后的富集生长。无机培养液:MgSO4·7H2O 0.50 g,KCl 0.50 g,Na2HPO4 1.80 g,KH2PO4 0.30 g,NaCl 5.00 g,定容至1 000 ml,pH 7~8。
1.2试验装置与方法
1.2.1试验装置试验装置为自制发酵罐(图1)。发酵罐上层与空气接触良好,氧气含量充足;中层与空气接触受到阻碍,氧气含量低,可以满足兼性厌氧菌或好氧菌的生长;底层难以与空气接触,氧气含量极低。取新鲜牛粪、发酵1年后的牛粪土壤混合物、少量冻存的猪粪与中水站污泥(未脱水)按体积比1∶1∶1∶1混合,取与上述泥粪混合物相同体积的玉米秸秆与之混合后置于15 cm×15 cm×30 cm的发酵罐中,发酵处理21 d后从发酵罐上、中、下层出口处取样。此外,将10.00 g发酵罐中泥粪混合物与1.00 g秸秆粉放入2个250 ml的锥形瓶中,加入超纯水定容至200 ml,作为强化可培养菌体系,记为A、B两组。
1.2.2微生物多样性分析分别对猪粪(记为X1)、发酵罐上、中、下层发酵21 d后的样品(分别记为X2、X3、X4)、发酵罐中发酵前样品(记为X5)、强化可培养体系摇瓶培养15 d后的样品(A组记为X6、B组记为X7)的微生物群落进行分析。利用CTAB法抽提土壤基因组DNA,将纯化的DNA进行PCR扩增,扩增产物用于DNA测序,测序样品通过TruSeq DNA kit(Illumina,美国)进行文库构建,采用Illumina Miseq 测序平台检测16S rDNA的V3V4高变区,所用引物序列为338F:5′-ACTCCTACGGGAGGCAGCA-3′和806R:5′- GGACTACHVGGGTWTCTAAT-3′。随后通过生物信息学方法进行序列分析和物种注释,了解样品微生物群落组成情况,利用Observed species 指数和Chao1 指数表征群落中物种的数量,利用Shannon 指数、Simpson 指数综合评估群落中物种的丰富度和均匀度,通过多样性分析进一步比较样品之间的差异性。
1.2.3菌种分离培养设置A、B两组强化可培养体系,更好地评价可培养菌群系统群落结构稳定性。与A组相比,B组加入1 ml可更好地发挥系统中各类微生物效果的EM菌剂,分别加水定容至200 ml,置于磁力搅拌器上搅拌。摇瓶培养15 d后取A组上清液进行逐级稀释,将稀释了104、105、106倍后的样品涂布于选择培养基上,将培养皿倒置放入恒温生化培养箱中,34 ℃恒温培养72 h后取出培养皿观察菌落生长情况。选择部分单菌落进行划线培养,同时接入LB液体培养基中进行扩大培养。
1.2.4目的菌种分析鉴定以所得秸秆降解目的菌DNA为模板进行PCR反应。PCR反应体系:20~30 ng/μl模板1.5 μl,10 pmol/μl上、下游引物各1.0 μl,2×Master Mix 12.5 μl,ddH2O 9.0 μl。反應条件为:95 ℃预变性5 min;94 ℃变性30 s;60 ℃退火30 s;72 ℃延伸1 min;设置30个循环;72 ℃后保温5 min。所用引物为通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和 1492R: 5′-GGCTACCTTGTT ACGACT T-3′。反应结束后产物用1%琼脂糖凝胶检测,测序。登录NCBI网站,利用Blast程序将测得数据与数据库中的所有序列进行比较分析。
1.2.5秸秆粉降解率测定称取1.00 g玉米秸秆粉(直径2 mm)置于40 ml无机培养液中,加入4 ml扩大培养所得菌液,对照组不加菌液,室温下150 r/min摇床培养5 d。离心弃去上清液,用蒸馏水反复清洗3次,每次清洗后离心弃去上清液[13]。60 ℃恒温烘干至恒质量,称质量精确至0.01 g,通过质量差计算菌液对秸秆粉的降解能力。
2结果与分析
2.1生物质废弃物不同发酵条件下微生物多样性变化
为揭示秸秆、畜禽粪便、活性污泥联合发酵过程中微生物的演替规律,分别对发酵罐上、中、下层发酵21 d后的样品、发酵罐中发酵前样品、强化可培养菌系统摇瓶培养15 d后的样品微生物群落进行分析,利用高通量测序分析方法分析生物质废弃物联合发酵过程中群落结构改变与秸秆降解之间的规律。
稀释曲线可比较测序数量不同的样本中物种的丰度,说明样本的测序数据是否合理。稀释曲线(图2)显示,随着样品序列数增加曲线逐渐趋于平缓,说明各样品OUT(操作分类单元)覆盖度已趋于饱和,测序深度足以检测到各样品中优势微生物。
X1为猪粪样品,X2、X3、X4分别为发酵罐上、中、下层发酵21 d后的样品,X5为发酵罐中发酵前样品,X6、X7分别为A组、B组摇瓶培养15 d后的样品。
发酵过程中氧含量不同使得生物质废弃物联合发酵体系中微生物多样性指数发生不同程度的变化(表1)。发酵罐中层样品(X3)Shannon指数为6.012,显著高于发酵前样品(X5),说明发酵罐中层氧气含量较低的环境对细菌多样性的促进作用较强,可有效增强生态系统稳定性。而在氧含量充足(X2)及缺氧条件(X4)下,其Shannon 指数分别为5.135、4.738,说明富氧及缺氧条件对发酵体系中细菌多样性有所抑制。Simpson指数等变化趋势也同时表明发酵过程中氧气含量的不同会导致发酵体系中细菌多样性发生变化,低氧条件更有利于发酵体系中细菌群落稳定性的维持。有研究结果表明,发酵体系中氧含量不同,发酵方式不同,功能微生物也不同[14-15]。
各样品见图2注。
不同氧含量条件下秸秆等生物质废弃物联合发酵各样品的OTU分布图(图3)显示,与发酵前样品(X5)相比,X4样品的重叠OUT数最高,与发酵前样品有更高的相似性;X3样品的独有OUT数最高,这表明当玉米秸秆、畜禽粪便、活性污泥在低氧含量条件下联合发酵会产生较多新的细菌群落。
样品X2、X3、X4、X5见图2注。
2.2不同发酵条件对细菌群落结构的影响
利用Illumina Miseq 测序平台对7个样品的细菌群落结构进行分析,共检测到154 420条有效序列,4 617个OUT,得到的细菌有33个门类,65个纲,94个目,162个科,260个属。同时选取相对丰度在1%(默认值)以上的物种绘制物种相对丰度分布图,在门和科的分类学水平上对细菌群落组成进行分析。
图4为秸秆等生物质废弃物在不同氧含量条件下联合发酵样品细菌在门分类学水平下的分类,其中拟杆菌门(Bacteroidetes)在各样品中所占比例为3.81%~54.24%,厚壁菌门(Firmicutes)为7.30%~65.88%,变形菌门(Proteobacteria)为4.53%~49.52%,放线菌门(Actinobacteria)为0.31%~15.00%,这与杜洋[8]的研究结果相似。与发酵前样品(X1、X5)相比,秸秆、畜禽粪便、活性污泥联合发酵21 d后的样品细菌群落结构发生明显改变, 其中Bacteroidetes、Firmicutes、Proteobacteria占据了绝对优势,相对丰度总量占细菌界总量的84%以上,这是因为其对碳水化合物、蛋白质等复杂有机物具有水解、酸化能力[16]。不同氧含量下秸秆等生物质废弃物联合发酵样品群落结构变化各不相同,发酵罐底层氧气含量极低的条件下样品与发酵前样品相比细菌群落结构变化并不显著,其余各试验组Proteobacteria相对丰度49.51%(X2)、37.03%(X3)、36.10%(X6)、29.35%(X7)均高于发酵前样品(X5),Proteobacteria细菌为细菌界中最大的一门,均为革兰氏阴性菌,各成员代谢类型不同,对有机物的去除具有很大作用[17]。与发酵前样品相比,发酵罐中层样品(X3)、2组强化可培养菌系统样品(X6、X7)中Bacteroidetes相对丰度显著提高。已有研究结果表明Bacteroidetes细菌在发酵过程中利用周围环境中的物质生长,Bacteroidetes 作为多种厌氧消化反应器中的一种优势菌门,对纤维素、碳水化合物和半纤维素及其他多糖物质等均具有一定的降解能力[18-19]。唐涛涛等[20]研究结果表明Bacteroidetes相对丰度随秸秆添加量的增加而增加。贾洋洋[15]将玉米秸秆堆成大堆发酵,发现在表层下60~80 cm处环境基本满足好氧或兼性厌氧菌的生长,为秸秆降解的主要位置。Bacteroidetes相对丰度明显与其他生境明显不同,证明Bacteroidetes与秸秆降解息息相关,也说明氧含量较低的条件更有利于本研究发酵底物中玉米秸秆的降解。而Firmicutes细胞壁中肽聚糖质量浓度高,大多可产生芽孢,借以抵抗脱水和极端环境,因此成为发酵初期主要优势菌门。Firmicutes中芽孢杆菌纲细菌可形成抗逆性极强的芽孢,具有较强的环境适应性,在环保、工业、农业等领域中具有重要作用[17]。同时Firmicutes细菌能够降解蛋白质、纤维素等大分子化合物,可协助Bacteroidetes降解秸稈中富含的纤维素[21-22]。富氧条件模拟好氧堆肥情况,与其他试验组相比,富氧条件下Actinobacteria相对丰度显著提高,进一步表明氧含量不同是造成发酵过程中微生物群落结构差异的重要原因之一。
为深入了解不同氧含量对秸秆、畜禽粪便、活性污泥联合发酵微生物群落结构的影响,在科分类学水平上对细菌群落组成进行分析。结果(图5)表明优势菌科包括梭菌科(Clostridiaceae,2.54%~41.20%)、卟啉单胞菌科(Porphyromonadaceae,0.20%~29.32%)、芽孢杆菌科(Bacillaceae,0.10%~1.08%)、假单胞菌科(Pseudomonadaceae,0.35%~8.97%)等。不同含氧量下底物发酵后微生物群落结构显著不同,发酵罐中层及两组强化可培养系统中Porphyromonadaceae丰度明显增加。王春芳等[23]从堆肥中富集得到的2组秸秆降解菌系共有的优势物种之一为Porphyromonadaceae,并确定其有秸秆降解能力。匡小珠等[24]在农业废弃物秸秆厌氧降解研究过程中同样分离得到1株Porphyromonadaceae细菌,进一步说明这种含氧条件下秸秆等底物共发酵更有利于玉米秸秆的降解。除此之外,还有一些微生物存在于发酵体系中,如Clostridiaceae,该种群具有较普遍的纤维素分解能力[25],是降解秸秆纤维素的重要微生物资源,其产生的纤维素酶将各组分聚集在一起,形成纤维小体[23],因此这些微生物的存在也有利于秸秆纤维的降解。
各样品见图2注。
各样品见图2注。
图6显示,不同氧含量下秸秆等生物质废弃物发酵对细菌群落结构产生不同影响,形成各不相同的优势菌属,比如,与发酵前样品(X5)相比,在氧含量充足的条件(X2)下Acinetobacter相对丰度增长显著,由5.60%增长至22.64%。研究者曾以水稻秸秆为唯一碳营养源进行秸秆降解菌群的筛选,发现Arthrobacter细菌能够合成分泌纤维素酶以及木质素酶以促进木质纤维素的降解[26]。而在氧气含量较低的条件(X3)下Sphingopyxis相对丰度有所增加;在基本无氧条件(X4)下Carnobacterium、Enterococcus等相对丰度变化明显,分别由1.7.%、0.27%增长至12.83%、4.01%。Enterococcus属于好氧细菌,能消耗利用可溶性碳水化合物等营养成分引起秸秆腐败变质[27]。显然,秸秆等生物质废弃物联合发酵一方面有利于微生物种类、总体数量的增加,另一方面可提高与秸秆降解相关的菌种含量,但不同处理方式下微生物优势种属各不相同。在OUT水平下的主坐标分析结果(图7)表明,基本无氧条件下的样品(X4)与发酵前样品(X5)群落结构更为相近,而氧含量充足的条件(X2)及氧气含量较低的条件(X3)下群落结构变化更为显著,验证了不同氧含量下秸秆等生物质废弃物联合发酵对细菌群落结构产生不同影响。
X1~X7各样品见图2注。
X1~X7各样品见图2注。
2.3功能菌种的鉴定及其对秸秆降解效果
在秸秆粉选择培养基上初步分离得到4株秸秆降解菌。对其16S rRNA序列进行测定,将其与NCBI数据库中的所有序列进行比对,比对结果如表2所示。
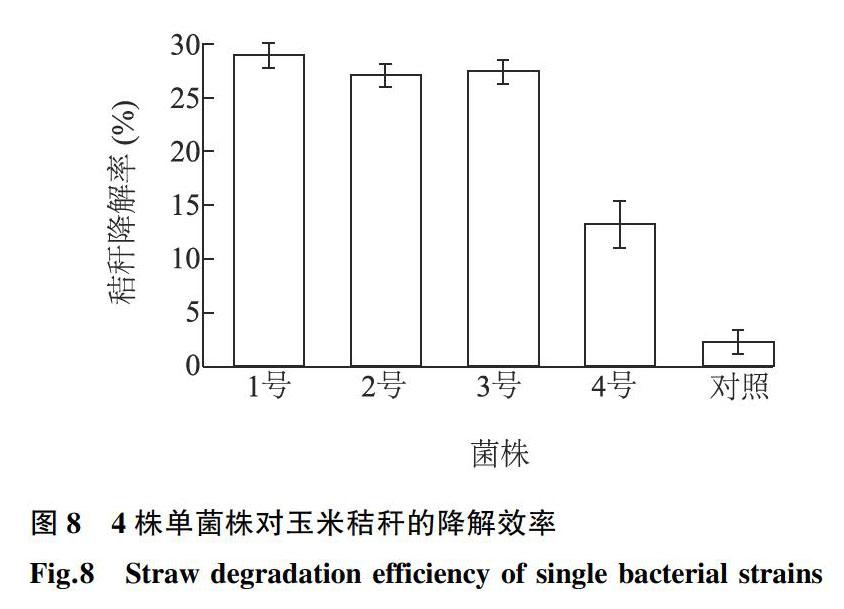
常温下,以玉米秸秆为唯一碳源,以10%的接种量将生长至对数生长期的菌液接种至灭菌无机培养液中培养5 d,采用差减法测定菌液对秸秆的降解效率。结果(图8)表明,从强化可培养体系中驯化分离所得4株菌株对玉米秸秆均有明显降解效果,其中Bacillus amyloliquefaciens对玉米秸秆的降解率达到28.9%,明显优于王加友等[28]分离得到的SY-403菌株。原因可能是该菌株可以产生半纤维素酶、木质素过氧化物酶、纤维素酶等秸秆降解酶,通过断裂秸秆中木质素单体之间的连接键,使其成为小分子芳香族化合物等[29]。
图84株单菌株对玉米秸秆的降解效率
Fig.8Straw degradation efficiency of single bacterial strains
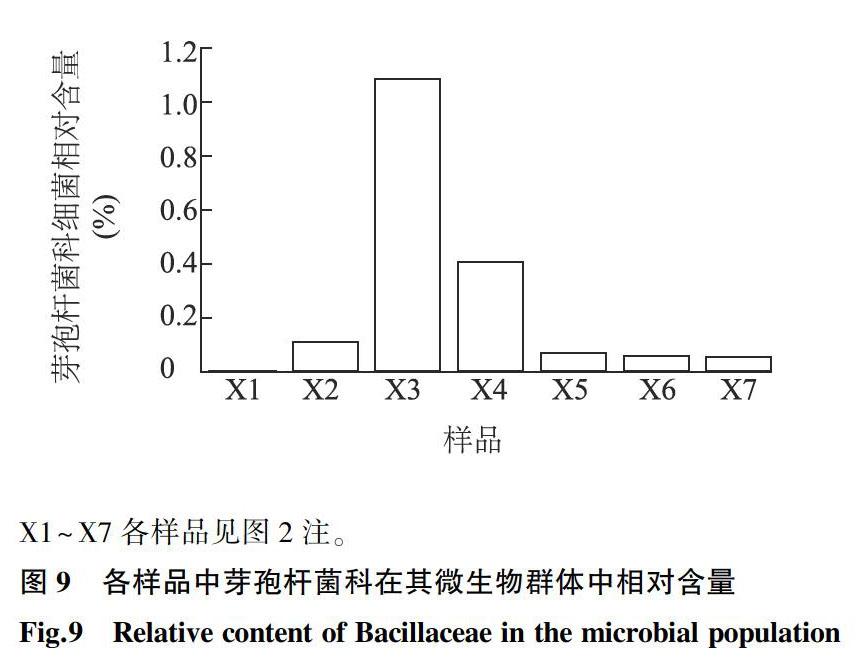
分离所获得的4株秸秆降解菌均为芽孢杆菌科,其在7组样品中相对含量如图9所示。不同发酵条件对生物质废弃物联合发酵体系中微生物产生不同影响。与其他试验组相比,低氧含量条件(X3)下Bacillaceae相对丰度显著增长,进一步表明低氧条件下秸秆粉等生物质废弃物联合发酵更有利于秸秆的降解。但是,传统纯培养方法分离得到的微生物仅占总数的1%[30],因此分离富集培养方法很难反应自然条件下微生物多样性信息[31],而高通量测序能够绕过细胞培养直接获得原位环境微生物群落结构信息。分析原位生物质废弃物降解功能菌群优势菌相对含量,可以为解析环境中微生物群落物种组成、功能提供重要参考。
X1~X7各样品见图2注。
3結论
氧含量不同对玉米秸秆、畜禽粪便、活性污泥发酵体系中微生物群落结构、营养结构等产生显著影响。高通量测序结果表明:在发酵体系中,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)相对丰度高,占据绝对优势。其中,发酵罐中层(X3)、2组强化可培养菌系统(X6、X7)中可促进碳水化合物、秸秆纤维素和半纤维素及其他多糖物质等有机物降解的Bacteroidetes相对丰度变化尤为显著,说明氧含量较低的条件更有利于秸秆的降解。
通过纯培养方式获得的4株秸秆降解菌均为芽孢杆菌属,其对玉米秸秆降解效率最高可达28.9%。高通量测序结果说明与其他试验组相比,在较低氧含量条件(X3)下Bacillaceae相对丰度增长明显,进一步证明氧含量较低的条件有利于秸秆降解。利用传统纯培养方式与新一代测序方法结合,探究生物质废弃联合发酵过程中微生物多样性变化与秸秆降解之间的规律,可以为完善生物质废弃物再利用提供理论依据,也为秸秆还田提供菌种资源。
参考文献:
[1]朱晓春,杜晓丹,贾向春,等.规模化奶牛牧场粪污资源化利用标准化研究[J].中国标准化,2019(21):179-183.
[2]KIM M, YANG Y, MORIKAWA-SAKURA M S, et al. Hydrogen production by anaerobic co-digestion of rice straw and sewage sludge[J]. International Journal of Hydrogen Energy,2012, 37(4): 3142-3149.
[3]WANG X, YANG G, FENG Y, et al. Optimizing feeding composition and carbon-nitrogen ratios for improved methane yield during anaerobic co-digestion of dairy, chicken manure and wheat straw[J]. Bioresource Technology, 2012, 120: 78-83.
[4]ZHAO J, GUI L, WANG Q, et al. Aged refuse enhances anaerobic digestion of waste activated sludge[J]. Water Research, 2017, 123: 724-733.
[20]唐涛涛,李江,杨爱江,等. 秸秆类型及配比变化对污泥厌氧消化中微生物群落的影响[J]. 化工进展, 2020,39(2): 667-678.
[21]于静,谷洁,王小娟,等. 微生物菌剂对鸡粪堆肥过程中氨气排放和微生物群落的影响[J]. 西北农业学报, 2019, 28(11): 1861-1870.
[22]令利军,何楠,白雪,等. 基于高通量测序的玉米秸秆自然发酵过程中细菌菌群结构特征[J]. 兰州大学学报(自然科学版), 2017, 53(4): 526-533.
[23]王春芳,馬诗淳,黄艳,等. 降解水稻秸秆的复合菌系及其微生物群落结构演替[J]. 微生物学报, 2016, 56(12): 1856-1868.
[24]匡小珠,邱艳玲,师晓爽,等. 一株新属水平厌氧发酵性细菌的分离与鉴定[J]. 安徽农业科学, 2010,38(17): 8840-8843.
[25]TSUCHIDATE T, TATENO T, OKAI N, et al. Glutamate production from β-glucan using endoglucanase-secreting Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology, 2011, 90(3): 895-901.
[26]康志超. 耐低温木质纤维素降解菌群的构建及其应用研究[D]. 长春:中国科学院大学(中国科学院东北地理与农业生态研究所), 2019.
[27]任海伟,孙安琪,任军乐,等. 添加白菜尾菜和甲酸对干玉米秸秆贮存品质的影响[J]. 草业学报. 2019, 28(8): 61-71.
[28]王加友,赵彭年,杨德玉,等. 一株纤维素分解菌的筛选、鉴定及其对玉米秸秆的降解效果[J]. 生物技术进展, 2018, 8(2): 132-139.
[29]李红亚,李术娜,王树香,等. 产芽孢木质素降解菌MN-8的筛选及其对木质素的降解[J]. 中国农业科学,2014, 47(2): 324-333.
[30]ALAIN K, QUERELLOU J. Cultivating the uncultured: limits, advances and future challenges[J]. Extremophiles, 2009, 13(4): 583-594.
[31]ROSSELLO M R, AMAN R. The species concept for prokaryotes[J].FEMS Microbiology Reviews,2001, 25(1):39-67.
(责任编辑:张震林)
