苹果根际解磷菌的分离筛选及解磷能力
2020-07-21庄馥璐柴小粉高蓓蓓
庄馥璐 柴小粉 高蓓蓓 王 忆
(中国农业大学 园艺学院,北京 100193)
苹果是蔷薇科苹果亚科苹果属植物,其果实富含矿物质和维生素,是人们日常生活中常见的鲜食水果之一。2017年世界苹果年产量约为 7 680 万t,中国作为世界上最大的苹果生产国和消费国,产量达4 450 万t,占世界苹果年产量的58%[1]。中国苹果的商业化生产已经成为许多地区重要的经济支柱。
磷是植物生长发育不可缺少的大量元素之一,对促进植株的生长发育和各种新陈代谢起着重要的作用。植株吸收的磷95%以上是无机磷的形式,占全磷含量的25%~56%[2],因此无机磷的供应常出现不足。据相关统计显示,全世界约有43%的耕地土壤缺乏能被植物吸收利用的有效磷, 我国缺乏有效磷的耕地土壤更是占我国总耕地土壤的70%以上[3]。为了保证农业生产的需求, 人们常常通过施用大量的磷肥来弥补有效磷的供应[4]。然而随着大量的磷肥投入,同时也造成了土壤磷盈余, 不仅降低了磷肥的利用率, 而且对果园环境构成威胁[5]。因此,如何能够满足土壤磷素供给,又不给生态环境造成额外负担,成为了果园管理新的关注点,生物菌肥也随之孕育而生。
土壤微生物在磷循环中起着至关重要的作用,其中,一些细菌可以通过溶解不溶性磷酸盐来提高植物的有效磷库,其被称之为解磷菌。解磷菌种类繁多,根据种类,可分为细菌、真菌和放线菌等。也可以根据解磷菌作用对象,即分解底物的不同,分为有机磷微生物(能够转化有机磷化合物)和无机磷微生物(将难溶无机化合物转为可吸收的可溶磷)。其实很难根据分解底物的不同将解磷菌区分开来,无机磷和有机磷都能被链霉菌属所溶解。目前,报道的菌属约有 20 多种,其中解磷细菌研究最多,主要包括芽孢杆菌(Bacillus)、假单胞菌(Pseudomonas)、根瘤菌(Rhizobium)、伯克氏菌属(Burkholderia)、无色杆菌属(Achromobacter)、固氮菌(Azotobacter)、农杆菌(Agrobacterium)、微球菌(Micrococcus)、黄杆菌属(Flavobacterium)和根瘤菌(Rhizobiumsp.)等[8-9]。解磷真菌类报道较少,但真菌磷能力强是目前许多学者关注的热点。研究较多的有青霉菌属(Penicillium)、曲霉菌属(Asperquillus)、根霉属(Rhizopus)、 镰刀菌属(Fusarium)和小菌核菌属(Sclerotium)等。放线菌主要包括链霉菌属(Streptomyces)和AM菌根。解磷菌对于农业生产上有重要的意义,解磷菌肥料的生产简单、见效快、市场竞争力强。因此,解磷菌肥不仅能够促进植物生长使作物增产,还能提高磷利用率使土壤环境改善,促进生态系统的可持续发展。
然而,目前在对土壤解磷菌的研究主要集中于溶解无机磷菌株的筛选[6-7],对于筛选土壤难溶性有机磷解磷菌的报道则较少[8]。同时,随着种植业结构的调整,人们对园艺产品的需求在不断增加,相应的,园艺产品对土壤中营养元素的需求也在不断增加,致使全国耕地土壤速效磷含量逐年下降。在土壤磷循环过程中,解磷微生物起着重要的作用,它可以将土壤中的难溶性磷转化为植物能够吸收并利用的有效磷,最终实现提高磷肥的利用率、改良土壤结构和提高作物产量的作用[9-12]。目前,对于解磷细菌筛选的研究国内外已有一些相关的报道,而前人多集中在对小麦[13-14]、玉米[15]和番茄[16]等根际解磷菌的研究,并将相关的解磷菌应用到菌肥中。国内外众多学者研究了生物菌肥在豆科和茄科等作物上的应用,目前在美国和澳大利亚等发达国家80%以上的豆科作物种植时都接种根瘤菌剂,但在中国接种根瘤菌的作物面积不足种植面积的1%[17-18]。其中,前人对茄子[19]和花生[20]等植物的研究表明:解磷菌肥的适量增施能够有效提高植株对氮、磷和钾的吸收,显著提高作物的产量,改善品质;生物菌肥在烟草上的施用能够改善植烟土壤环境[21]以及促进烟株对钾素的吸收和利用[22],从而促进烟株生长发育,提高产量和质量[23]。但是,目前对于果树根际解磷菌的报道还很少。
本研究以植酸钙作为唯一有机磷源,通过选择性培养,从苹果砧木小金海棠根际土壤中分离纯化解磷细菌,研究该菌株的解磷能力及生长情况;并选择解磷能力强的菌株回接到植物根系,研究解磷菌对植株的影响,以期在开发果树特异性和效果好的解磷菌资源。
1 材料与方法
1.1 土壤样品采集
苹果根际土的收集在北京市昌平区上庄镇实验基地苹果园中进行。该地区属于暖温带,半湿润大陆性季风气候,年均气温13 ℃,年均降水量535 mm,降水主要集中在夏季,全年日照2 390 h,土壤类型以褐土为主。果园中的栽培品种为富士,嫁接基砧为小金海棠的实生砧木,于2011年9月初芽接。在2018年10月进行土壤采集,以树干为中心的半径1 m范围内,避开施肥点,取深度为0~20 cm 土层的毛细根,用“抖根法”收集根际土,装入无菌自封袋并迅速放入冰盒,带回实验室于4 ℃冰箱保存,用于后续解磷细菌的分离筛选。
1.2 解磷菌的分离筛选及纯化
称取1 g根际土,装入10 mL无菌离心管中,加入10 mL无菌水,充分振荡形成细菌悬浮液,依次稀释得到10-1、10-2、10-3、10-4和10-5稀释梯度的样品。取各稀释梯度悬液100 μL均匀涂布到含蒙金娜有机磷培养基(1 L 体系:10 g葡萄糖(glucose)、0.5 g (NH4)2SO4、0.3 g NaCl、0.3 g KCl、0.03 g FeSO4·7H2O、0.03 g MnSO4·4H2O、0.3 g MgSO4·7H2O、0.4 g酵母粉、15 g琼脂粉、2 g 植酸钙,pH为7.0)的平板上,放置于37 ℃恒温培养箱2 d。从适当稀释倍数的培养基上挑取形成溶磷圈的单菌落,采用划线的方式将单菌落接种到LB平板培养基上培养形成单菌落,再挑取单菌落在蒙金娜培养基上划线,反复上述步骤直至得到纯的单菌落。然后将这些菌株接种到LB斜面培养基上,37 ℃培养2 d后置于4 ℃冰箱中保存,用于后续检测。
1.3 解磷细菌的鉴定
对菌体进行革兰氏染色,在显微镜下观察菌体形态。解磷细菌生理生化特性测定参考《常见细菌系统鉴定手册》[24]和《伯杰细菌鉴定手册》[25]的方法对菌株进行淀粉水解、过氧化氢酶试验、M.R (甲基红)试验和明胶试验等生理生化试验。
从小金海棠根际土壤中分离纯化的解磷细菌进行16S rDNA测序分析,用以确定解磷菌菌株种类。在LB培养液中活化细菌,吸取菌液进行细菌PCR扩增,采用细菌16S rDNA通用引物(27F:5-AGA GTT TGA TCM TGG CTC AG-3′;1492R:5′- TAC GGY TAC CTT GTT ACG ACT T-3′;M 为A 或C),PCR反应体系50 μL,PCR反应程序为 95 ℃ 预变性5 min;94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸1 min 30 s,循环34次;最后72 ℃延伸7 min。然后将PCR产物交由生工生物工程(上海)股份有限公司进行测序分析,所得序列提交到Genbank中利用Blast程序(www.ncbi.nlm.nih.gov/BLAST/)进行相似性比对,用ClustalX进行序列比对分析,确定细菌的种类,最后用MEGA软件(版本5.5)构建系统进化树。
1.3.1解磷菌的解磷能力测定
将分离纯化的菌株接种到蒙金娜有机磷培养基平板上,放置 37 ℃ 恒温箱中培养 60 h 分别测定细菌菌落直径(d)和溶磷圈直径(D),计算可溶性指数(D/d)。由于磷酸单酯酶能够水解对硝苯基磷酸二钠,产生磷酸和对硝基苯酚(黄色)。通过比色法测定释放的对硝基苯酚的含量,计算单位根际土单位时间内对硝基苯酚的量来评估磷酸单酯酶的活性。因此向培养基平板上滴加2 mL 150 mmol/LpNPP(对硝苯基磷酸二钠),覆盖溶磷圈,4 h后观察显色结果,如有黄色产生则说明细菌分泌磷酸酶。将各菌株分别接种到LB液体培养基,以180 r/min 37 ℃ 培养7 h后用分光光度计调整细菌浓度至OD600=0.6。在超净工作台中吸取750 μL细菌悬液加入到装蒙金娜液体培养基(15 mL)的50 mL无菌离心管,斜放于37 ℃振荡(180 r/min)培养,每个菌株3次重复。在培养24 h后吸取2 mL溶液,4 ℃,12 000 r/min 离心5 min,取上清液用钼锑抗显色法[26]测定无机磷含量,同时用pH计测定培养液pH。另外取上清液0.5 mL,添加0.1 mLpNPP (对硝苯基磷酸二钠)MES缓冲液(pH 8.5),30 ℃水浴培养30 min,用1 mL 0.25 mol/L NaOH溶液终止反应。对照先添1 mL 0.25 mol/L NaOH溶液终止反应,然后 30 ℃水浴培养30 min,12 000 r/min离心10 min,用pNP(对硝基苯酚)做标准曲线比色,测定磷酸酶含量。
1.3.2解磷菌生长曲线的测定
各解磷细菌菌株在LB液体培养基以180 r/min 37 ℃培养8 h,用分光光度计将菌液调整至OD600=0.1用于接种。本试验用100孔微孔板作为细菌生长曲线测定的培养装置,在微孔中分别加入180 μL液体LB培养基,然后每个孔内加入20 μL调整好的菌液,对照加入20 μL液体LB培养基,每个处理重复9次。微孔板放到细菌连续生长仪Bioscreen C MBR(Oy Growth Curves Ab Ltd,Finland)中 37 ℃ 培养,每隔2 h监测OD600值,用于反应细菌的生长状况。
1.4 拟南芥回接试验及根际pH显色
拟南芥根际回接解磷菌试验在培养基上进行。解磷菌回接试验设置3个处理,分别是正常磷供应、无菌且植酸钙为磷源、回接解磷菌且植酸钙为磷源(在拟南芥根系生长位置加入PsbM4菌液10 μL),每个处理4次重复,每次重复1个板(10棵拟南芥)。本试验采用M培养基,按照表1准备母液[27]。配置工作液时吸取相应体积的母液,加 10 g/L 蔗糖,pH调至5.5,固体培养基加3 g/L植物凝胶,121 ℃灭菌15 min。试验用拟南芥为野生型,种子用75%无水乙醇消毒30 s,无菌水冲洗3~4次,再用次氯酸钠(体积比:次氯酸钠∶无菌水=1∶3)消毒4 min,无菌水清洗3~4次,播种于MS培养基中,放置于4 ℃纯化3 d。之后取出,培养基垂直培养,生长2周左右转移至不同处理的培养基中进行培养,直至出现缺磷表型。收获时检测根际pH。

表1 Minimum(M)培养基母液配方[27]Table 1 Concentration of stock solutions to prepare minimum(M) medium
收获时,将拟南芥根系用去离子水清洗3次,用吸水纸将根系表面水分吸干,将根系放置于显色培养基(0.06 g溴甲酚紫用少量95%酒精溶解,用蒸馏水定容至100 mL,取1 mL加入100 mL去离子水中,用1 mol/L NaOH调整溶液pH约5.9,加入1 g琼脂,加入溶解后倒板)上,将根系展开,暗培养60 min,观察根系周围培养基颜色变化。
1.5 数据处理
试验数据均用Excel进行初步整理,利用SPSS软件(20.0版本)进行数据分析。对不同菌株的可溶性指数、液体培养基中无机磷浓度和磷酸酶活性进行单因素方差分析和LSD法多重比较(P<0.05)。利用MEGA软件(版本5.5)构建系统进化树,利用Sigmaplot软件(版本10.0)拟合细菌生长曲线。
2 结果与分析
2.1 苹果根际土壤解磷菌的筛选和纯化
在5个不同稀释梯度下,对比根际土壤细菌悬液在筛选培养基上培养24 h后的菌落个数,确定解磷菌的最终筛选稀释倍数为10-3,此时细菌在有机磷筛选培养基上的生长状况如图1(a)所示,单皿菌落数在30~300个且单菌落间较好分离,同时出现较为明显的溶磷圈。将出现溶磷圈的单菌落进行纯化培养,得到10株解磷菌,分别命名为苹果树解磷菌1-10(Phosphate-solubilizing bacteria fromMalusxiaojinensis1-10,简称PsbM1-10)。
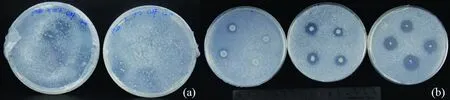
(a)稀释倍数为 10-3 的筛选培养基 Selection medium with a dilution factor of 10-3(b)不同解磷菌的解磷能力对比 Comparison of phosphorus removal ability of different phosphorus removal bacteria图1 筛选解磷菌的培养基及不同解磷菌解磷能力的对比Fig.1 Comparison of medium for screening phosphate-solubilizing bacteria and the phosphate-solubilizing capacity of different phosphate-solubilizing bacteria
2.2 解磷菌的生理生化特性
对筛选获得的10株解磷菌进行细菌基本理化性质的测定,包含革兰氏染色、甲基红、过氧化氢、淀粉水解和明胶水解试验等。细菌按特征可为革兰氏阳性和阴性菌两大类,根据染色性质可以缩小鉴定范围,有利于进一步分离和判断,检测发现所有筛出的10株解磷菌均为革兰氏阴性菌,且通过甲基红试验验证均不可代谢糖产酸。过氧化氢试验发现PsbM4和PsbM9具有过氧化氢酶活性,使得滴加3%过氧化氢溶液5 min后仍能产生气体。PsbM4和PsbM10被发现可产生淀粉水解酶,可以水解淀粉使碘液和淀粉无法形成蓝紫色物质。PsbM1、PsbM4、PsbM5和PsbM9可产生明胶酶分解明胶,使明胶液化。

(a)过氧化氢试验 H2O2 test; (b)淀粉水解试验 Starch hydrolysis test; (c)明胶试验 Gelatin test图2 3种生理生化指标的测定Fig.2 Determination of three physiological and biochemical indexes
2.3 解磷菌的解磷能力
研究中常用溶磷圈直径(D)和菌落直径(d)的比例关系来代表解磷菌的解磷能力,因此本研究利用蒙金娜有机磷固体培养基测定纯化的10株解磷菌的这2个指标初步测定10株解磷菌的解磷能力,结果显示:10株解磷菌的可溶性指数>1.50,不同菌株之间存在差异,其中PsbM6的可溶性指数最大(为5.13),其次是PsbM7、PsbM8和PsbM10(分别为3.53、3.42和3.18),可溶性指数最小的为PsbM1(表3)。
通过钼锑抗显色法对10株解磷菌的解磷能力进行定量分析,结果表明PsbM10的解磷能力最强,培养24 h后溶液的无机磷浓度达到104.125 mg/L,其次为PsbM4和PsbM8。由于解磷菌在矿化有机磷的同时会降低溶液pH,因此溶液pH的变化也在一定程度说明菌株的解磷能力高低。测定发现10株解磷菌使pH降低的程度有所不同,其中PsbM8 和PsbM6下降幅度最低。

表2 10株解磷菌的理化特性Table 2 Physicochemical characteristic of 10 strains of phosphatolytic bacteria
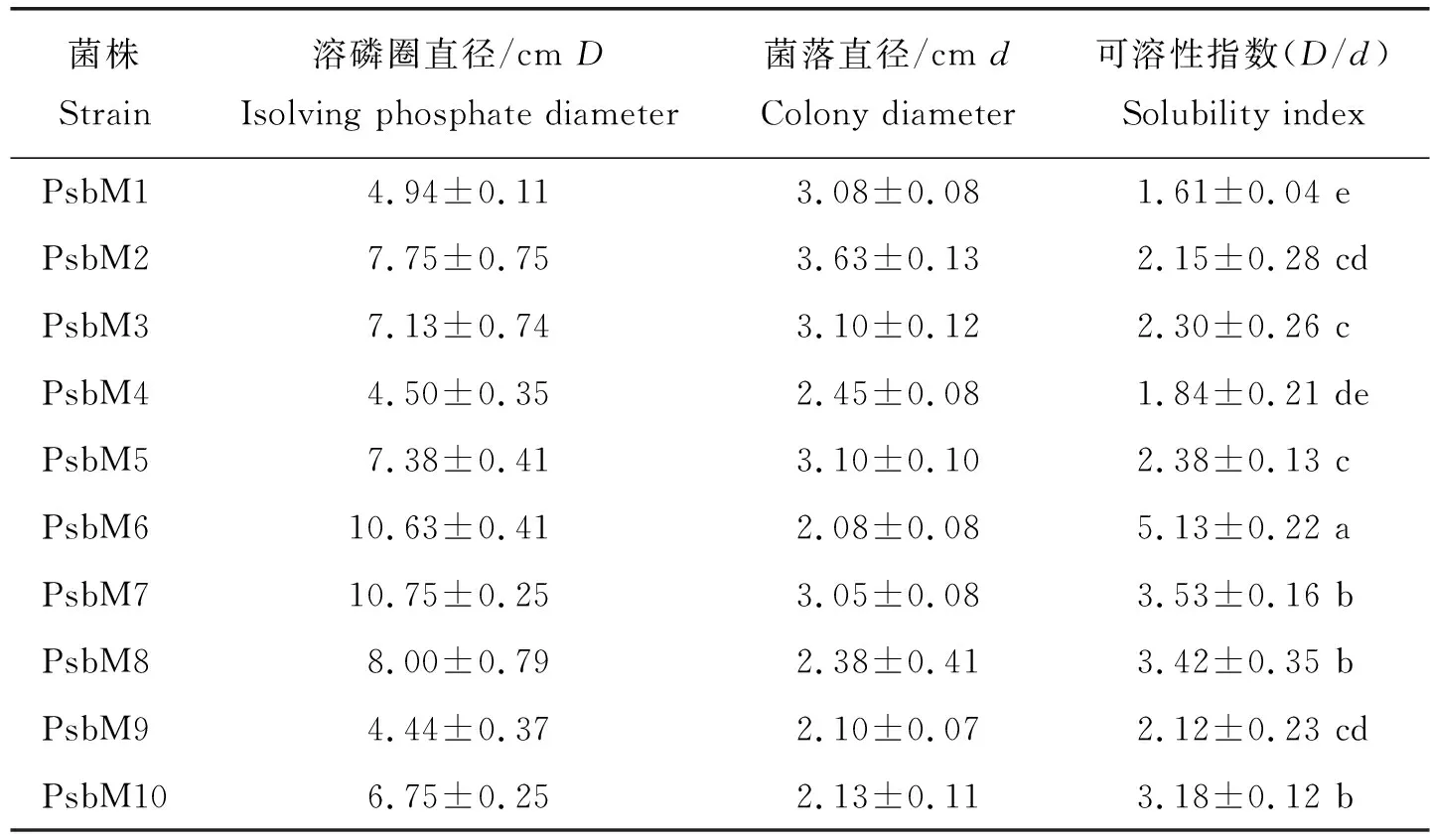
表3 解磷菌溶磷圈和菌落直径比值Table 3 Disolving phosphate zone diameter to culture community zone diameter ofphosphate-solubilizing bacteria

不同小写字母表示处理间差异达显著水平(P<0.05)。下同。The different lower case letters indicate significant difference among the treatments(P<0.05). The same below.图3 从小金海棠苹果砧木根际分离的10株解磷菌的解磷量及菌液pHFig.3 Phosphorus solubility and pH value of the bacteria solution of 10 strains isolated from rhizosphere of apple stock Malus xiaojinensis
2.4 解磷菌的酸性磷酸酶活性
有学者[28]认为,细菌分泌酸性磷酸酶的活性与解磷菌的解磷能力有关,因此本研究对这10株解磷菌进行酸性磷酸酶活性的定性和定量的检测。在产生溶磷圈的蒙金娜有机磷培养基平板上滴加1 mLpNPP,覆盖溶磷圈,10株解磷菌均有黄色产生(图4(a)和(b)),说明这些解磷菌都能够分泌酸性磷酸酶。同时定量检测解磷菌的酸性磷酸酶活性(图4(c)),发现菌株PsbM4的酸性磷酸酶活性最高,达到44.24 μg/(mL·h)(pNPP),菌株PsbM3的酸性磷酸酶活性次之,为22.63 μg/(mL·h)(pNPP)。

(a)解磷菌未进行磷酸酶显色反应前; (b)解磷菌进行磷酸酶显色反应后; (c)10株解磷菌的磷酸酶活性(a) Phospholytic bacteria before phosphatase chromogenic reaction; (b) Phospholytic bacteria after phosphatase chromogenic reaction; (c) Phosphatase activity of 10 strains of phosphatolytic bacteria图4 解磷菌酸性磷酸酶显色反应和10株解磷菌的酸性磷酸酶活性Fig.4 Phosphatase chromogenic reaction and phosphatase activity of 10 phosphatase producing strains
2.5 解磷菌的生长曲线
为了对菌种进行更好的应用,需要筛选出能够快速增殖的株系。通过对解磷菌生长曲线拟合发现,多数解磷菌生长迅速,在2 h内即进入对数期,12 h后进入稳定期,但菌株之间的生长繁殖能力存在一定差异(图5)。特别是PsbM4,其在培养过程中滞后期较长,在6 h后进入对数期,20 h进入稳定期,繁殖速度较慢。
2.6 优势解磷菌的筛选及菌株鉴定
对解磷菌株的16S rDNA进行测序,经基因序列比对分析构建系统进化树(图6), 发现10个菌株可以归为3个主要的菌属(Acinetobacter、Enterobacter和Pseudomonas)中。在解磷优势菌的筛选中,以各菌株的解磷能力和酸性磷酸酶的活性为主要筛选标准。根据前面的试验结果可知,PsbM4的解磷能力仅次于PsbM10且其酸性磷酸酶的活性明显高于其他菌株,所以本研究重点关注PsbM4。通过 BLAST比对并使用 MEGA7 软件构建进化树,PsbM4显示与肠杆菌属成员EnterobactercloacaeMG274270.1具有最高同源性。随后,将其作为优势解磷菌株进行研究。
2.7 菌株回接拟南芥结果
为了验证PsbM4是否有利于植物的生长,将菌株回接到拟南芥根系周围。挑PsbM4单菌落至LB培养基,在180 r/min 37 ℃培养24 h后用无菌水调整细菌的OD600为1.0,在每盘培养基中加入20 μL的菌液且用涂布器推开。将拟南芥分别移栽至MS、缺磷和缺磷加菌3组培养基中,6 d后进行拍照并进行根系pH显色。
从图7(c)可以看出,缺磷加解磷菌培养基中拟南芥的根系周围有明显的解磷圈出现, 这说明培养基中的部分植酸钙被解磷菌分解;而且相比于缺磷培养基(图7(b)所示),加菌培养基的植株更大且叶片更绿。同时,将拟南芥根系用去离子水清洗3次,用吸水纸将根系表面水分吸干,将根系进行pH显色发现,若有黄色出现说明根系分泌出酸性物质。如图7(c)所示,缺磷加菌培养基拟南芥根系周围有黄色出现,这说明其根系分泌出酸性物质,而如图7(a)和(b)所示,缺磷培养基和MS培养基并无颜色变化。

图5 从苹果砧木小金海棠分离的 10 株解磷菌的生长曲线Fig.5 Growth curve of 10 phosphate-degrading bacteria isolated from apple stock Malus xiaojinensis
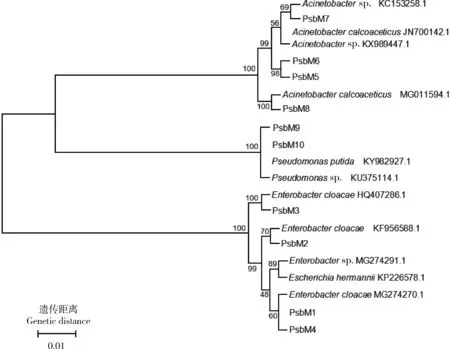
图6 从小金海棠苹果砧木根际分离的10株解磷菌16S rDNA系统发育树Fig.6 Phylogenetic tree of estbliashed based on 16S rDNA sequences of 10 phosphatolytic bacteria isolated from apple stock Malus xiaojinensis

(A)和(a) MS培养基; (B)和(b)缺磷培养基; (C)和(c)缺磷加解磷菌培养基(A) and (a) MS medium; (B) and (b) phosphorus deficient medium; (C) and (c) phosphorus-deficient admixture medium for phosphorus-deficient bacteria图7 各处理组拟南芥的表型及pH显色情况Fig.7 Phenotype and pH color development of Arabidopsis thaliana in each treatment group
3 讨 论
随着种植业结构的调整,人们对园艺产品的需求在不断增加,相应的,园艺产品对土壤中营养元素的需求也在不断增加,致使全国耕地土壤速效磷含量逐年下降。在土壤磷循环过程中,解磷微生物起着重要的作用。目前,对于解磷细菌筛选的研究主要集中在大田作物,对于果树根际解磷菌的报道还很少。根际土壤解磷菌在土壤中的数量及生态分布主要受宿主植物基因型、土壤类型和耕作方式等因素影响[29]。大田作物根际解磷菌多为芽孢杆菌属和假单胞菌属,而Zaffar等[30]通过研究发现苹果根际土壤中存在大量的芽孢杆菌属、假单胞菌属和微球菌属。对解磷菌解磷能力的相关研究表明,其解磷能力的大小主要是由菌株自身的特性所决定的,有学者认为解磷能力与菌株分泌的苹果酸和草酸相关[31-32],还有学者认为磷酸酶对解磷菌的解磷效果有重要影响[33],磷酸酶活性越高,解磷能力越强。
在本研究中选择的原产我国对磷具有高效吸收特性的苹果砧木小金海棠,筛选到具有矿化有机磷的根际解磷菌主要为不动杆菌属、肠杆菌属和假单胞菌属,这说明根际土壤解磷菌的种群类型与宿主基因型确实有一定的关系,与前人研究相符。运用溶磷圈法和钼锑抗比色法对10 株解磷菌的解磷能力及酸性磷酸酶活性进行综合测定后发现,培养后的菌液上清液的pH均比初始pH低,这极有可能是解磷菌在解磷的过程中产生了酸性磷酸酶等物质,矿化了培养基中的植酸钙产生无机磷,从而引起了pH的下降。综合分析10株解磷菌的溶磷圈大小、解磷能力和酸性磷酸酶活性,发现PsbM4体现了较高的解磷能力和酸性磷酸酶活性,因此将它作为筛选到的优势候选菌株,将其回接到拟南芥中,发现解磷菌能促进拟南芥生长,解磷菌同时影响了拟南芥的根际pH,导致拟南芥的根际pH下降,这可能是由于解磷菌分泌的酸性磷酸酶导致的结果,与测定解磷菌能力时菌液pH下降的结果相同。
未来会将解磷菌进一步回接到苹果苗并探究解磷菌的促吸磷机制,由于从苹果砧木小金海棠中分离筛选出的解磷菌,与苹果根系互作性较好,对土壤环境的适应性也更强,对于开发解磷菌肥将具有一定意义。