青光安II号方有效组分对青光眼模型DBA/2J小鼠视网膜中RhoA、ROCK及Caspase-3蛋白表达的影响
2020-07-18李银鑫蒋鹏飞曾志成彭清华
李银鑫 蒋鹏飞 曾志成 彭清华

〔摘要〕 目的 观察青光安II号方有效组分对青光眼模型DBA/2J小鼠视网膜中RhoA、ROCK及Caspase-3蛋白表达的影响。方法 将8只(16只眼)雌性C57BL/6小鼠设为空白组(A组),48只(96只眼)雌性DBA/2J小鼠随机分成6组,每组8只(16只眼),分别为:模型组(B组)、益脉康分散片组(C组)、青光安II号汤剂组(D组)、青光安II号有效组分低浓度组(E组)、青光安II號有效组分中浓度组(F组)、青光安II号有效组分高浓度组(G组),B、C、D、E、F、G组DBA/2J小鼠喂养38周龄建立青光眼模型后开始干预,干预4周后Western blot法检测DBA/2J小鼠视网膜中RhoA、ROCK及Caspase-3蛋白的相对表达量。结果 干预4周后,与A组比较,B组RhoA、ROCK、Caspase-3蛋白相对表达量明显升高,差异均有统计学意义(P<0.05);与B组比较,C、D、E、F、G组RhoA、ROCK、Caspase-3蛋白表达减少,差异均有统计学意义(P<0.05);与C组比较,D、E、F组RhoA、ROCK、Caspase-3蛋白相对表达差异无统计学意义(P>0.05);与C、D组比较,G组RhoA、ROCK、Caspase-3蛋白表达减少,差异有统计学意义(P<0.05)。结论 青光安II号方有效组分能抑制Rho/ROCK信号通路及凋亡相关蛋白Caspase-3的表达,其中高浓度青光安II号方有效组分效果优于益脉康分散片和青光安II号方汤剂,推测青光安II号方及其有效组分治疗青光眼的机制可能与其抑制Rho/ROCK信号通路及视网膜细胞凋亡相关蛋白表达有关。
〔关键词〕 青光眼;青光安II号方;DBA/2J小鼠;Rho/ROCK信号通路;细胞凋亡
〔中图分类号〕R285.5;R775 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.06.006
〔Abstract〕 Objective To observe the effect of the effective component of Qingguang'an II on the expression of RhoA, ROCK and Caspase-3 protein in the retina of DBA/2J mice with glaucoma. Methods Eight female C57BL/6 mice (16 eyes) were set as the blank group (Group A), and 48 female DBA/2J mice (96 eyes) were randomly divided into 6 groups, with 8 rats (16 eyes) in each group. Theses groups were model group (group B), Yimaikang Dispersible Tablet group (group C), Qingguang'an II Decoction group (group D), Qingguang'an II effective component low concentration group (Group E), Qingguang'an II effective component middle concentration group (Group F), Qingguang'an II effective component high concentration group (Group G). Groups B, C, D, E, F and G were fed for 38 weeks after birth, and the glaucoma model was established. From week 39, all the groups were treated for 4 weeks, and the expression of RhoA, ROCK and Caspase-3 protein was detected by western blot. Results After 4 weeks intervention, compared with group A, the expression of RhoA, ROCK, and Caspase-3 protein in group B was significantly increased, and the difference was statistically significant (P<0.05); Compared with group B, the expression of RhoA, ROCK, and Caspase-3 protein in group C, D, E, F, G were decreased, and the difference was statistically significant (P<0.05); Compared with groups C, the expression of RhoA, ROCK, Caspase-3 protein in group D, E and F was not statistically significant different (P>0.05). Compared with group C, D, the expression of RhoA, ROCK, and Caspase-3 protein in group G was decreased, and the difference was statistically significant (P<0.05). Conclusion The effective component of Qingguang'an II can inhibit the expression of Rho/ROCK signaling pathway and apoptosis-related protein Caspase-3 in retinal cells, and the effect of high concentration Qingguang'an II effective component is better than Yimaikang Dispersible Tablets and Qingguang'an II Decoction The mechanism of Qingguang'an II and its effective component for glaucoma may be related to its inhibition of Rho/ROCK signaling pathway and the expression of apoptosis-related proteins in retinal cells.
〔Keywords〕 Glaucoma; Qingguang'an II prescription; DBA/2J mice; Rho/ROCK signaling pathway; apoptosis
青光眼(glaucoma)是因视网膜神经节细胞(retinal ganglion cells,RGCs)及其轴突渐进变性,进而导致特征性视神经结构性损害并伴随视力损失的一组视神经病变疾病[1],本病都具有视神经损害这一病理结局,其原因是各种病理因素导致了RGCs的损伤、变性、凋亡[2]。目前,阻断或降低RGCs凋亡、提高RGCs存活率逐渐成为青光眼研究的主流方向[3]。视神经损伤后,Rho/ROCK信号通路激活,视网膜及视神经RhoA和ROCK蛋白表达,凋亡相关蛋白Caspase-3表达逐渐升高,视网膜、视神经的形态学明显改变,如视神经轴突肿胀、轴突数目减少、髓鞘松解变性、板层结构分离、神经间质基质密度降低等[4-6]。阻断Rho/ROCK信号通路可抑制RGCs的凋亡,提高RGCs的存活率,从而起到保护神经的作用[7]。RhoA、ROCK蛋白是该信号通路上的重要蛋白,Caspase-3是凋亡相关蛋白。前期实验和临床研究发现,“血瘀水停”为青光眼早中期病机之一[4],根据青光眼视神经损伤的中医病理机制,对青光安颗粒剂的组方进行优化,研发了青光安Ⅱ号方[2]。本实验观察了青光安Ⅱ号方及其低、中、高浓度有效组分对青光眼模型DBA/2J小鼠视网膜中RhoA、ROCK及Caspase-3蛋白表达水平的影响,希望能明确青光安II号方治疗青光眼的部分机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 48只10周龄健康SPF级雌性DBA/2J小鼠,体质量18~22 g,北京维通利华实验动物技术有限公司提供,实验动物质量合格证号:1100111911055898;8只10周龄健康SPF级雌性C57BL/6J小鼠,体质量18~22 g,湖南斯莱克景达实验动物有限公司提供,实验动物质量合格证号:1107271911002463。动物饲养于湖南中医药大学科技创新中心实验动物中心SPF级实验室,标准化颗粒饲料饲养,自由进食、进水。
1.1.2 实验药物 青光安Ⅱ号汤剂:由枸杞子、黄芪、女贞子等道地药材按规定比例用灭菌蒸馏水制成悬混液;青光安II号方有效组分悬混液:基于课题组既往中药高通量筛选体系[8-9]经验对青光安II号方中药组分库的筛选,提取出青光安II号方有效组分悬混液。益脉康分散片:湖南湘雅制药有限公司,批号:1903119。
1.1.3 主要试剂及仪器 RIPA裂解液(武汉赛维尔生物科技有限公司,批号:G2002);BCA蛋白定量检测试剂盒(武汉赛维尔生物科技有限公司,批号:G2026);β-actin(武汉赛维尔生物科技有限公司,批号:GB12001);HRP标记山羊抗兔(武汉赛维尔生物科技有限公司,批号:GB23303);兔抗-RhoA(北京博奥森生物技术有限公司,批号:20190586);兔抗-ROCK(武汉贝茵莱生物科技有限公司,批号:AF07053985);兔抗-Caspase-3(北京博奥森生物技术有限公司,批号:AG07138921);Tono-pen AVIA笔式眼压计(美国Reichert公司);微量可调移液器(广州雷得生物技术有限公司);脱色摇床(武汉赛维尔生物科技有限公司,型号:TSY-B)。
1.2 实验方法
1.2.1 青光眼模型的建立 根据杨帆等[10-11]的实验研究,采用DBA/2J小鼠喂养至38周龄自动成模。动态观察DBA/2J小鼠眼压、眼前节变化,38周龄时DBA/2J小鼠眼壓较前明显升高,裂隙灯下可见角膜钙化斑、虹膜色素脱失、瞳孔移位及部分并发白内障,则造模成功。
1.2.2 实验分组 将8只(16只眼)雌性C57BL/6J小鼠设为空白组(A组),48只(96只眼)雌性DBA/2J小鼠按照随机数字表法随机分成6组,分别为模型组(B组)、益脉康分散片组(C组)、青光安II号汤剂组(D组)、青光安II号方有效组分低浓度组(E组)、青光安II号方有效组分中浓度组(F组)、青光安II号方有效组分高浓度组(G组),并对所有实验动物进行标号处理。
1.2.3 动物给药 第38周龄时,各组开始灌胃给药,连续4周,每日1次。其中A组和B组饲服12.91 mL/(kg·d)蒸馏水;C组饲服0.31 g/(kg·d)益脉康分散片悬混液;D组饲服9.67 g/(kg·d)青光安II号方悬混液;E、F、G组饲服0.85 g/(kg·d)、1.70 g/(kg·d)、3.40 g/(kg·d)青光安II号方有效组分悬混液(按“人-动物体表面积等效剂量比值表”折算,相当于成人等效剂量的1/2倍、1倍、2倍)。
1.2.4 取材 干预第4周后,将各组小鼠行颈椎脱臼处死,迅速取出眼球,在解剖显微镜下用眼科显微器械沿角巩膜缘剪开,除去眼前节及玻璃体,迅速剥离出视网膜组织,置入EP管中,标记组别、序号及眼别,再放入液氮罐中保存,供Western blot检测各组视网膜RhoA、ROCK和Caspase-3蛋白相对表达量。
1.2.5 指标检测方法 从液氮罐中取出视网膜组织,每组每两张视网膜组织为1个样本,每组检测8个样本。视网膜组织加入RIPA裂解液充分裂解、匀浆、离心,离心后取上层清液制成总蛋白溶液。用BCA蛋白浓度测定试剂盒测蛋白浓度。根据测定样品的吸光值,在标准曲线上查得其相应的蛋白含量。制备样品并计算上样量,然后进行蛋白变性。灌胶上样后进行电泳,将蛋白质电泳到凝胶上。将修剪好的PVDF膜浸入甲醇中使其活化后进行转膜,使凝胶上的蛋白质能转移至膜上。室温下将转好的膜在脱色摇床上封闭,孵育各指标一抗(兔抗-RhoA、兔抗-ROCK、兔抗-Caspase-3多克隆抗体)、二抗(HRP标记-山羊抗兔)。在暗室环境下加入ECL溶液,充分反应后曝光,曝光后的胶片进行试剂显影和定影。将定影后的胶片进行扫描存档,并用PhotoShop整理去色,随后采用AlphaEaseFC软件分析系统进行灰度值分析,分析各目标蛋白的灰度值,即表示蛋白表达量。
1.3 统计学方法
采用SPSS 21.0统计软件对实验结果进行分析。先进行正态性分布及方差齐性检验:若满足正态性和方差齐性,则采用单因素方差分析;多重比较采用LSD法;若不符合正态分布或方差齐性,则采用秩和检验;计量资料以“x±s”表示。均以P<0.05为差异有统计学意义。
2 结果
2.1 眼压检测结果
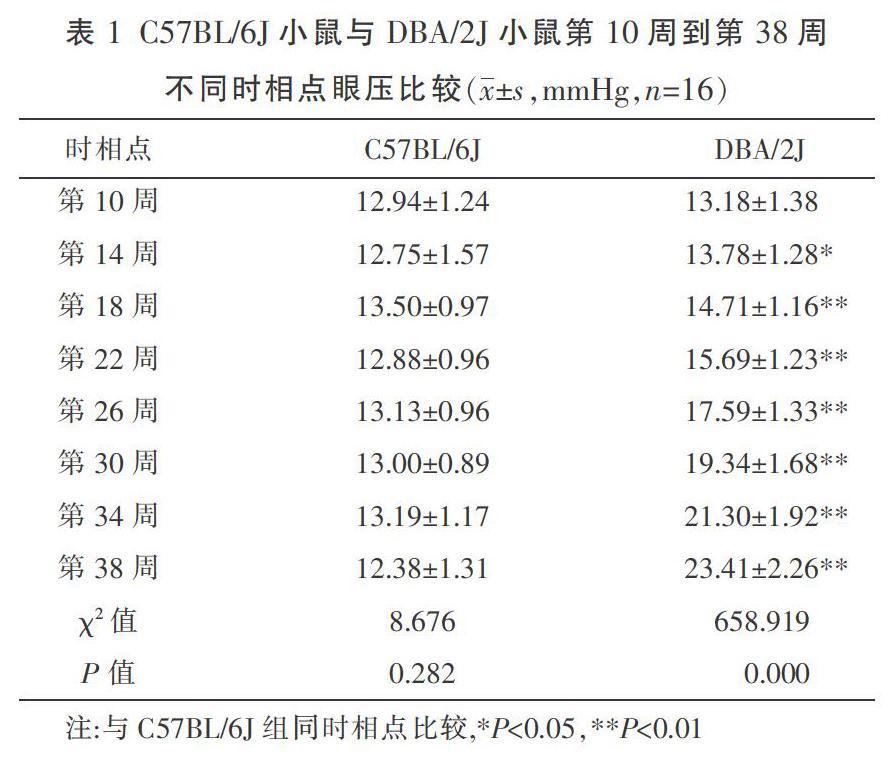
8只(16眼)C57BL/6J小鼠在第10周至第38周眼压一直波动在10~16 mmHg。48只(96眼)DBA/2J小鼠在第10周到第22周之间逐渐上升,到了第26周及以后,眼壓明显上升。DBA/2J小鼠与C57BL/6J小鼠第10周到第38周不同时相点眼压比较,见表1。
组内不同时点眼压比较:由于C57BL/6J和DBA/2J组的各个时间点不符合正态分布,同一个小鼠重复测量8次,故用多个相关样本的非参数Friedman检验。C57BL/6J组内不同时相点的眼压比较差异均无统计学意义(?字2=8.676,P=0.282),说明C57BL/6J小鼠在第10周到第38周内眼压是没有显著差异;DBA/2J组内不同时点眼压比较差异有统计学意义(?字2=658.919,P=0.000),说明DBA/2J小鼠在第10周到第38周内眼压是有显著差异,眼压随着时间的增长而增加。
同一时间点不同组眼压比较,经检验不符合正态分布,故用两个独立样本非参数Mann-Whitney U检验,从第14周开始,两组小鼠的眼压就开始差异有统计学意义(z=-2.495,P=0.011),之后的差异更加明显(P<0.01),DBA/2J组从第14周开始明显是高于C57BL/6J组。
2.2 眼前节检查
眼前段裂隙灯检查发现,C57BL/6J小鼠从第10周到第38周之间,眼前段未见明显异常,角膜透明,虹膜纹理清晰,瞳孔居中而圆,晶状体透明,对复方托吡卡胺滴眼液反应灵敏,见图1-2。
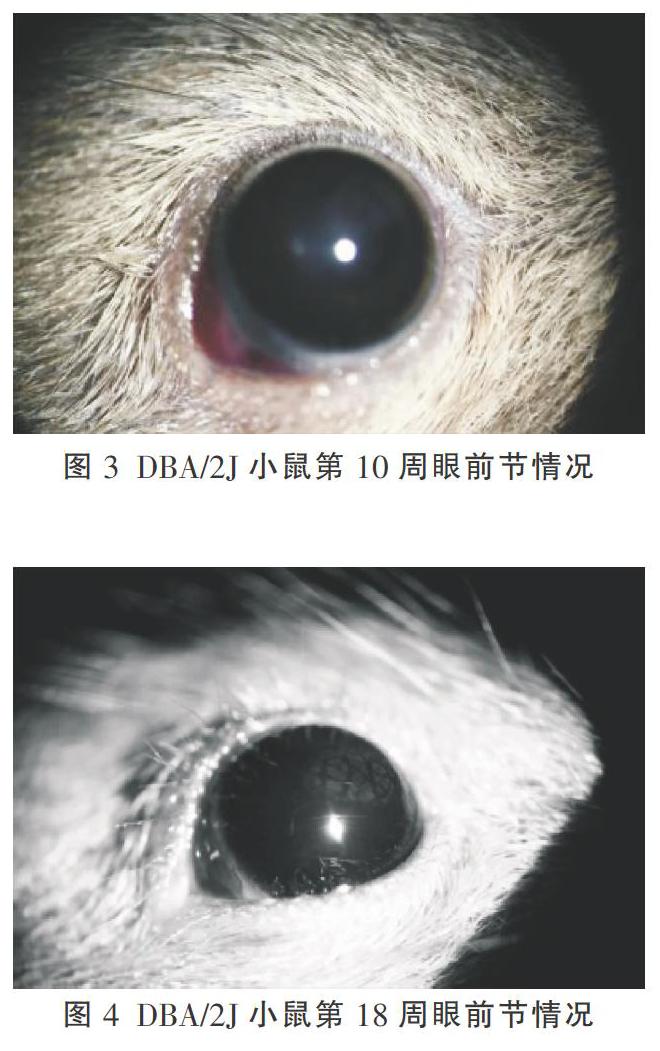
DBA/2J小鼠在第10周龄时即被发现有角膜钙化斑,见图3;随着周龄延长角膜钙化斑逐渐加重,到第18周龄时大多数DBA/2J小鼠出现明显的角膜钙化斑密集成片,见图4;到第30周龄左右DBA/2J小鼠虹膜色素脱失播散,局部出现虹膜透照,虹膜基质萎缩,瞳孔后粘连,到第38周龄时虹膜色素脱失加重,瞳孔移位,部分并发白内障,见图5。
2.3 Western blot检测各组视网膜RhoA、ROCK和Caspase-3蛋白相对表达量
通过Western blot检测各组视网膜RhoA、ROCK和Caspase-3蛋白相对表达量,发现各组蛋白数据均符合正态分布,方差齐同,经过单因素方差分析检验,各组RhoA、ROCK和Caspase-3蛋白相对表达差异具有统计学意义(F=16.507,P=0.000;F=36.241,P=0.000;F=15.068,P=0.000)。
各组RhoA、ROCK、Caspase-3两两比较:与空白组比较,模型组视网膜RhoA、ROCK、Caspase-3表达量明显升高,差异有统计学意义(P<0.05),说明青光眼视神经损害的发生发展中Rho/ROCK信号通路激活;与模型组比较,益脉康分散片组、青光安II号方汤剂组、青光安II号方有效组分低、中、高剂量组RhoA、ROCK、Caspase-3表达量均明显降低,差异有统计学意义(P<0.05),说明益脉康分散片、青光安II号方及其不同浓度有效组分皆可通过抑制Rho/ROCK信号通路抑制视网膜神经节细胞的凋亡,减缓青光眼视神经损害;与益脉康分散片组比较,青光安II号方汤剂组、青光安II号方有效组分低、中浓度组RhoA、ROCK、Caspase-3蛋白相对表达差异无统计学意义(P>0.05);与益脉康分散片组和青光安II号方汤剂组比较,青光安II号方有效组分高剂量组RhoA、ROCK、Caspase-3表达量降低,差异有统计学意义(P<0.05)。见表2、图6。
3 讨论
青光眼的视神经保护对保存患者视力、减缓视功能损失具有重要意义。目前,常用的视神经保护药物有钙离子通道阻滞剂、抗氧化剂、抑制谷氨酸兴奋性毒性药物、神经营养因子等[12-13],但治疗效果大都不令人满意,或者有不良反应产生,拥有丰富天然药物资源的中医药在青光眼视神经保护领域拥有广阔的前景,具有创新药物的潜力。
青光眼相当于中医的五风内障。《秘传眼科龙木论卷一·五风变内障》曰:“此眼初患之时,亦是脏腑虚劳,肝风为本。”前期基础和临床研究中发现青光眼中晚期视神经病变患者肝肾亏虚与血瘀水停同存[2,14-22],肝肾精血亏虚,则水血互累,血瘀水停,脉络瘀滞,故青光眼晚期视神经病变基本病机总结为气阴亏虚、脉络瘀滞。根据青光眼视神经损伤的中医发病机制,对青光安颗粒剂的组方进行优化,研发出以滋补肝肾、益气活血为治法的青光安Ⅱ号方[2]。青光安Ⅱ号方由枸杞、女贞子、灯盏花、黄芪等药组成。本方重用枸杞、女贞子,取其滋补肝肾、益精明目之功;另加黄芪补气健脾,生精养血,补益机体正气,扶正以驱邪外出,寓有“正气存内,邪不可干”之意,并能利水;灯盏细辛活血。全方补益扶正与活血利水驱邪同存,补通兼施,使目窍通畅,气血调和。青光安II号方前期实验研究表明:青光安II号方可抑制RGCs的凋亡,提高RGCs的存活率,起到保护视神经的作用[2];体外细胞学实验表明,青光安II号方能够很好地保护视网膜组织,维持视网膜神经节细胞的形态结构正常并减少其凋亡[20-22]。
近来多项研究表明,Rho/ROCK信号通路在降低眼压、保护RGCs及改善眼部血流量方面为青光眼治疗显示了良好的前景。Rho/ROCK信号通路是中枢神经系统内的重要信号传导系统,广泛参与细胞生长、分化和细胞凋亡等一系列生物学过程。Rho/ROCK信号通路在青光眼的发病机制中的作用主要体现在视神经损伤后,Rho/ROCK信号通路的下游分子Crmp2在视神经上表达,视网膜及视神经上RhoA和ROCK蛋白相对表达量上调,凋亡相关蛋白Caspase-3表达逐渐升高[5-6],出现视网膜、视神经的形态学明显改变,如视神经轴突肿胀、轴突数目减少,髓鞘松解变性,板层结构分离,神经间质基质密度降低等[23-25];同时Rho激活下游的关键靶效应分子ROCK引起轴突生长锥塌陷,抑制轴突生长;也可作用于细胞骨架蛋白,进而抑制轴突末端生长锥的延伸及神经节再生。研究表明阻断Rho/ROCK信号通路可抑制RGCs的凋亡,提高RGCs的存活率,从而起到保护神经的作用[7,26-27]。
本实验以Rho/ROCK信号通路为切入点,通过检测Rho/ROCK信号通路中的RhoA及其下游蛋白ROCK、凋亡相关蛋白Caspase-3,观察青光安II号方有效组分对青光眼视神经损害小鼠模型视网膜RhoA、ROCK、Caspase-3蛋白的相对表达量的影响,探析青光眼II号方及其有效组分基于Rho/ROCK信号通路的对青光眼实验动物模型视网膜的保护作用。
本实验采用了DBA/2J小鼠作为青光眼实验动物模型。DBA/2J小鼠自发性青光眼模型是近年来基于转基因技术的应用最为广泛的年龄相关性、进展性自发性高眼压实验动物模型。DBA/2J小鼠第8~9月龄开始出现视网膜神经节细胞凋亡和视神经的变性,到第18月龄时,90%以上的视神经严重变性,视功能几乎全部丧失。DBA/2J小鼠视网膜神经节细胞凋亡率最大可以达到90%以上[28],是作为青光眼模型的良好造模实验动物,在探讨压力相关性视神经节细胞凋亡、视神经变性机制和评估视神经保护药物疗效等方面应用广泛。本实验动态观察DBA/2J小鼠与空白组C57BL/6J小鼠眼压、眼前节变化,第14周开始DBA/2J小鼠眼压与C57BL/6J小鼠眼压组间比较具有差异性,且第38周龄时DBA/2J小鼠眼压较前明显升高,裂隙灯下可见角膜钙化斑、虹膜色素脱失、瞳孔移位、部分并发白内障,表明DBA/2J小鼠青光眼实验动物模型造模成功。
本研究发现青光眼动物模型DBA/2J小鼠视网膜RhoA、ROCK、Caspase-3蛋白表达升高,益脉康分散片、青光安II号方汤剂及青光安II号方有效组分低、中、高剂量均可以降低DBA/2J小鼠视网膜RhoA、ROCK、Caspase-3蛋白的表达,抑制其活性,其中青光安II号方有效组分高剂量组降低视网膜RhoA、ROCK、Caspase-3蛋白的效果更为明显。实验研究表明在青光眼视神经损害的发生发展中Rho/ROCK信号通路激活,益脉康分散片、青光安II号方及其不同浓度有效组分皆可抑制DBA/2J小鼠视网膜RhoA、ROCK、Caspase-3蛋白的表达,推测青光安II号方治疗青光眼的机制可能与其抑制Rho/ROCK信号通路及视网膜细胞凋亡相关蛋白表达有关。
参考文献
[1] 吴姗姗,田庆梅,高延娥,等.青光眼视神经节细胞凋亡的作用机制研究进展[J].眼科新进展,2019,39(9):882-885.
[2] 周亚莎,徐 剑,彭 俊,等.青光安Ⅱ号对慢性高眼压模型大鼠视网膜GSK-3β及β-catenin mRNA表达影响[J].湖南中医药大学学报,2017,37(10):1049-1051.
[3] YADAV K S, SHARMA S, LONDHE V Y. Bio-tactics for neuroprotection of retinal ganglion cells in the treatment of Glaucoma[J]. Life Sciences, 2020, 243: 117303.
[4] 彭清华.眼科活血利水法的基础研究[J].湖南中医药大学学报, 2009,29(5):14-18.
[5] 何理烨,梁 亮.Rho/ROCK通路抑制剂在青光眼中的研究进展[J]. 海南医学,2016,27(13):2161-2164.
[6] 于江龙.Rho激酶抑制剂对兔外伤性视神经损伤保护作用的实验研究[D].乌鲁木齐:新疆医科大学,2015.
[7] YAMAMOTO K, MARUYAMA K, HIMORI N, et al. The novel Rho kinase (ROCK) inhibitor K-115: a new candidate drug for neuroprotective treatment in Glaucoma[J]. Investigative Ophthalmology & Visual Science, 2014, 55(11): 7126-7136.
[8] 彭清華.基于TGF-β/Smad3信号传导系统的抗青光眼术后滤过道瘢痕化的中药高通量筛选体系的建立[C]//世界中医药学会联合会眼科专业委员会、中国中西医结合学会眼科专业委员会、中华中医药学会眼科分会.世界中医药学会联合会眼科专业委员会第五届学术年会、中国中西医结合学会眼科专业委员会第十三届学术年会、中华中医药学会眼科分会第十三届学术年会、中国(河北)第二届国际眼科学术研讨会论文汇编.邢台:世界中医药学会联合会眼科专业委员会、中国中西医结合学会眼科专业委员会、中华中医药学会眼科分会:中华中医药学会,2014:64-65.
[9] 姚小磊.基于TGF-β1与Bcl-2的抗干眼症中药高通量筛选体系的建立[D].长沙:湖南中医药大学,2010.
[10] 杨 帆,吴玲玲,郭秀娟,等.青光眼动物模型DBA/2J小鼠的眼部特征及组织学观察[J].眼科研究,2010,28(2):103-108.
[11] WANG JING|DONG Y U. Characterization of intraocular pressure pattern and changes of retinal ganglion cells in DBA2J glaucoma mice[J]. International Journal of Ophthalmology, 2016,9(2):211-217.
[12] 邰 雪,申 颖.青光眼药物治疗进展[J].内蒙古医科大学学报, 2019,41(S1):271-277.
[13] 于莎莎,赵 云,汤 欣.视神经损伤药物治疗的研究进展[J].眼科新进展,2019,39(3):291-295.
[14] 彭清华,孙学争,戴宗顺.活血利水法在眼科的临床运用[J].中国中医药现代远程教育,2014,12(5):128-131.
[15] 彭 俊,曾志成,谭涵宇,等.眼科活血利水法的基础研究进展[J]. 眼科新进展,2010,30(6):585-589,593.
[16] 曾志成,彭 俊,谭涵宇,等.活血利水法治疗眼科疾病的临床研究进展[J].湖南中医药大学学报,2010,30(7):74-78.
[17] 东长霞,彭 俊,彭清华,等.中药青光安对急性高眼压兔视网膜组织结构及细胞凋亡的影响[J].国际眼科杂志,2010,10(1):51-54.
[18] 赵海滨,彭清华,吴权龙,等.青光安颗粒对兔急性高眼压视神经轴突的保护作用[J].国际眼科杂志,2009,9(12):2318-2321.
[19] 彭 抿,彭清华,李建超,等.青光安颗粒剂含药血清对体外培养大鼠视网膜神经节细胞调亡的实验研究[J].医药世界,2006,7(7):84-85.
[20] 周亚莎,徐 剑,刘 悦,等.青光安Ⅱ号对慢性高眼压SD大鼠模型中视网膜PAX6和Ngn1及Ngn2 mRNA表达的影响[J].国际眼科杂志,2017,17(9):1631-1634.
[21] ZHOU YS, XU J, PENG J, et al. Effect of Qingguangan II on expressions of OX42 protein and IL-1β mRNA of retinal microglia cells of rats with chronic high intraocular pressure[J]. International Journal of Ophthalmology, 2018,11(2):326-328.
[22] 刘 悦,周亚莎,徐 剑,等.青光安Ⅱ号方对慢性高眼压大鼠视网膜热休克蛋白的影响[J].中国中医眼科杂志,2017,27(5):281-285.
[23] 宋海珊,高殿文.Rho/ROCK信号通路与青光眼[J].大连医科大学学报,2012,34(1):88-91.
[24] 崔红培,庄曾渊.Rho/ROCK信号通路与视神经疾病[C]//中华中医药学会第七次眼科学术交流会论文集.贵阳:中华中医药学会眼科分会,2008:217.
[25] FENG Y B, LOGRASSO P V, DEFERT O, et al. Rho kinase (ROCK) inhibitors and their therapeutic potential[J]. Journal of Medicinal Chemistry, 2016, 59(6):2269-2300.
[26] 孔祥芬.Rho激酶抑制剂对视神经损伤保护作用的研究进展[D]. 石家庄:河北医科大学,2018.
[27] 陈文诗,宋 娜,张雨晴,等.Rho激酶抑制剂在青光眼治疗中的应用进展[J].国际眼科杂志,2019,19(8):1313-1316.
[28] 李佰龍,孟 慧,沈兰珂.慢性高眼压动物模型研究进展[J].世界最新医学信息文摘,2019,19(63):53-54.
