外源抗生素对栽培作物与野生植物的氧化胁迫及其富集转运的差异性
2020-07-16DebelaSisayAbebe华倩雯陈欣瑶
武 剑,Debela Sisay-Abebe,华倩雯,陈欣瑶,张 园
(苏州科技大学环境科学与工程学院,江苏 苏州 215009)
抗生素在畜禽养殖业中通常作为添加剂用于提高动物产品产量,但因其过度使用以及难以被动物完全吸收,导致其不断排放并累积在外部环境中[1],并已成为颇受关注的污染物类型[2]. 施用畜禽粪便是耕地土壤中抗生素污染的主要外来源之一[3],据报道,粪便中的抗生素典型浓度范围在1 mg/kg~10 mg/kg[4-5],其中猪粪检测到最高量可达134.2 mg/kg[6]. 在长期施用畜禽粪便的土壤中,各类抗生素同样有着不同的检出,其中以四环素类、磺胺类和喹诺酮类抗生素的检出率最高[7-8].
外源抗生素从土壤中转移至植物体内及其毒理效应的研究屡见不鲜,目前已在多种植物中发现了抗生素,如胡萝卜、生菜、玉米等[9-11]. Riaz等[12]研究表明高浓度抗生素通过引起氧化应激而抑制小麦生长,迟荪琳等[13]研究发现四环素类抗生素浓度超过50 mg/kg就会对蔬菜产生氧化胁迫. 长期生长在污染环境中的野生植物与初次引入到该环境中的栽培作物对污染物的响应存在一定的差异性,有研究表明野生植物对逆境的胁迫作用更为敏感[14],但关于野生植物与栽培作物对外源抗生素的氧化胁迫效应及富集转运差异性却少有报道. 在生产活动中,青菜、生菜、玉米和稗草、马唐、狗尾草分别作为重要经济作物和优良牧草,其转运污染物的能力也会对人类和动物健康构成威胁.
因此,本研究以养猪场内抗生素污染土壤为研究对象,选用养猪场内的3种优势野生植物(稗草、马唐、狗尾草)和3种栽培作物(青菜、生菜、玉米)作为试验作物,研究猪粪引入的外源抗生素对野生植物和栽培作物抗氧化酶活性的影响及抗生素在植物体内的富集和转运特征,比较两者对外源抗生素的氧化胁迫和富集转运能力的差异性. 以期为抗生素污染土壤中的植物生态风险评价累积资料,特别是集约化养殖场搬迁后的遗留地块和长期施用粪便的土壤进行安全生产活动,以及短期培养在该环境下作物的生态安全性都有着一定的参考价值.
1 材料与方法
1.1 供试材料
供试野生植物为禾本科的稗草、马唐及狗尾草,种子采自于苏州某养猪场内,为养猪场内优势种群植物;供试栽培作物为十字花科的青菜、菊科的生菜及禾本科的玉米,种子购于种子市场. 供试抗生素污染土壤采自苏州某养猪场内长期接受猪粪施用的土壤,供试无抗生素污染土壤采自苏州市东山镇未施过有机肥的农田土耕层土壤(0 cm~20 cm),其基本理化性质见表1.
本实验选用的3种四环素类(TCs)抗生素(四环素(TC)、土霉素(OTC)和强力霉素(DOX)),3种磺胺类(SAs)抗生素(磺胺嘧啶(SD)、磺胺二甲基嘧啶(SM2)和磺胺甲恶唑(SMX)),以及3种喹诺酮类(QNs)抗生素(恩诺沙星(ENR)、环丙沙星(CIP)和诺氟沙星(NOR)),其纯度均大于99.0%. 甲醇、乙腈、正己烷均为色谱级,其他化学试剂均为分析纯. 固相萃取小柱为Oasis HLB(6 mL,200 mg).
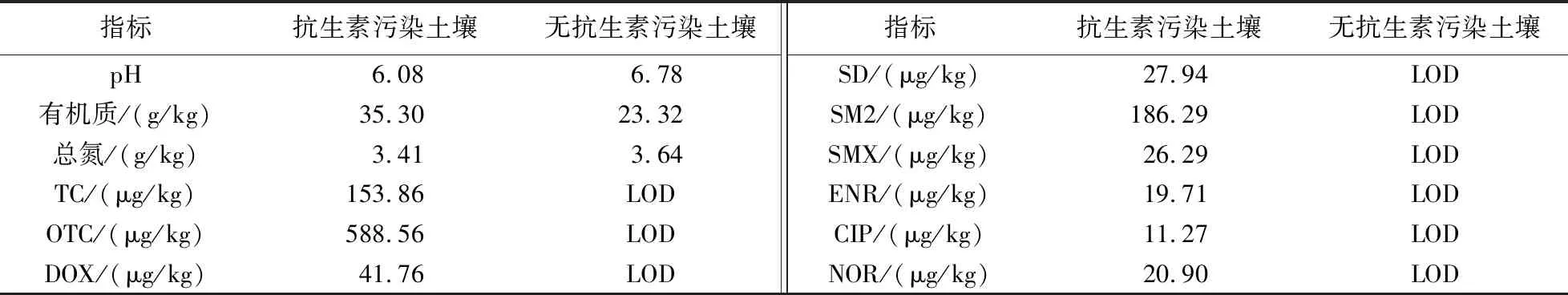
表1 土壤的基本理化性质Table 1 Basic physical and chemical properties of soil
注:LOD表示低于仪器检出限.
1.2 实验设计
盆栽实验于2019年1月20日至2019年3月21日在温室大棚中进行. 土壤处理分为外源抗生素污染组和无抗生素污染组,分别种植栽培作物(青菜、生菜、玉米)和野生植物(稗草、马唐、狗尾),每个处理 3个重复,同时放置3盆不种任何植物的抗生素污染土壤作为空白对照(盆栽实验的设计见图1). 植物种子在0.02%赤霉酸溶液中浸泡24 h以打破休眠,每个塑料盆中装入不同处理的2 kg风干过筛(3 mm)土壤,将植物种子分别撒在不同的塑料盆中,调节含水率至田间持水量的70%左右,正常光照条件下,温度控制在(25±1)℃. 植株于60 d后收获,收获后的植物分为地下部分(根)和地上部分(叶),用去离子水洗掉上面残留的土壤颗粒,一部分冻干测定抗生素含量,一部分立即测定生理指标;土壤样品采集于植物根部抖落下来的根际土壤,冻干后用于测定抗生素含量.
1.3 测定项目与方法
1.3.1 植物抗氧化酶活性和丙二醛含量
测定方法参考前人的研究[15]:超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)法,SOD活性单位以抑制NBT光化还原50%所需酶量为1个酶活单位;过氧化物酶(POD)采用愈创木酚法,以每分钟OD值升高1.0为1个酶活性单位;过氧化氢酶(CAT)采用紫外分光光度法,以每分钟OD值减少0.01为1个酶活性单位;丙二醛(MDA)采用硫代巴比妥酸法(TBA).
1.3.2 土壤和植物中抗生素的测定
样品的前处理采用固相萃取法(SPE),处理过程主要参考文献[16-17],有部分改动:准确称取冻干的2.0 g土壤和植物样品(研磨过筛)于50 mL离心管中,加入15 mL萃取剂(0.1 mol/L的Na2EDTA-McllVaine),涡旋混匀后超声15 min,之后5 000 rpm离心15 min,将上清液转移至新的50 mL离心管中,重复3次,合并上清液. 植物样品提取液加入10 mL正己烷脱脂3次,收集下层液体. 上清液于40 ℃ 水浴下氮吹浓缩至10 mL,过0.45 μm滤膜后加纯水稀释至500 mL准备进行过柱,用10 mL甲醇、10 mL超纯水依次活化固相萃取小柱. 将稀释后的萃取液以5 mL/min的速度通过萃取小柱,之后用10 mL超纯水淋洗小柱,继续抽真空10 min以除去柱中残留水分,最后用10 mL甲醇(含1.0%甲酸)洗脱,收集洗脱液,在氮气浓缩仪上吹至近干,用甲醇定容至1 mL,过0.22 μm有机系滤膜,待测.
1.3.3 HPLC-MS/MS分析与质量控制
采用HPLC-MS/MS(Ultimate 3000 型高效液相色谱仪,TSQ Quantum Ultra EMR三重四极杆质谱仪)测定. 色谱条件:色谱柱Waters ACQUITY UPLC BEH C18column(1.7 μm,2.1 mm×100 mm). 流动相A为0.1%甲酸水溶液,流动相B为乙腈;进样体积5 μL;流速0.3 mL/min;柱温30 ℃. 测定时采用的流动相梯度如表2.
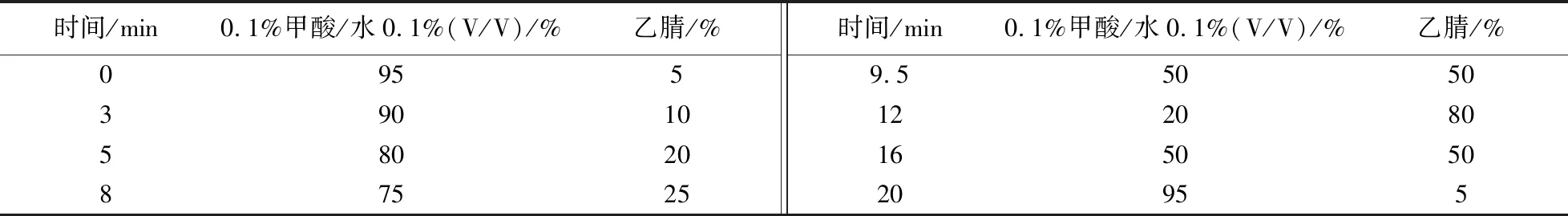
表2 HPLC测定流动相梯度Table 2 Mobile phase for the gradient of HPLC
质谱条件:采用加热电喷雾正离子源(ESI+),选择反应监测模式(SRM). 喷雾器电压为3.5 kV,喷雾器温度为250 ℃,鞘气和辅助气压力分别为35 psi和5 psi,离子传输毛细管温度为300 ℃,碰撞气压力为0.1 Pa,进样方式为自动进样.
3类抗生素的检测限(LOD)分别为TCs:0.030 μg/kg~0.060 μg/kg,SAs:0.006 μg/kg~0.010 μg/kg,QNs:0.014 μg/kg~0.031 μg/kg. 采用加标法测定3类抗生素的回收率,其回收率为TCs:71.1%~107.54%,SAs:67.2%~82.6%,QNs:61.4%~72.9%,回收率的标准偏差(RSD)均低于8%,表明该方法的准确度和精密度均符合样品分析要求.
1.4 数据分析
用Excel 2016和SPSS 20对数据进行分析,对不同处理数据进行单因素方差分析(ANOVA)和Duncan多重比较,数据以(平均值±标准差)表示,用Origin 2018进行绘图. 植物对抗生素的富集和转运能力分别用生物浓缩系数(BCF)和转运系数(TF)表示,计算公式:BCF=Cp/Cs,其中Cp:抗生素在植物不同部位的浓度(μg/kg);Cs:抗生素在土壤中的浓度(μg/kg);TF=Ca/Cu,其中Ca:植物地上部分抗生素浓度(μg/kg);Cu:植物地下部分抗生素浓度(μg/kg).
2 结果与讨论
2.1 外源抗生素对栽培作物和野生植物抗氧化酶活性及MDA含量的影响
2.1.1 地下部分的抗氧化酶活性和MDA含量
由图2可知,在抗生素处理下,栽培作物和野生植物的地下部分抗氧化酶活性和MDA含量变化不同. 如图2(a)所示,抗生素处理对栽培作物和野生植物地下部分的SOD活性有着不同程度的抑制作用,其中栽培作物较CK降低了64.57%~105.52%,野生植物较CK降低了37.17%~56.91%,这可能是由于植物的抗氧化系统具有一定的限度,当超过这个限度时抗氧化酶活性将会迅速降低并受到一定的毒害作用[13,18]. 栽培作物和野生植物地下部分的POD活性在抗生素处理下显著增加,其中栽培作物的变化较大,栽培作物SC的地下部分较CK增加了414.61%(图2(b));栽培作物和野生植物地下部分的CAT活性较CK分别增加了121.10%~169.79%和20.46%~29.43%,这说明栽培作物地下部分在抗生素处理下更加敏感(图2(c)).
植物体内MDA的产生表明其正受到外界胁迫作用,此时需要植物产生更多的抗氧化酶来清除过量的活性氧自由基(ROS)[19],并且相关研究表明外源抗生素是胁迫植物产生MDA的生物指标之一[20]. 在抗生素处理下,本研究中栽培作物地下部分的MDA含量显著增加,是其CK的4.19~5.62倍,而野生植物的地下部分的MDA含量均无显著变化,这进一步说明外源抗生素对栽培作物地下部分的胁迫作用更大(图2(d)).
2.1.2 地上部分的抗氧化酶活性和MDA含量
如图3(a)所示,抗生素处理对栽培作物和野生植物的地上部分SOD活性总体上表现出抑制作用,两者较CK分别下降了178.24%~260.00%和24.64%~168.14%,栽培作物受到的抑制作用更明显;栽培作物和野生植物地上部分的POD活性在抗生素处理下均显著增加,其中栽培作物是其CK的3.56~9.81倍,野生植物是其CK的1.36~3.36倍,这表明外源抗生素对栽培作物的地上部分的POD活性的影响要大于野生植物的地上部分(图3(b));对于CAT活性,栽培作物地上部分的CAT活性在抗生素处理下较CK提高了20.85%~61.98%,而野生植物的地上部分较CK却没有显著变化(图3(c));抗生素处理显著增加了栽培作物地上部分的MDA含量,较CK高374.50%~653.19%,其中栽培作物YM的地上部分MDA含量最高,是其他3种野生植物地上部分的3.68~5.26倍,相比野生植物地上部分的MDA含量较CK的变化,栽培作物地上部分对外源抗生素的胁迫作用则更为敏感(图3(d)).
以上的分析表明,不论地上部分还是地下部分,栽培作物受到外源抗生素的胁迫作用在一定程度上都要大于野生植物,但由于野生植物在抗生素污染环境中经过自然选择,可能对抗生素具有一定的耐受性,因此其可能对抗生素有着更好的适应性,并且本研究的结果也印证了这一点,因此关于抗生素对栽培作物和野生植物抗氧化酶活性的影响及作用机制还需进一步探讨.
2.2 抗生素在栽培作物和野生植物中的含量和根际土壤中的残留量
经检测,种植在无抗生素污染土壤的栽培作物和野生植物中均未检测到9种目标抗生素,因此本文不对其进行讨论,重点讨论种植在抗生素污染土壤中的栽培作物和野生植物对抗生素的富集转运.
由图4可知,抗生素在栽培作物和野生植物及其不同部位中的含量不同. 对于地下部分,栽培作物中抗生素的总含量均显著高于野生植物,其中以栽培作物QC的抗生素含量最高,是野生植物的1.58~2.33倍;对于地上部分,整体上栽培作物中抗生素的总含量高于野生植物(除野生植物BC外). 另外,栽培作物和野生植物的不同部位中均残留了TCs,而QNs仅在栽培作物QC和SC的地下部分有残留,这可能是由于土壤中残留的QNs浓度本来就相对较低,两者同一部位中抗生素的积累量均为TCs>SAs>QNs,以上分析一定程度上表明栽培作物富集抗生素的能力强于野生植物.
由图5可知,栽培作物和野生植物对收获时根际土壤中抗生素的残留量也有着一定的影响. 与空白对照土壤(60 d)相比,TCs在栽培作物和野生植物的根际土壤中分别下降了9.26%~27.28%和5.51%~14.12%,SAs下降了11.25%~17.68%和8.61%~15.67%,而QNs在根际土壤中则相对稳定,无明显的变化. 所有根际土壤样品中抗生素的总残留量均呈显著下降趋势,下降了约7.40%~22.19%,这表明栽培作物和野生植物都可以降低土壤中抗生素的残留量. 整体上,野生植物根际土壤中抗生素的总残留量要高于栽培作物,并且其体内抗生素的含量也低于栽培作物,即植物体内抗生素残留的量越少,土壤中抗生素残留的量即越多,反之亦然.
2.3 栽培作物和野生植物对抗生素的富集转运特征
由表3可知,栽培作物和野生植物地下部分对TCs的富集系数分别为0.026~0.035和0.017~0.020,这说明栽培作物地下部分富集TCs的能力要大于野生植物的地下部分;3种栽培作物地下部分都可以富集SAs,而野生植物仅有BC可以富集;QNs仅有栽培作物QC和YM的地下部分可以富集,野生植物均无法富集. 同样两者地上部分对TCs的富集能力也表现为栽培作物大于野生植物. 整体上,栽培作物的地下、地上部分富集抗生素的能力都要高于野生植物,且两者相同部位对不同类型抗生素的富集能力基本一致,为TCs>SAs>QNs.
植物富集污染物的能力与植物对污染物的抵抗能力有关[21],本研究发现栽培作物对抗生素的氧化胁迫更为敏感,所以这也可能是导致栽培作物富集抗生素能力较强的原因之一. 虽然影响植物富集土壤中抗生素的因素很多,包括抗生素的种类、浓度以及植物的品种等[13],但这也在一定程度上说明,栽培作物相较于野生植物更容易吸收土壤中的抗生素. 一般来说,土壤中的污染物浓度越高,植物对污染物的吸收量也越大. 本研究中,土壤中抗生素残留量最大的为TCs,并且栽培作物和野生植物都对TCs的富集能力最高,这也进一步说明植物体内抗生素的分布与土壤中抗生素浓度有着显著的正相关[22].

表3 抗生素在栽培作物和野生植物不同部位中的生物富集系数(BCF)Table 3 Bioconcentration factors(BCF)of antibiotics in different parts of cultivated crops and wild plants
注:字母不同代表同一列的显著差异性(Duncan test;P<0.05);±后代表3个重复样品的的标准偏差;-表示抗生素浓度低于检出限,无法计算相关系数. 下同.
如表4所示,栽培作物和野生植物对抗生素的转运系数范围分别为:0.384~0.460和0.329~0.559,其中野生植物BC对TCs和SAs的转运能力均最强,其转运系数分别是栽培作物的1.24~1.52倍和1.03~1.31倍. 不论栽培作物还是野生植物,都对TCs有着较强的转运能力,这也可能与土壤中TCs的浓度较高有关. 所有植物地上部分均未检出QNs,故无法计算其转运系数,这也在一定程度上表明QNs难以被植物转运,栽培作物和野生植物对不同类型抗生素的转运能力均为TCs>SAs>QNs. 整体上,植物转运抗生素的能力为野生植物>栽培作物,这与植物富集抗生素能力为栽培作物>野生植物的结果恰好相反. 本研究只关注了短期效应,当土壤中不断地施用畜禽粪便引入抗生素,随着时间的推移转运抗生素能力强的植物其生态风险也会变大. 相关研究表明抗生素在植物中的TF还与植物蒸腾作用、生长速度、疏水性和电离能力等因素有关[23-25],因此关于栽培作物和野生植物转运抗生素的机制还需要进一步的研究.

表4 栽培作物和野生植物中抗生素的转运系数(TF)Table 4 Translocation factor of antibiotics in cultivated crops and wild plants
2.4 抗生素的含量与植物生理指标的相关性
相关性分析的结果进一步说明外源抗生素对栽培作物和野生植物的氧化胁迫程度不同(表5). 根际土壤中抗生素的含量与栽培作物地下、地上部分SOD活性呈极显著正相关(r=0.923,P<0.01;r=0.866,P<0.01),而与野生植物的SOD活性无显著相关性(P>0.05);栽培作物地上部分POD活性与其根际土壤、地上部分的抗生素含量呈(极)显著负相关(r=-0.682,P<0.05;r=-0.913,P<0.01),而野生植物地上部分POD活性却与其根际土壤、地上部分的抗生素含量呈(极)显著正相关(r=0.739,P<0.05;r=0.956,P<0.01);栽培作物地下部分的CAT活性与其对应部位的抗生素含量呈显著负相关(r=-0.267,P<0.05);野生植物地上部分MDA含量与其对应部位的抗生素含量呈显著正相关(r=0.670,P<0.05). 产生以上结果的原因可能是猪粪在引入抗生素的同时,也会导致重金属、盐、有机物等污染物进入到土壤[26-27],诱导植物产生ROS而干扰抗氧化酶的活性和MDA的含量.
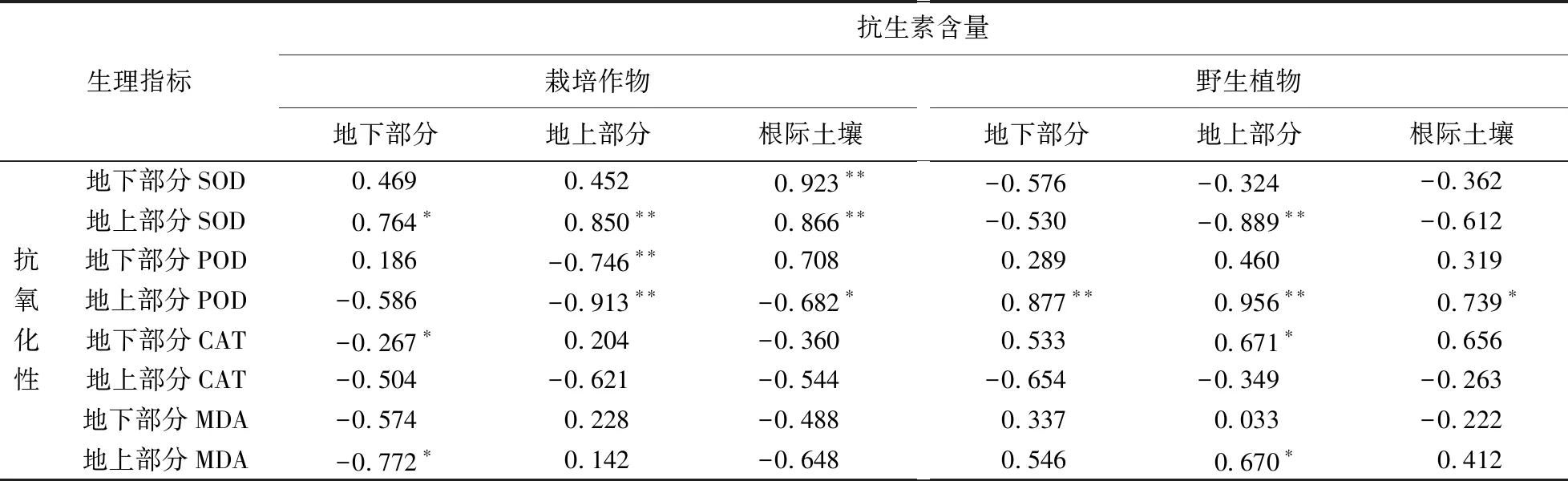
表5 植物和根际土壤中抗生素含量与植物抗氧化酶活的相关性Table 5 Correlation between antibiotic content and antioxidant enzyme activity in plants and rhizosphere soils
注:**表示在P<0.01水平(双侧)上显著相关;*表示在P<0.05水平(双侧)上显著相关.
3 结论
(1)外源抗生素对栽培作物的SOD活性呈抑制作用,并且栽培作物的MDA含量在外源抗生素处理下显著增加,特别是栽培植物玉米. 这表明栽培作物受到外源抗生素的胁迫作用更强,在抗生素污染的土壤中,要更关注短期培养的栽培作物对抗生素的响应.
(2)栽培作物和野生植物不同部位抗生素的含量基本一致,为地下部分>地上部分;两者对外源抗生素的富集能力整体上呈现:栽培作物>野生植物,但其转运抗生素的能力为野生植物>栽培作物,因此不论栽培作物还是野生植物,都具有一定的生态风险.
(3)栽培作物和野生植物对不同类型抗生素的富集能力均表现为TCs>SAs>QNs,且两者体内及其根际土壤中抗生素残留量也表现为TCs>SAs>QNs,因此在抗生素污染的土壤-植物系统中TCs的生态风险较高.
