钠长石的晶体化学基因特征及其可浮性预测
2020-07-14朱一民谢瑞琦乘舟越洋李艳军
王 燕 朱一民 谢瑞琦 乘舟越洋 李艳军
(1.东北大学资源与土木工程学院,辽宁沈阳110819;2.难采选铁矿资源高效开发利用技术国家地方联合工程研究中心,辽宁沈阳110819)
钠长石(NaAlSi3O8)为铝硅酸盐矿物,常作为脉石矿物存在于大多数的金属矿及非金属矿中,特别是在锂辉石浮选过程中,钠长石常以锂辉石的脉石矿物存在。由于钠长石与锂辉石均属于硅酸盐矿物,有较低的零电点,表面特性相似,因此钠长石与锂辉石的浮选分离困难,分离效率低[1]。钠长石和锂辉石分离最常用的方法为浮选法,矿物的晶体结构决定其晶体化学特征,而矿物的晶体化学特征会直接影响矿物的可浮性,进而影响浮选效果[2]。近年来,有很多学者从量子化学计算的微观角度研究矿物的晶体特征。谭鑫等[3]采用Materials Studio软件的DMol3模块计算了钨锰矿不同解理面的弛豫、电荷布居以及表面能,分析计算结果发现沿Mn—O键断裂形成的(010)面是钨锰矿的理想解理面,表面活性原子为Mn原子。付博等[4]研究了白云石的电子结构,分析计算结果发现白云石为绝缘体,Mg、Ca原子都是电子供体,在浮选过程中易发生药剂吸附的位点为Ca、Mg和O位点等。但目前基于第一性原理对钠长石矿物晶体特征进行深入研究的报道还较少。
本文基于密度泛函理论,通过对钠长石体相的Mulliken电荷布居和键布居、能带结构、态密度以及(010)面的Mulliken电荷布居和键布居、态密度、表面能进行分析并预测其可浮性,进而揭示钠长石的晶体结构及其对浮选效果的影响,从微观角度为钠长石与锂辉石的浮选分离研究提供理论参考。
1 计算方法与模型
1.1 晶胞模拟与计算
采用基于密度泛函理论的Materials Studio软件的CASTEP模块对钠长石的体相晶胞进行几何优化,从而确定合理的计算参数以及稳定的钠长石晶体结构[5]。几何优化采用BFGS算法,自洽迭代过程中体系能量改变、原子间作用力、原子间内应力和原子位移,收敛标准分别设为2×10-5eV/atom、0.5 eV/nm、0.1 GPa、2×10-4nm。几何优化的基本参数设为:交换相关泛函为广义梯度函数GGA中的PBESOL关联系数;k点取样密度为2×2×4,平面波截断能为700 eV。优化计算所得钠长石的晶胞参数与试验检测参数对比如表1所示。

由表1可知,计算所得的晶胞参数与试验检测所得的晶胞参数较接近,相对误差仅为0.56%,表明优化计算所选取的参数和采用的方法具有代表性。
将优化计算后的钠长石晶胞模型的XRD图与检测所得的钠长石纯矿物的XRD图做对比,结果见图1。
由图1分析可知,模拟计算的钠长石的XRD图谱与钠长石纯矿物的实测XRD图谱较吻合。结合表1和图1可说明,优化计算后的钠长石晶胞模型与实际钠长石纯矿物的晶体结构相符,具有代表性,可以采用Materials Studio软件的模拟计算结果表征钠长石的晶体结构。优化后的晶胞结构见图2。
1.2 表面模型构建


在优化后的钠长石晶胞基础上,构建钠长石表面模型。根据文献[6]报道,钠长石(010)面为最可能的解理面。当切割层数为3,真空层厚度为1.5 nm时,表面可以维持稳定的表面性能,随着切割层数和真空层厚度增加,表面能等特性变化不大,但计算时间变长,因此本文沿米勒指数(010)方向切割钠长石晶胞,切割层数为3,真空层厚度为1.5 nm。对切割后的表面进行优化,表面优化参数选取与晶胞优化参数一致,对于优化后的结构再进行性质分析。
1.3 表面能计算
表面能是沿一个晶体表面的方向将矿物晶体分成2个独立的表面所需要的能量,它能够表征在形成新表面时对分子之间各种化学键的破坏程度。表面能计算公式如式(1)所示:

式中,Esurf表示表面能,J/m2;Eslab和Ebulk分别表示模拟计算所得到的表面模型和体相模型的能量,J;Nslab和Nbulk分别表示表面模型和体相模型的原子个数;A表示所计算表面的面积,m2。
2 计算结果及讨论
2.1 钠长石体相分析
2.1.1 Mulliken布居分析
钠长石原胞中各原子游离态的价电子构型为O 2s22p4、Na 2s22p63s1、Al 3s23p1、Si 3s23p2,经优化计算后体相中各体相原子的Mulliken电荷布居如表2所示。

由表2可知:钠长石原胞体相优化后,氧原子的价电子构型有8种,分别为O 2s1.852p5.34、O 2s1.842p5.30、O 2s1.852p5.31、O 2s1.812p5.34、O 2s1.862p5.39、O 2s1.832p5.30、O 2s1.852p5.30、O 2s1.822p5.32,在氧原子中,2s轨道失去的电子少,2p轨道得到的电子多,氧原子最后所带的电荷为负,是电子受体;经优化后的钠原子主要是s轨道失电子,钠原子的总电子数为7.86,失去了1.14 e电子,所以钠原子所带的电荷为1.14 e;铝原子在体相优化后的价电子构型为Al 3s0.463p0.78,其中3s轨道失去1.54 e电子,3p轨道失去1.22 e电子,共失去1.76 e电子,所以铝原子所带的电荷为1.76 e;硅原子在体相优化后的价电子构型有3种,分别为Si 3s0.623p1.23、Si 3s0.653p1.25、Si 3s0.643p1.29,硅原子的s轨道和p轨道都存在失电子的现象,是电子供体。
矿物的Mulliken键布居可以用来表征原子间所成键的共价性和离子性。首先原子间成键状态的布居值是大于0的;若布居值小于0,则表明原子间状态是反成键或不成键。在成键原子中,布居值越大,键的共价性越强,反之布居值越小,键的离子性越强。一般情况下,共价性越强的键其键能越大,越难断裂。此外,键长越长,键能越小,越容易发生断裂。钠长石体相的Mulliken键布居如表3所示。

分析表3可知:在优化后的钠长石晶胞中存在具有不同键布居值和键长的12种Si—O键、4种Al—O键和6种Na—O键;Si—O键的各个键布居值相比较Al—O键和Na—O键来说是最大的,这表明在这3种化学键中,Si—O键的共价性最强,离子性最弱,最不容易发生断裂;4种Al—O键的布居值最为接近或一致;而Na—O键的布居值最小,键长最长,这说明Na—O键的离子性最强,而共价性最弱,最容易发生断裂。当Na—O键断裂时,Na+会在水中溶解而交换H+,水中剩余的大量OH-与矿物表面暴露出来的Al3+、Si4+发生键合作用,这将导致在较宽的pH值范围内,钠长石表面都是荷负电的,所以选用阴离子捕收剂难以将钠长石捕收上来[7]。
2.1.2 能带结构分析
禁带宽度(Band gap)是表征半导体的重要参量,矿物的内部晶体结构和原子之间的相互结合性质都会影响到禁带宽度的大小。一般当矿物的禁带宽度大于3 eV时属于绝缘体;小于3 eV时属于半导体[8]。定义钠长石费米能级Ef为0 eV,钠长石体相能带结构如图3所示。

由图3可知,钠长石的禁带宽度为4.928 eV,且能带中还有电子满带,所以钠长石属于绝缘体。
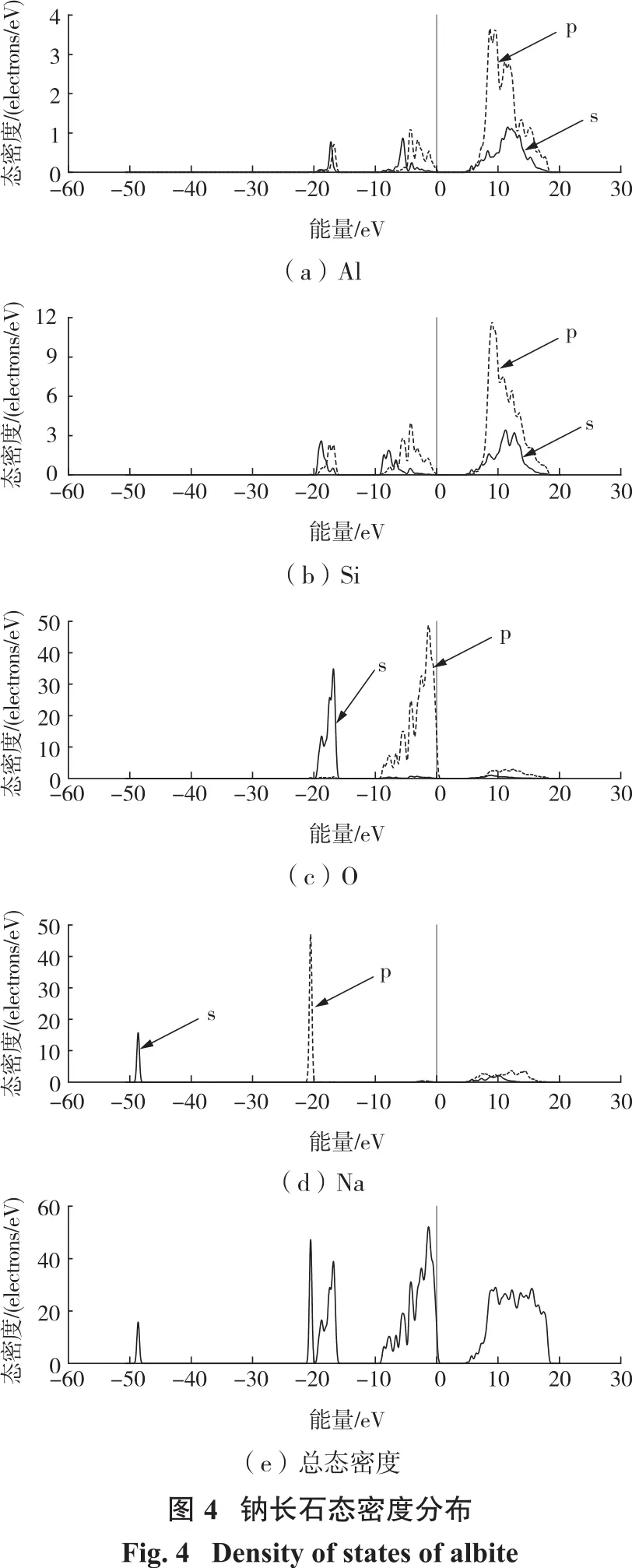
2.1.3 态密度分析
图4所示为钠长石体相态密度分布。
由图4可知:钠长石的能带范围在-50.64~20.14 eV,主要分为4个部分;在-49.45~-47.83 eV之间的价带全部由钠原子的s轨道贡献;在-21.40~-15.71 eV之间的价带,大多数由钠原子的2p轨道和氧原子的2s轨道贡献;在-9.48~0.72 eV之间的顶部价带几乎全部由氧原子的2p轨道贡献,而硅原子的3s轨道和3p轨道、铝原子的3s轨道和3p轨道只贡献极小一部分;在4.40~18.83 eV之间的导带能级主要是由硅原子的3p轨道和铝原子3p轨道组成,其余轨道也有很小一部分的贡献。在费米能级附近的态密度主要是氧原子的2p轨道贡献,因为越靠近费米能级的电子越活跃,所以在钠长石中氧原子的活性最强。
2.2 钠长石表面分析
钠长石(010)面优化后的表面结构如图5所示。对表面层原子进行Mulliken布居分析,从而了解表面层原子的带电及不同原子之间的成键情况,同时对表面能进行分析。
2.2.1 Mulliken布居分析
钠长石(010)面表面层原子的Mulliken电荷布居如表4所示。
由表4可知,钠长石(010)面优化后,表面层原子的外电子出现了一定程度的重新排布。对比表2数据可以发现,表面层氧原子的2s轨道和2p轨道上的电子发生了微弱的重新排布,2s轨道相比于体相失去的电子少了,同时2p轨道得到的电子也少了,最终氧原子所带电荷量并无太大改变;表面层硅原子考察了3种,与体相硅原子相比,外电子存在重新排布但不明显;表面层钠原子和铝原子均表现出一定的电子转移能力,铝原子的s轨道、p轨道均表现为失电子,失电子量分别为0.04 e和0.06 e,所以总电子数表现为减少,最终荷电量由体相的1.76 e增大到1.86 e;而钠原子的s轨道失去0.02 e电子,p轨道得到0.12 e电子,最终表现为得到0.10 e电子,所以电荷量由1.14 e减小到1.04 e。


对于 Si3—O3、Si1—O3、Al—O1、Al—O7 能成键是因为本文所考察的是钠长石单晶胞,而钠长石实际晶体是很多单晶胞有规律的重复单元,所以从化学理论上来看,以上化学键是可以成键并有其特有的键布居值和键长。钠长石(010)面表面层不同种类原子之间的Mulliken键布居如表5所示。
分析表5可知:钠长石表面层原子之间的键布居值和键长与体相原子的布居值与键长相比,有明显差别;对于表面层所考察的Si—O键,尤其是Si1—O4、Si2—O7的键布居值,相较于体相Si—O键的所有布居值来说,更接近于1,表明其共价性更强;但也有Si1—O2、Si1—O5、Si1—O3、Si3—O8这些键的布居值低于体相所有Si—O键的布居值,表明它们之间的相互作用有所减弱;对于表面层所考察的Al—O2键布居值为0.55,大于体相所有Al—O键的布居值,同时Al—O2的键长为0.169 251 nm,小于体相所有Al—O键的键长,表明两原子间的电子云重叠密度增大,即Al—O2键的共价性更强,相较于体相键能增强;而Al—O7键布居值仅为0.31,表明其共价性有所减弱;对于表面层所考察的Na—O4键布居值为0.11,大于体相中所有Na—O键的布居值,而键长为0.215 143 nm,小于体相中所有Na—O键的键长,表明Na—O4键的离子性有所减弱。键布居结果中,Na—O键仍然为3种化学键中最易断裂键,Na+会溶于水,所以钠长石表面荷负电,易与胺类等阳离子捕收剂发生静电吸附作用或分子吸附作用。
2.2.2 态密度分析
图6所示为钠长石(010)面表层原子态密度分布。

由图6可知,钠长石(010)面表层原子的能带分布在-53.04 eV~17.82 eV之间,在费米面以上的导带底主要是由硅原子的s轨道、p轨道以及钠原子的p轨道、铝原子的p轨道组成,而在费米面附近的顶部价带主要是由表面氧原子的2p轨道提供轨道贡献,表明在浮选过程中,钠长石(010)表面上的氧原子相对于其他原子有更高的活性,在参与化学反应时得失电子的能力更强,更容易与浮选药剂发生作用,是矿物浮选的活性位点。
2.2.3 表面能分析
优化表面提交的能量计算结果如表6所示。表6表明数据是收敛的,根据表面能计算式(1),最终算得表面能为1.309 7 J/m2。
3 结论
(1)在钠长石的晶体结构中,O原子为电子受体,主要是2p轨道得到电子,其余Na、Al、Si原子均为电子供体,所带电荷为正;由于钠长石晶体结构的复杂性,Si—O键、Al—O键和Na—O键都有多种不同的布居和键长,其中Si—O键的布居值最大,其共价性最强,Al—O键次之,而Na—O键的离子性最强。这3种化学键中Na—O键最易断裂,Na+会溶于水中而使钠长石表面荷负电,易与胺类等阳离子捕收剂发生静电吸附作用或分子吸附作用。
(2)在钠长石(010)面费米能级附近的顶部价带主要是由氧原子的2p轨道构成,所以在浮选过程中氧原子有更高的活性,更易与浮选药剂发生作用,是其浮选的活性位点。
(3)钠长石(010)面的表面层原子的外电子在达到新平衡时出现了一定程度的电子重构现象,表面层原子间的布居值也发生明显改变,经过计算得构建表面的表面能为1.309 7 J/m2。


