多囊卵巢综合征患者子宫内膜容受性和妊娠率分析
2020-07-14吕淑兰毛文军杨筱凤
王 丽,吕淑兰,毛文军,白 娥,杨筱凤
(西安交通大学第一附属医院妇产科,西安 710061;*通讯作者,E-mail:yxf73@163.com)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是常见的妇科内分泌疾病,发病率5%-10%[1]。育龄期PCOS女性不仅表现为月经稀发,多数患者因不孕症就诊。胚胎着床是胚泡与容受态的子宫内膜相互作用并进入内膜的复杂过程,胚胎着床成功与否取决于胚泡的侵入能力及子宫内膜容受性。目前评价子宫内膜容受性的方法包括子宫内膜超声影像学、分子生物标志物、基因/转录/蛋白组学等[2]。文献报道子宫内膜的厚度和容积下降、子宫内膜血流的减少可导致内膜容受性受损[3]。研究发现PCOS患者生育能力下降,除排卵障碍外,还与子宫内膜容受性降低有关[4]。基于以上研究,我们推测PCOS患者可能因子宫内膜血供和容积下降而导致内膜容受性降低,进而不利于胚胎着床,提高子宫内膜血供则可能通过改善子宫内膜容受性而提高妊娠率。本研究通过比较PCOS患者与健康对照组胚胎着床窗口期子宫内膜容受性,分析两组的妊娠率及其与内膜容受性的关系,为改善PCOS患者生育问题提供思路。
1 资料与方法
1.1 研究对象
选择2018-05~2019-10在西安交通大学第一附属医院以不孕症就诊的PCOS患者80例设为PCOS组,年龄22-38岁,平均(28.36±7.31)岁。不孕年限1-5年,平均(2.28±0.97)年。PCOS诊断标准根据中国2018年《多囊卵巢综合征中国诊疗指南》制定的标准[5]:①月经稀发或闭经或不规则子宫出血;②高雄激素血症的临床表现或实验室证据;③单侧或双侧卵巢可见直径2-9 mm的卵泡≥12个,和(或)卵巢体积>10 cm3;此3项中符合①②或①③,并排除引起高雄激素和排卵异常的疾病,则可诊断为PCOS。选择同期计划妊娠要求监测排卵的健康女性80例为对照组。排除标准:①高雄激素疾病:库欣综合征、先天性肾上腺皮质增生、卵巢或肾上腺分泌雄激素的肿瘤;②排卵障碍性疾病:甲状腺功能异常、下丘脑闭经、早发性卵巢功能不全等;③输卵管因素或男方精液异常所致不孕症;④生殖道感染。所有入选者均详细记录一般资料,包括年龄、身体质量指数(body mass index,BMI)、腰臀比、基础性激素水平。本研究已在中国临床试验注册中心注册(No.ChiCTR1900023423),并获得西安交通大学第一附属医院伦理委员会批准(No.XJTU1AF2019LSK-120),所有研究对象均签署知情同意书。
1.2 主要仪器
本研究使用美国GE Voluson E8彩色多普勒超声机,为了减少人员操作间的差异,本研究超声检查均由1人完成,患者排空膀胱后将腔内超声探头放置阴道后穹隆,对子宫和附件区进行详细扫描,测量并记录有关数据。所有参与者于月经来潮或孕激素撤退性出血第2-3天由本院检验科采用化学发光法检测血清基础性激素水平,包括卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、泌乳素(prolactin,PRL)、雌二醇(estradiol,E2)、孕酮(progesterone,P)及睾酮(testosterone,T)。
1.3 方法
PCOS患者在采用醋酸环丙孕酮降雄激素和使用二甲双胍改善胰岛素抵抗预处理6个月后进行自然周期监测排卵,患者于月经第9-10日开始经阴道超声监测卵泡发育和子宫内膜生长情况,卵泡成熟后采用人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)或达菲林诱导排卵并指导患者同房。排卵后3 d开始口服地屈孕酮片(10 mg/次,2次/d),直至月经来潮或妊娠,若妊娠后则继续黄体支持治疗至妊娠10周。健康对照组于月经第9-10日开始经阴道超声监测卵泡发育和子宫内膜生长情况,卵泡成熟后指导患者同房。
1.4 卵泡发育及排卵情况
记录两组参与者的成熟卵泡数目、排卵数,并计算成功排卵率。成熟卵泡定义为卵泡平均直径≥18 mm。成功排卵标准如下[6]:①优势卵泡平均直径≥18 mm后消失或缩小5 mm以上;②子宫直肠陷窝出现游离液体;③黄体中体(排卵后6-7 d)血清孕激素≥15 nmol/L。成功排卵率(%)=成功排卵例数/总例数×100%。
1.5 子宫内膜容受性
所有参与者于胚胎着床窗口期(排卵后7-9 d)使用腔内超声探头检测子宫内膜容受性相关指标,包括子宫内膜厚度(endometrial thickness,ET)、子宫动脉搏动指数(pulsatility index,PI)和阻力指数(resistance index,RI)、子宫内膜容积和血流相关指数。ET测量采用经阴道超声在子宫正中矢状切面测量子宫前壁内膜和肌层交界处与子宫后壁内膜和肌层交界处的最大厚度[7]。子宫动脉PI和RI由子宫动脉上行主支在子宫颈左右沿纵向平面测量,取左右子宫动脉的平均值进行统计分析[8]。随后进入虚拟计算机辅助分析(virtual organ computer aid analysis,VOCAL)程序,手动模式勾画子宫内膜轮廓,VOCAL程序自动计算子宫内膜容积(endometrial volume,EV)、血管形成指数(vascularization index,VI)、血流指数(flow index,FI)以及血管形成-血流指数(vascularization flow index,VFI)[9]。
1.6 未破裂卵泡黄素化综合征
未破裂卵泡黄素化综合征(luteinized unruptured follicle syndrome,LUFS)表现为超声监测成熟卵泡持续存在或增大,卵泡壁增厚,点或网格状强回声或囊性实性回声[10]。
1.7 妊娠情况
包括生化妊娠、临床妊娠和持续妊娠。生化妊娠定义为排卵后14 d血hCG≥10 mIU/ml。临床妊娠定义为排卵后4周超声检查宫腔内出现孕囊、胚芽或原始心管搏动。持续妊娠为宫内胎儿生长发育至12周[11]。
1.8 统计学分析
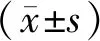
2 结果
2.1 两组参与者一般临床资料比较
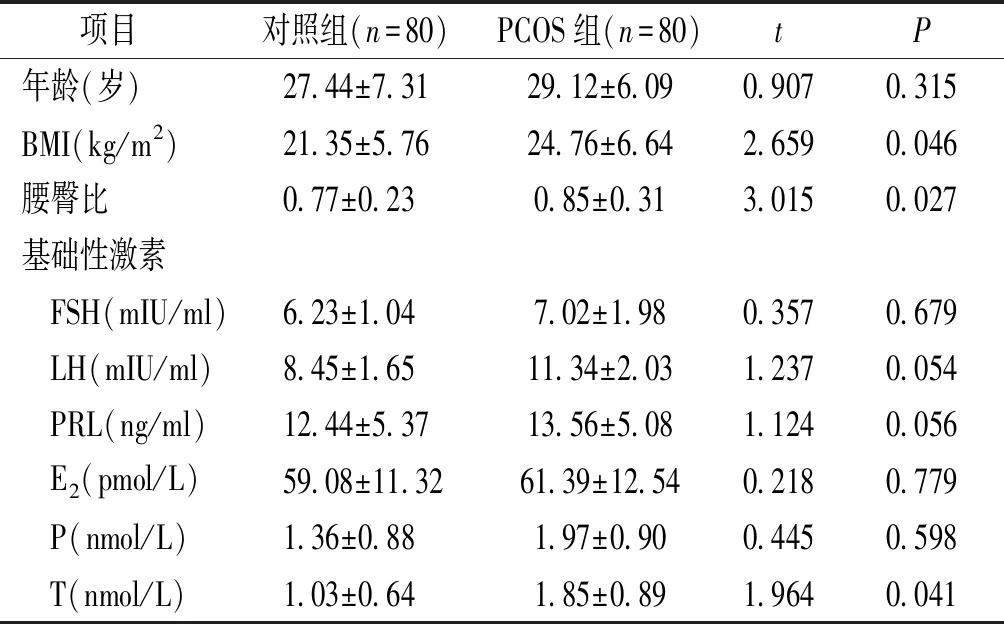
PCOS组患者BMI、腰臀比、和血清睾酮水平均显著高于对照组,差异有统计学意义(P<0.05),两组参与者年龄、血清FSH、LH、PRL、E2、和P水平比较差异无统计学意义(P>0.05,见表1)。
2.2 两组参与者卵泡发育及排卵情况比较
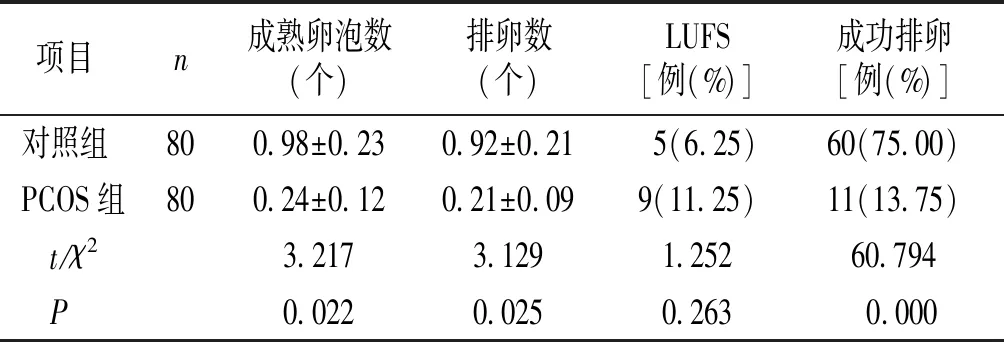
PCOS组成熟卵泡数、排卵数、和成功排卵率均显著低于对照组,差异有统计学意义(P<0.05),而两组参与者LUFS发生率比较差异无统计学意义(P>0.05,见表2)。
表1 两组参与者一般临床资料比较
Table 1 Comparison of general clinical data of participants between the two groups
项目对照组(n=80)PCOS组(n=80)tP年龄(岁)27.44±7.3129.12±6.090.9070.315BMI(kg/m2)21.35±5.7624.76±6.642.6590.046腰臀比0.77±0.230.85±0.313.0150.027基础性激素 FSH(mIU/ml)6.23±1.047.02±1.980.3570.679 LH(mIU/ml)8.45±1.6511.34±2.031.2370.054 PRL(ng/ml)12.44±5.3713.56±5.081.1240.056 E2(pmol/L)59.08±11.3261.39±12.540.2180.779 P(nmol/L)1.36±0.881.97±0.900.4450.598 T(nmol/L)1.03±0.641.85±0.891.9640.041
表2 两组参与者卵泡发育及排卵情况比较
Table 2 Comparison of follicular development and ovulation of participants between the two groups
项目 n 成熟卵泡数(个)排卵数(个)LUFS[例(%)]成功排卵[例(%)]对照组800.98±0.230.92±0.21 5(6.25)60(75.00)PCOS组800.24±0.120.21±0.099(11.25)11(13.75) t/χ23.2173.1291.25260.794 P0.0220.0250.263 0.000
2.3 两组参与者中成功排卵者胚胎着床窗口期子宫内膜容受性指标比较
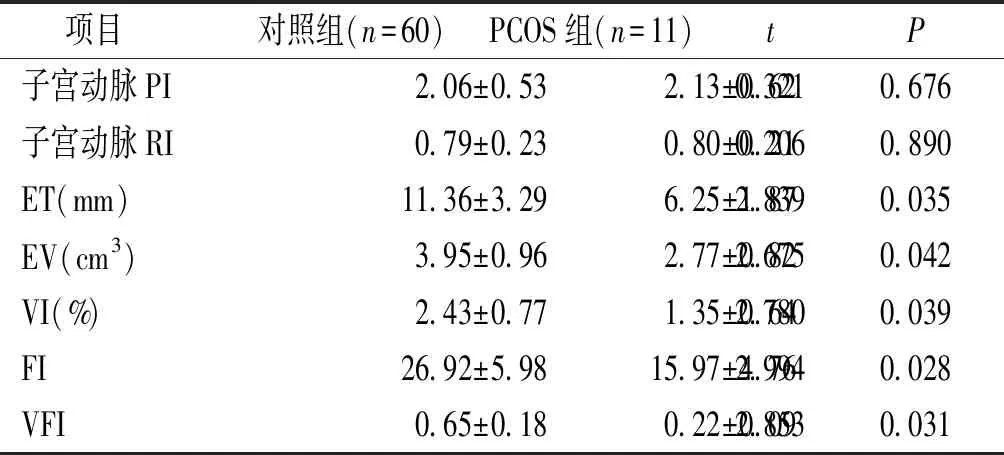
PCOS组成功排卵者胚胎着床窗口期ET、EV、VI、FI和VFI均显著低于对照组,差异有统计学意义(P<0.05),而两组成功排卵者子宫动脉PI、RI比较差异无统计学意义(P>0.05,见表3)。
表3 两组参与者胚胎着床窗口期子宫内膜容受性指标比较
Table 3 Comparison of endometrial receptivity indexes during embryo implantation window of participants between the two groups
项目对照组(n=60)PCOS组(n=11)tP子宫动脉PI2.06±0.532.13±0.620.3210.676子宫动脉RI0.79±0.230.80±0.210.2060.890ET(mm)11.36±3.296.25±1.872.8390.035EV(cm3)3.95±0.962.77±0.822.6750.042VI(%)2.43±0.771.35±0.642.7800.039FI26.92±5.9815.97±4.762.9940.028VFI0.65±0.180.22±0.092.8530.031
2.4 两组参与者妊娠情况比较
PCOS组患者生化妊娠率、临床妊娠率和持续妊娠率分别为6.25%,3.75%,2.50%,均显著低于对照组的32.50%,26.25%,25.00%,差异有统计学意义(P<0.01,见表4)。
表4 两组参与者妊娠率比较 例(%)
Table 4 Comparison of pregnancy rates of participants between the two groups cases(%)
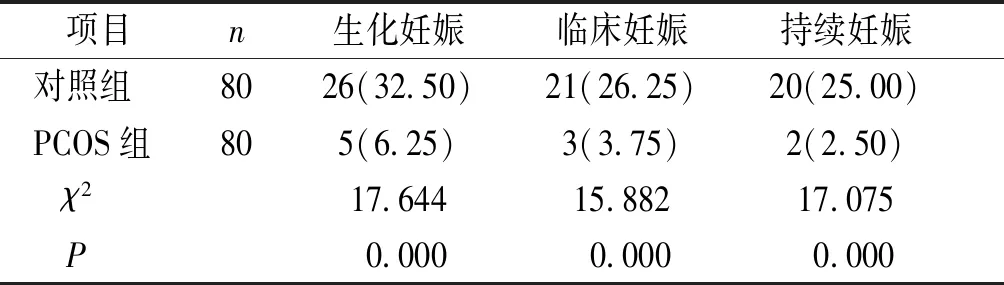
项目n生化妊娠临床妊娠持续妊娠 对照组8026(32.50)21(26.25)20(25.00) PCOS组805(6.25)3(3.75)2(2.50) χ217.64415.88217.075 P 0.000 0.000 0.000
2.5 妊娠者与非妊娠者胚胎着床窗口期子宫内膜容受性指标比较
将两组中所有参与者按照是否妊娠进行分组:非妊娠组(129例)和妊娠组(31例),比较两组参与者子宫内膜容受性相关指标。结果显示妊娠组胚胎着床窗口期VI、FI、VFI均显著高于非妊娠组,差异有统计学意义(P<0.05),而非妊娠组和妊娠组胚胎着床窗口期子宫动脉PI、RI、ET、EV比较差异无统计学意义(P>0.05,见表5)。
表5 妊娠者与非妊娠者胚胎着床窗口期子宫内膜容受性指标比较
Table 5 Comparison of endometrial receptivity indexes during the embryo implantation window between pregnancy and non-pregnancy
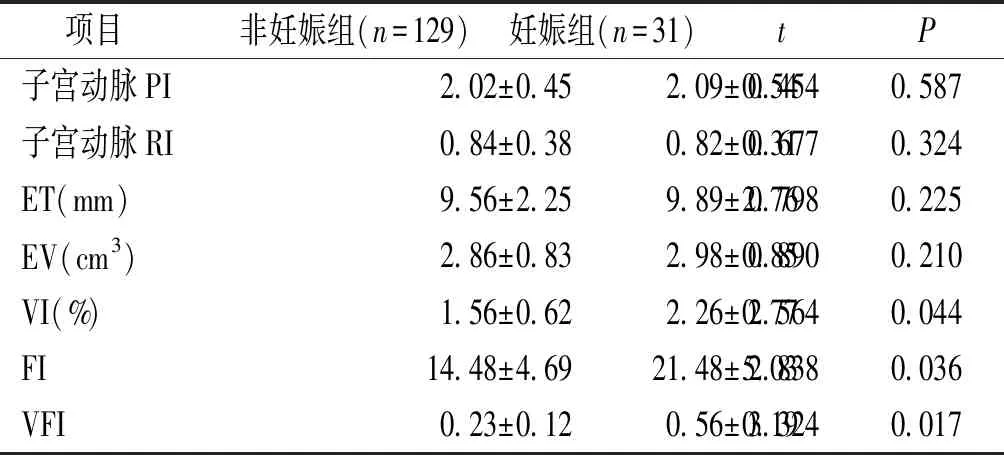
项目非妊娠组(n=129)妊娠组(n=31) tP子宫动脉PI2.02±0.452.09±0.540.4540.587子宫动脉RI0.84±0.380.82±0.310.6770.324ET(mm)9.56±2.259.89±2.760.7980.225EV(cm3)2.86±0.832.98±0.850.8900.210VI(%)1.56±0.622.26±0.772.5640.044FI14.48±4.6921.48±5.032.8380.036VFI0.23±0.120.56±0.193.3240.017
3 讨论
PCOS是一种发病多因性的生殖内分泌代谢紊乱疾病,研究报道50%-70%的育龄期PCOS女性以不孕症为主诉就诊[12],2018年《多囊卵巢综合征中国诊疗指南》制定的标准指出解决此类患者的生育问题应首先进行预处理,包括调整生活方式、改善高雄激素及糖脂代谢紊乱,之后进行监测排卵及不孕症的三线治疗流程[5]。本研究结果显示,PCOS组采用醋酸环丙孕酮降雄激素和使用二甲双胍改善胰岛素抵抗预处理后部分患者恢复排卵,但进一步监测两组参与者自然周期卵泡发育情况,结果显示PCOS组成熟卵泡数、排卵数、成功排卵率均显著低于对照组(P<0.05),且PCOS组患者生化妊娠率、临床妊娠率和持续妊娠率均显著低于对照组(P<0.01),提示PCOS患者在预处理后虽然少数可恢复排卵并获得妊娠,但大多数患者仍需要促排卵治疗以解决生育问题,这与2018年国际发布的基于循证医学证据指南对于PCOS不孕症推荐的治疗方案一致[13]。正常的优势选择过程受到FSH窗口、局部正性选择因子及负性选择因子的调控和影响。PCOS患者的卵泡发育异常表现为早期卵泡生长过多,但其生长受到抑制,大量小窦状卵泡发育停滞甚至闭锁,不发生优势卵泡的选择。因此,大多数PCOS患者需要促排卵以解决生育问题。
子宫内膜容受性在胚胎着床中发挥重要作用,在人和哺乳动物的正常生殖周期中,子宫内膜仅有一个极其短暂的允许胚胎植入的最敏感时期,大约在人正常月经周期排卵后7-9 d,这个敏感期称为“种植窗期”(window of implantation),此时子宫内膜表现出最大的容受性[14]。本研究在测定双侧子宫动脉血流的同时,还采用新型可检测微小血管、低速度血流的三维能量多普勒超声技术检测了胚胎着床窗口期子宫内膜容积和血流相关参数,结果显示PCOS组成功排卵者胚胎着床窗口期ET、EV、VI、FI和VFI均显著低于对照组(P<0.05),而两组参与者子宫动脉PI、RI比较差异无统计学意义(P>0.05)。此外,本研究将所有参与者根据是否妊娠进行分组,结果显示妊娠组胚胎着床窗口期VI、FI、VFI均显著高于非妊娠组,差异有统计学意义(P<0.05),而非妊娠组和妊娠组胚胎着床窗口期子宫动脉PI、RI、ET、EV比较差异无统计学意义(P>0.05),提示PCOS患者子宫内膜容受性低于健康对照组,进而导致妊娠率降低,良好的子宫内膜容积和血流可增加妊娠率。
在胚胎植入早期,血管新生活跃,各种血管新生相关因子表达增高,为胚胎的发育和妊娠的持续提供支持作用。因此,子宫内膜的血供对反应其容受性有重要意义。子宫动脉是供应整个子宫的血管,其血流参数应该是反应子宫整体血供的状态,而不能精准地反应内膜区的血供状态,故内膜血流更能代表子宫内膜容受性。国外已有关于子宫内膜血流、血管化指数在评估内膜容受性中的价值研究,但多数集中于体外受精-胚胎移植(invitrofertilization-embryo transfer,IVF-ET)。Choudhary等[15]研究发现,IVF-ET患者hCG注射日子宫内膜厚度、血流与妊娠相关,内膜较厚、血流丰富者妊娠率高。另有学者报道无论在排卵期还是黄体期,PCOS患者子宫内膜血供均低于正常对照者,当给予二甲双胍治疗6个月后子宫内膜的厚度和容积、内膜血供显著改善,提示PCOS患者可通过改善子宫内膜与内膜下血流参数,进而提高子宫内膜的容受性[16]。Kim等[17]一项前瞻性研究选择了236例接受IVF-ET的女性进行子宫内膜和内膜下血流分析,结果显示与非妊娠者相比,妊娠者子宫内膜VI、FI和VFI显著增加,本研究结果以与以上报道相似。
综述所述,PCOS患者生育问题不仅表现为排卵障碍,子宫内膜容受性下降同样需要临床重视,此类患者应改善胚胎着床窗口期子宫内膜容受性,以便提高妊娠率。然而,本研究结果需要大样本多中心论证,且三维能量多普勒超声对于子宫内膜容受性的评估需要在PCOS促排卵中进一步验证。
