lncRNA RP13-991F5.2通过调控LKB1/AMPK信号通路抑制肾细胞癌细胞的侵袭和增殖
2020-07-14刘诗月黄玉琴
胡 波,刘诗月,黄玉琴,呙 月
(湖北医药学院附属襄阳市第一人民医院肿瘤科,襄阳 441000;*通讯作者,E-mail:hb20054291@126.com)
肾细胞癌起源于肾小管上皮细胞,大约占成人恶性肿瘤的2%,其发病率呈逐年上升趋势[1]。肾细胞癌早期易转移,严重威胁患者的生命健康[2]。肾细胞癌对放射治疗、化学治疗均不敏感,其主要治疗方式仍是手术治疗,但复发率较高[3]。探究肾细胞癌发生、发展的分子机制,对肾细胞癌的靶向治疗具有重要意义。长链非编码RNA(long-chain non-coding RNA,lncRNA)是一类长度大于200个核苷酸的非编码RNA,在转录水平、转录后水平、表观遗传水平等方面对基因表达具有调控作用[4]。近年的研究表明,lncRNA在肾细胞癌发生、发展中具有类似癌基因或抑癌基因的作用[5]。lncRNA是近年来肾细胞癌研究领域一个新的热点。RP13-991F5.2是一个尚未被报道的lncRNA,长度为838 nt。本研究检测了RP13-991F5.2在83对肾细胞癌组织和癌旁组织、肾细胞癌细胞株和正常肾小管上皮细胞中的差异表达,通过在表达最低的肾细胞癌细胞中过表达RP13-991F5.2,观察RP13-991F5.2对肾细胞癌细胞侵袭和增殖能力的影响,并探讨其分子作用机制。
1 材料与方法
1.1 组织样本来源
83对肾细胞癌组织和对应的癌旁组织为湖北医药学院附属襄阳市第一人民医院肿瘤科2016-11~2019-04手术切除的标本,以距离肿瘤边缘5 cm处的组织为癌旁组织,采集后立即于液氮中保存。患者术前均未接受放射治疗和化学治疗。所有肾细胞癌组织和癌旁组织均经病理学证实。本研究经湖北医药学院附属襄阳市第一人民医院伦理委员会批注,患者均签署知情同意书。
1.2 细胞株和主要试剂
DMEM培养基和RPMI-1640培养基购于美国Hyclone公司;四甲基偶氮唑蓝(MTT)试剂盒购于美国Sigma公司;肾细胞癌细胞株(ACHN、A498、OS-RC-2、786-O、Caki-1)和正常肾小管上皮细胞(HK-2)购于上海信然生物技术有限公司;胎牛血清购于美国Gibco公司;阴性对照慢病毒、携带RP13-991F5.2的慢病毒购于南京诺唯赞生物科技有限公司;逆转录试剂盒和实时定量聚合酶链反应(qPCR)试剂盒购于日本TaKaRa公司;超敏ECL发光试剂盒购于美国Thermo公司;一抗mTORC2、LKB1、GAPDH、AMPK、Raptor及p-Raptor购于美国Abcam公司;Transwell小室购于美国Corning公司;基质胶购于美国Life Technologies公司。
1.3 细胞培养和感染
在37 ℃、体积分数为5% CO2培养箱中,5种肾细胞癌细胞株均利用含10%胎牛血清的RPMI-1640培养基培养,正常肾小管上皮细胞利用含10%胎牛血清的DMEM培养基培养,0.25%胰蛋白酶消化传代。接种对数生长期Caki-1细胞至6孔板,细胞汇合度为40%时感染慢病毒。慢病毒感染步骤严格依据说明书操作,分别感染携带RP13-991F5.2的慢病毒和阴性对照慢病毒(感染复数均为25),定义为RP13-991F5.2组和对照组。慢病毒感染Caki-1细胞12 h后,观察细胞状态,及时更换新鲜培养基。
1.4 qPCR检测RP13-991F5.2和LKB1 mRNA的表达量
选取200 mg组织或细胞,利用Trizol试剂提取总RNA,利用紫外分光仪分析其浓度和纯度。逆转录为cDNA后,采用qPCR检测RP13-991F5.2和LKB1 mRNA的相对表达,所得数据利用2-ΔΔCt方法计算。qPCR反应条件:95 ℃预变性60 s,95 ℃变性10 s,62 ℃退火25 s,72 ℃延伸25 s,共35个循环。以GAPDH作内参,计算RP13-991F5.2和LKB1的表达量。RP13-991F5.2上游引物:5′-CGCCTCTAATCCCAGCTACTT-3′,下游引物:5′-CACCTCCCAGGTTCAAGC-3′;LKB1上游引物:5′-TGTCGG TGGGTATGGACAC-3′,下游引物:5′-CCTTGCCGTAAGAGCCTTCC-3′;GAPDH上游引物:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物:5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.5 Transwell侵袭实验检测感染Caki-1细胞的侵袭能力
预先将基质胶均匀铺在Transwell上室,在培养箱中凝固。收集感染后48 h的Caki-1细胞,无血清DMEM培养基调整细胞密度。每组均加200 μl细胞悬液至上室,下室均加入700 μl含10%胎牛血清的RPMI-1640培养基。培养箱中培养24 h后,利用4%多聚甲醛室温下固定10 min,利用0.1%结晶紫染液室温下染色15 min。流水冲洗染液后,棉签轻轻擦去上室细胞。在高倍显微镜下,计数每组穿过底膜的细胞数,表示Caki-1细胞的侵袭能力。
1.6 四甲基偶氮唑蓝(MTT)法检测感染Caki-1细胞的增殖能力
收集感染48 h的Caki-1细胞,RPMI-1640培养基调整细胞密度后,以4 000个/孔接种于96孔板,分别于接种细胞后的第1-5天进行MTT检测。检测时,加入23 μl/孔MTT试剂,培养箱培养4 h,加入180 μl/孔二甲基亚砜,充分振荡后,利用酶标仪检测在波长495 nm处每孔的吸光度(A)值。
1.7 Western blot检测LKB1/AMPK信号通路蛋白的表达
收集感染后48 h的Caki-1细胞并提取细胞总蛋白,每组细胞蛋白上样量为40 μg,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白后,利用PVDF膜转膜。在室温下,PVDF膜在5%脱脂牛奶中封闭2 h。分别孵育LKB1(稀释比为1 ∶1 000)、AMPK(稀释比为1 ∶1 000)、Raptor(稀释比为1 ∶3 000)、p-Raptor(稀释比为1 ∶2 000)、mTORC2(稀释比为1 ∶2 000)和GAPDH一抗(稀释比均为1 ∶2 000),4 ℃下孵育过夜。室温下孵育二抗2 h后,均匀滴加超敏ECL发光试剂,利用凝胶成像仪显影、拍照。
1.8 统计学分析
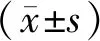
2 结果
2.1 肾细胞癌组织中RP13-991F5.2的表达
qPCR结果显示,83对肾细胞癌组织和癌旁组织中RP13-991F5.2的相对表达量分别为1.34±0.26和6.72±0.98,癌旁组织RP13-991F5.2的相对表达量是肾细胞癌组织的5.01倍,差异有统计学意义(t=25.31,P<0.01,见图1)。
2.2 肾细胞癌细胞株中RP13-991F5.2的表达
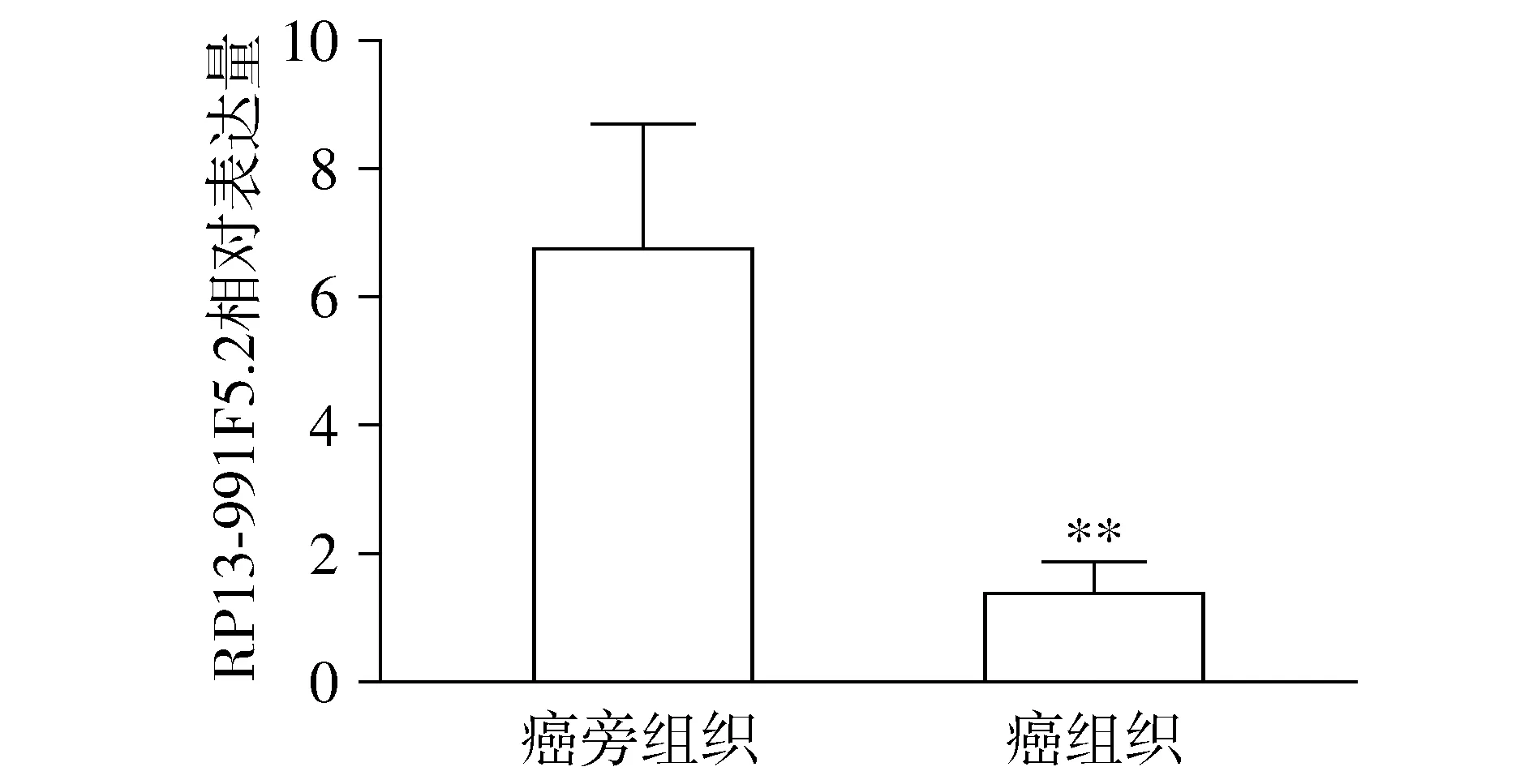
qPCR结果显示,肾细胞癌细胞株(ACHN、A498、OS-RC-2、786-O、Caki-1)和正常肾小管上皮细胞(HK-2)中RP13-991F5.2的相对表达量分别为0.51±0.05,0.77±0.02,0.47±0.02,0.30±0.03,0.14±0.02和1.01±0.09,肾细胞癌细胞株中RP13-991F5.2的相对表达量明显低于正常肾小管细胞(P<0.05),Caki-1细胞中的表达最低(P<0.01,见图2)。
与癌旁组织比较,**P<0.01图1 肾细胞癌组织和癌旁组织中RP13-991F5.2的相对表达量Figure 1 Expression of RP13-991F5.2 in bladder cancer tissues and paracancerous tissues
与HK-2细胞比较,*P<0.05,**P<0.01图2 肾细胞癌细胞株和正常肾小管上皮细胞中RP13-991F5.2的相对表达量Figure 2 Expression of RP13-991F5.2 in bladder cancer cell lines and normal renal tubular epithelial cells
2.3 Caki-1细胞感染RP13-991F5.2病毒的效率
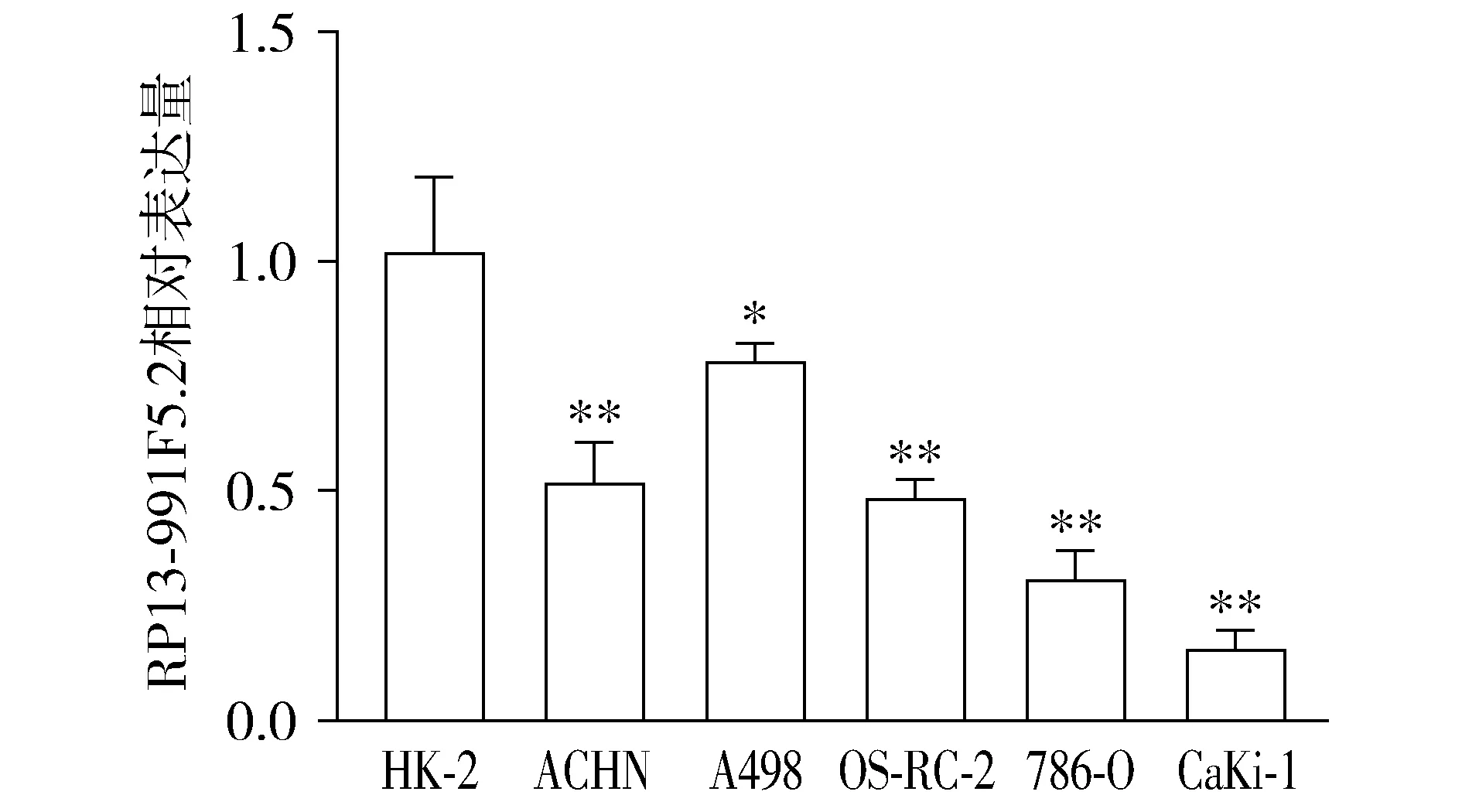
qPCR结果显示,对照组和RP13-991F5.2组细胞中RP13-991F5.2的相对表达量分别为1.01±0.07和13.90±1.51,差异有统计学意义(t=8.54,P<0.01,见图3)。RP13-991F5.2组RP13-991F5.2的相对表达量是对照组的13.76倍。
与对照组比较,**P<0.01图3 Caki-1细胞感染携带RP13-991F5.2的慢病毒和阴性对照慢病毒后RP13-991F5.2的相对表达量Figure 3 Expression of RP13-991F5.2 in Caki-1 cells infected with the lentivirus carrying RP13-991F5.2 or the negative control
2.4 RP13-991F5.2对Caki-1细胞侵袭能力的影响
对照组和RP13-991F5.2组细胞中穿膜Caki-1细胞数分别为(109.70±15.37)个和(40.60±7.06)个。与对照组比较,RP13-991F5.2组穿膜Caki-1细胞数明显较少,差异有统计学意义(t=4.09,P<0.01,见图4),RP13-991F5.2具有抑制肾细胞癌Caki-1细胞侵袭的能力。
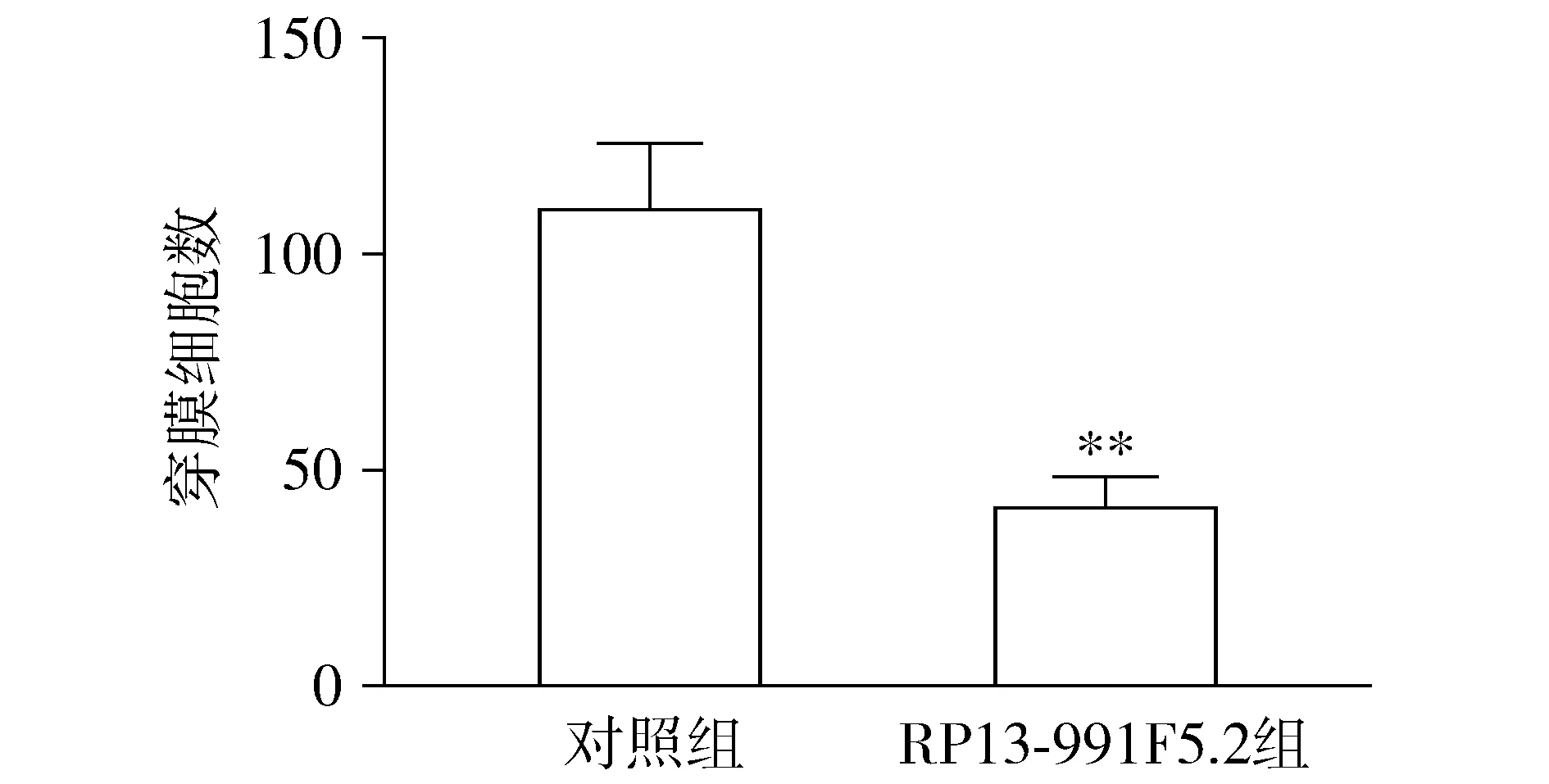
与对照组相比,**P<0.01图4 RP13-991F5.2对Caki-1细胞侵袭能力的影响Figure 4 Effect of RP13-991F5.2 on the invasion ability of Caki-1 cells
2.5 RP13-991F5.2对Caki-1细胞增殖能力的影响
MTT法结果显示,两组Caki-1细胞在感染后第1天的A值差异无统计学意义(t=0.22,P>0.05,见图5)。RP13-991F5.2组Caki-1细胞在感染后第2,3,4,5天的A值低于对照组,差异均有统计学意义(分别t=3.86,P<0.05;t=4.12,P<0.05;t=4.73,P<0.01;t=4.79,P<0.01),表明RP13-991F5.2具有抑制肾细胞癌Caki-1细胞增殖的能力。
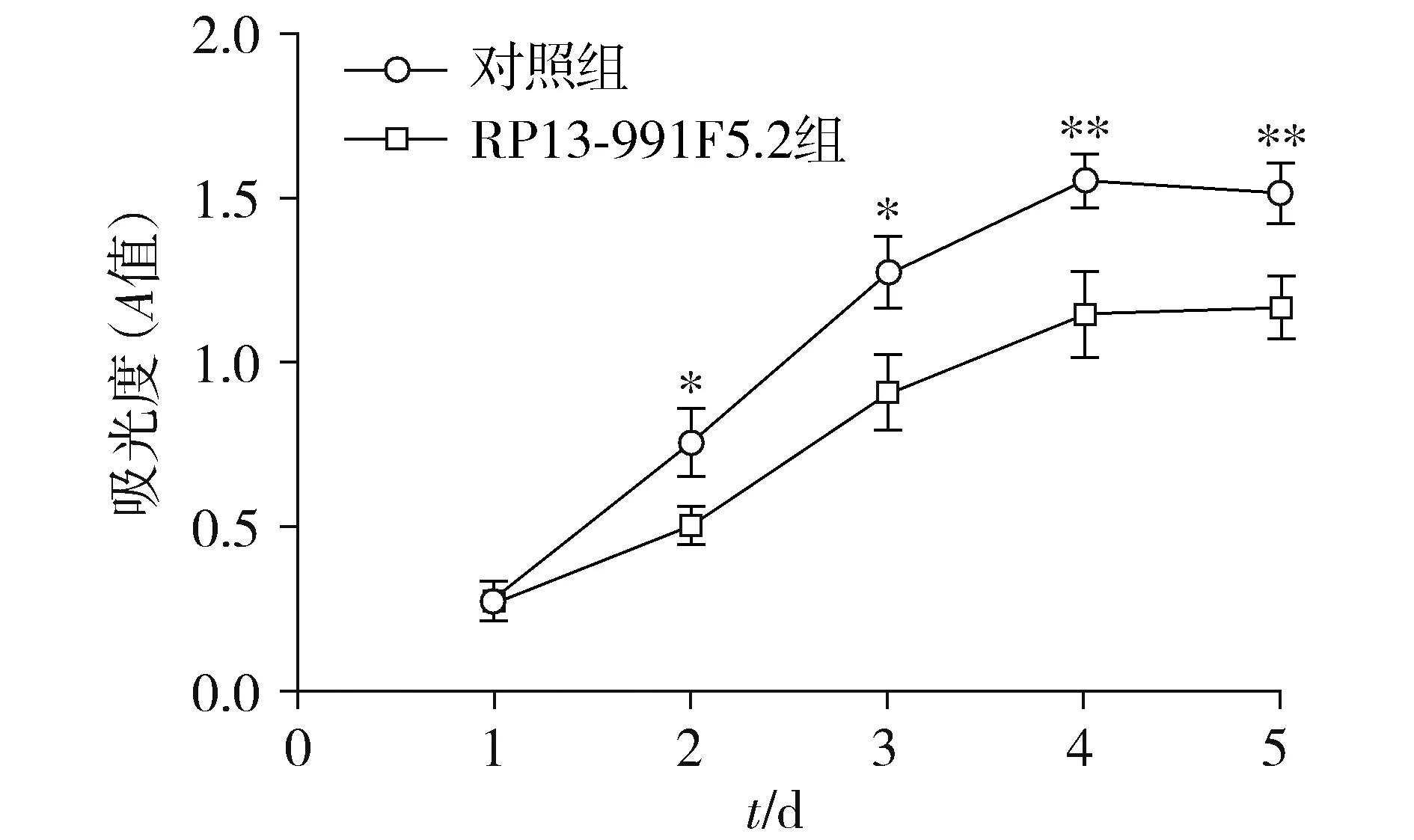
与对照组相比,*P<0.05,**P<0.01图5 RP13-991F5.2对Caki-1细胞增殖能力的影响Figure 5 Effect of RP13-991F5.2 on the proliferation of Caki-1 cells
2.6 Caki-1细胞感染RP13-991F5.2慢病毒对LKB1 mRNA表达的影响
qPCR结果显示,RP13-991F5.2组Caki-1细胞感染RP13-991F5.2慢病毒后LKB1 mRNA的相对表达量明显高于对照组,差异有统计学意义(6.77±1.24vs1.01±0.09,t=13.80,P<0.01),表明RP13-991F5.2可有效促进LKB1 mRNA的相对表达。
2.7 Caki-1细胞感染RP13-991F5.2慢病毒后LKB1/AMPK信号通路蛋白的表达水平
Western blot结果表明,RP13-991F5.2组Caki-1细胞感染RP13-991F5.2慢病毒后,LKB1和AMPK蛋白表达量明显升高(见图6),表明LKB1/AMPK信号通路可能被活化。同时,p-Raptor蛋白和mTORC2蛋白表达降低,表明mTOR信号通路可能被抑制。
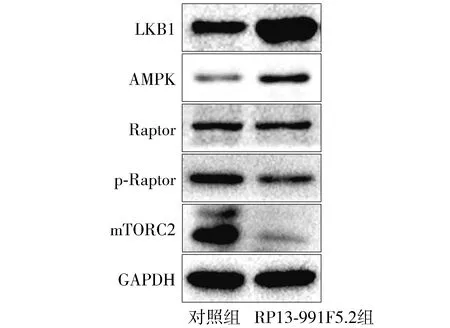
图6 RP13-991F5.2对LKB1/AMPK信号通路蛋白表达的影响Figure 6 Effect of RP13-991F5.2 on the expression of LKB1/AMPK signaling pathway proteins
3 讨论
人类基因组转录后的大部分RNA均不能翻译为蛋白,仅有2%的RNA可编码蛋白,长链非编码RNA(long-chain non-coding RNA,lncRNA)是非编码RNA的重要组成部分[6]。很长一段时间,由于lncRNA缺乏开放阅读框,研究者认为lncRNA只是转录的“副产物”,不具有生物学意义[7]。越来越多的研究表明,lncRNA可直接结合转录因子、RNA聚合酶、染色质修饰蛋白,引导基因的转录和翻译,参与细胞的分化、发育、凋亡等活动[8,9]。近年来,很多lncRNA被证实在包括肾细胞癌在内的肿瘤组织和癌旁组织中的表达存在明显异常,其表达水平与患者肿瘤大小、TNM分期、预后情况相关[10,11]。Yang等[12]研究发现,lncRNA KCNQ1DN在肾细胞癌组织和细胞株中表达明显降低,其低表达可能源于启动子的高度甲基化,KCNQ1DN可通过抑制癌基因c-myc的表达,显著抑制肾细胞癌细胞的生长。Shi等[13]发现,lncRNA ROR在肾细胞癌组织中表达明显上调,主要通过调节miR-206/VEGF分子轴促进肿瘤的进展,沉默lncRNA ROR表达可显著抑制肾细胞癌细胞的增殖、迁移和侵袭。Luo等[14]发现,lncRNA ENST00000434223的表达水平与肾细胞癌患者的预后不良密切相关,下调ENST00000434223表达可增强肾细胞癌细胞的活力和侵袭性,过表达ENST00000434223可明显抑制细胞的生长和转移能力,ENST00000434223发挥作用的机制可能与Wnt/β-catenin信号通路转导有关。lncRNA对肾细胞癌的诊断和靶向治疗具有重要临床意义。RP13-991F5.2是一种尚未被报道的lncRNA,其在肾细胞癌组织中的表达和分子作用机制尚不明确。
本研究以RP13-991F5.2作为研究对象,通过qPCR法验证其在肾细胞癌和细胞株中的表达差异。结果显示,与癌旁组织相比,RP13-991F5.2在肾细胞癌组织中的表达降低;与正常肾小管上皮相比RP13-991F5.2在肾细胞癌细胞株中的表达降低,表明RP13-991F5.2可能在肾细胞癌发生、发展中发挥抑癌基因作用。本研究进一步将载有RP13-991F5.2的慢病毒感染肾细胞癌Caki-1细胞,通过Transwell侵袭实验和MTT法检测过表达RP13-991F5.2后Caki-1细胞的侵袭和增殖能力。结果显示,过表达RP13-991F5.2可明显抑制肾细胞癌Caki-1细胞的侵袭能力和增殖能力,提示RP13-991F5.2可抑制肾细胞癌细胞转移和生长。肝激酶B1(LKB1)基因包括1个非编码外显子和9个编码外显子,其蛋白由433个氨基酸组成,可调节细胞极性,是一种肿瘤抑制因子[15]。在人体大部分组织中,LKB1均有表达,其表达异常在疾病尤其是肿瘤的发生中具有重要作用,LKB1表达缺失或突变在越来越多的多种恶性肿瘤如前列腺癌、肝癌被证实参与调控肿瘤细胞的恶性生物学行为[16,17]。有研究表明,LKB1在肾细胞癌组织和细胞株中呈低表达,LKB1表达降低与肾细胞癌细胞的上皮间充质转化和异常增殖明显相关[18]。qPCR和Western blot显示,过表达RP13-991F5.2在mRNA和蛋白水平上均可明显促进LKB1基因的表达。LKB1主要通过活化LKB1/AMPK信号通路,抑制Raptor蛋白磷酸化,进而抑制mTOR信号通路活化,从而抑制肿瘤细胞的转移和生长,发挥抑癌基因的作用[19]。RP13-991F5.2促进LKB1蛋白表达后,AMPK蛋白表达升高,p-Raptor蛋白和mTORC2蛋白表达降低,表明LKB1/AMPK信号通路被活化,mTOR信号通路被抑制。RP13-991F5.2可能主要通过促进LKB1/AMPK信号通路活化,参与抑制肾细胞癌细胞的侵袭和增殖能力。
综上所述,肾细胞癌组织中RP13-991F5.2呈低表达,上调RP13-991F5.2明显抑制肾细胞癌细胞的侵袭和增殖能力。RP13-991F5.2可能是通过促进LKB1/AMPK信号通路的活化在肾细胞癌发生、发展中发挥抑癌基因作用,可能成为肾细胞癌的基因治疗靶点。
