PR方案治疗慢性丙型肝炎患者ITPA基因rs1127354位点多态性与利巴韦林相关性溶血关系探讨*
2020-07-10徐金凤安红杰何文艳赵崇山赵应飞周丽华
徐金凤,安红杰,何文艳,艾 红,赵崇山,赵应飞,董 波,周丽华,吴 晶
丙型肝炎病毒(hepatitis C virus,HCV)感染可导致肝脏持续炎症反应,中国感染人群达 0.4 亿,全球感染人群可能大于1.7亿,已成为全球性公共卫生问题。慢性丙型肝炎(CHC)的抗病毒治疗已经从干扰素联合利巴韦林跃进到全口服直接抗病毒药物(DAA)时代, 但目前干扰素联合利巴韦林(ribavirin,RBV)抗病毒治疗仍为HCV感染者的基础治疗方案[1-3]。然而,RBV可能引起溶血性贫血,从而在治疗过程中被迫减量或停用,导致疗效降低或疗程延长和医疗费用增加。研究表明,RBV相关性溶血发生率存在个体差异[4],但已经明确,三磷酸次黄嘌呤核苷(inosine triphosphatase genotype,ITPA)基因多态性与贫血发生密切相关,而其他因素,如是否应用α-干扰素和基础血红蛋白水平等也会影响贫血的发生及其严重程度。预测患者在抗病毒治疗过程中出现贫血的风险,有助于制定更加安全有效的治疗方案,并提高疗效和节约经费,实现精准治疗。本研究旨在分析标准治疗方案治疗CHC患者ITPA基因多态性与利巴韦林相关性溶血的关系及其对抗病毒效果的影响,现报道如下。
1 资料与方法
1.1 一般资料 2016年3月~2018年3月我院收治的CHC患者235例,男性190例,女性45例;年龄23~65岁,平均年龄为(39.5±11.4)岁。诊断依据《丙型肝炎防治指南(2015年更新版)》[7],①HCV感染超过半年;②抗-HCV和HCV RNA阳性。排除标准:①合并妊娠和哺乳或有妊娠计划的女性;②既往接受过或正在接受α-干扰素联合利巴韦林抗病毒治疗;③伴有精神、心理疾病,无法配合完成治疗;④严重的心、肾等重要脏器实质性损害;⑤合并失代偿期肝硬化、代谢性肝病、其他类型肝炎病毒,如甲、乙、丁型和(或)戊型肝炎病毒感染、酒精性肝病和自身免疫性肝病;⑥合并艾滋病、肿瘤等严重消耗性疾病。患者签署知情同意书,本研究经我院医学伦理委员会审批同意。
1.2 治疗方法 给予所有患者聚乙二醇化干扰素α-2a(厦门特宝生物工程股份有限公司,国药准字S20160001) 180 μg皮下注射,1次/w,RBV(四川太平洋药业有限责任公司,国药准字H20046381)800 mg/d分次口服,持续治疗24~48 w。根据血红蛋白(hemoglobin, Hb)水平变化,决定RBV用量,即当Hb<100 g/L 时,将RBV减量;当Hb<85 g/L 时,停用RBV。根据患者中性粒细胞计数或血小板计数降低情况,决定聚乙二醇干扰素α-2a用量或是否停药(当中性粒细胞计数<0.75×109/L或血小板计数<50×109/L时,将聚乙二醇干扰素α-2a的剂量减半;当中性粒细胞计数<0.5×109/L 或血小板计数<25×109/L 时,终止抗病毒治疗)[9,10]。
1.3 检测指标 使用9200型全自动生化分析仪检测血生化指标(海力孚公司);使用COBAS AmpliPrep/TaqMan 48 超敏聚合酶链式反应系统检测血清HCV RNA水平(罗氏);采用离心柱法获取人血基因组 DNA,经聚合酶链式反应增扩人基因组 DNA,最后以测序引物对获得的扩增产物进行测序,检测ITPA基因rs1127354位点基因型,将其分为AA型、AC型和CC型【生工生物工程(上海)股份有限公司】。
1.4 病毒学应答 快速病毒学应答(rapid virological response,RVR),即治疗第 4 周时 HCV RNA 低于检测下限;早期病毒学应答(early virological response,EVR),即治疗第 12 周时HCV RNA低于检测下限;持续病毒学应答(sustained virological response,SVR),即治疗结束后24 周血清 HCV RNA持续低于检测下限。

2 结果
2.1 不同基因型患者抗病毒治疗效果比较 共有188例CHC患者完成24周治疗,ITPA基因rs1127354位点AA/AC型与CC型组患者RVR和EVR无统计学差异(P>0.05),但AA/AC型组SVR显著高于CC型组(P<0.05,表1)。
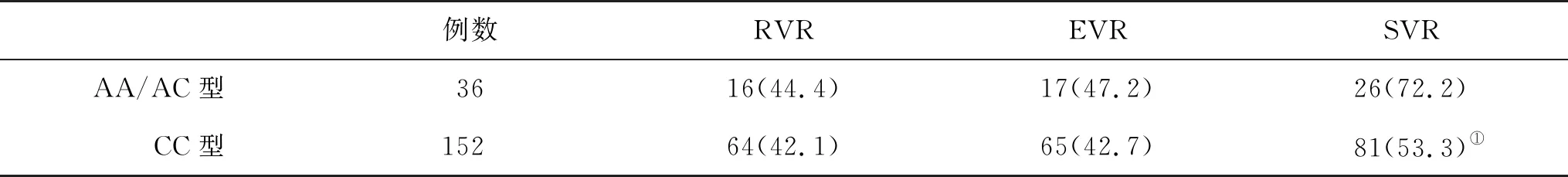
表1 不同基因型CHC患者疗效[n(%)]比较
与AA/AC型比,①P<0.05
>2.2 不同基因型患者血红蛋白水平变化的比较 治疗前,两种基因型患者Hb水平无统计学差异(P>0.05);治疗后, 排除不能耐受而脱落患者后,AA/AC型患者Hb水平均显著高于CC型(P<0.05,表2)。

表2 不同基因型患者Hb水平变化的比较
与AA/AC型比,①P<0.05
3 讨论
虽然直接作用抗病毒药物(direct-acting antiviral agents, DAAs)治疗丙型肝炎已经在世界范围内应用,并取得良好的治疗效果[13],但国内DAAs药物医疗资源相对有限,部分地区仍需应用聚乙二醇干扰素α-2a联合RBV治疗,PR方案仍为《中国丙型肝炎防治指南》(2015年)推荐的主要治疗方法。此外,多项国内外指南也推荐RBV与多种DAAs联用[14-16]。因此,RBV相关溶血及抗病毒治疗效果影响因素的研究具有重要的临床意义,预测患者出现贫血的风险及抗病毒治疗效果,有助于制定更加安全有效的治疗方案,并提高疗效和节约医疗经费,实现精准治疗。
口服RBV经消化系统吸收进入机体血液循环,可被红细胞摄取,并在红细胞内发生磷酸化,进而激活其抗病毒能力。但是,在RBV 被激活的过程中,红细胞内鸟苷三磷酸(guanosine triphosphate, GTP)被大量消耗,会严重影响红细胞中能量代谢,诱发溶血性贫血。此外,活化为三磷酸盐的RBV在红细胞内富集可导致红细胞氧化损伤,进而导致其破裂。肌苷三磷酸在红细胞内可替代 GTP合成腺嘌呤核苷三磷酸,大量消耗GTP,起到保护红细胞的作用[17]。ITPA包括两个功能性变异位点:一个在外显子错位突变(rs1127354,P32T),一个在内含子剪切突变(rs7270101)。一些研究认为rs7270101位点的基因突变与RBV相关溶血中血红蛋白下降程度无明显的联系[18]。本研究发现ITPA(rs1127354位点)基因CC型193例(82.1%),AA/AC型42例(17.9%),与既往多数研究结果接近[19,20]。由于红细胞容量的测量较为复杂,临床多用Hb水平来代替。本研究结果显示,在治疗第4周、8周、12周、24周,AA/AC型人群Hb下降程度均低于CC型人群,即含有A等位基因的患者发生溶血性贫血的可能性较低。ITPA基因型发生改变可减少RBV活化对红细胞的损伤作用,从而提高了血红蛋白水平。因此,AA/AC型患者Hb下降程度较低,临床可根据患者Hb水平情况及时调整用药和干预。
本研究结果显示在治疗4周和24周,两组不同基因型患者Hb水平差异较显著。在治疗初期RBV在血中蓄积较少,对红细胞的损伤较小。随着用药时间延长,CC型患者红细胞出现损伤。在治疗12周后,RBV在体内蓄积,ITPA基因型改变,在治疗过程CC型基因患者更易因为RBV相关溶血而降低RBV用量,但研究中部分CC型基因患者亦无RBV相关溶血情况的发生,且随着用药时间的延长,两组患者发生严重贫血的几率接近,rs1127354位点基因型对患者临床用药的指导作用可能需要进一步研究。
本研究应用聚乙二醇干扰素α-2a和RBV联合治疗CHC患者,聚乙二醇干扰素α-2a一方面可与肝细胞表面的干扰素受体结合,促进相关抗病毒因子及其蛋白的分泌和释放,抑制HCV复制,还可提高多种免疫细胞的杀伤能力,提高机体的免疫功能,起到间接的抗病毒效果。RBV可通过竞争性抑制病毒合成酶,如肌苷单磷酸脱氢酶、RNA多聚酶和信使RNA鸟苷转移酶等,抑制细胞内HCV复制,减少病毒载量,改善患者病情。临床实践显示接受聚乙二醇干扰素α-2a和RBV治疗的患者抗病毒治疗效果可能存在较大的差异。白细胞计数能反映机体的免疫功能,正常的白细胞数目能抑制HCV在体内的复制,提高抗病毒治疗效果。丙型肝炎患者肝脏长期存在炎症反应可导致肝组织损伤,刺激肝星状细胞分泌胶原,细胞外基质沉积,导致肝纤维化。肝纤维化程度越高,患者受HCV损伤程度越高。因此,存在肝纤维化的患者会严重影响抗病毒治疗效果。RBV全基因组关联的相关研究显示ITPA基因型可能与患者抗病毒治疗效果有关,但与患者SVR的关系仍存在争议。既往部分研究认为ITPA基因通过影响RBV用量,间接影响抗病毒治疗效果,但也有部分学者认为,ITPA基因型对抗病毒治疗效果的影响呈现出独立于RBV剂量的现象[21,22]。本研究共有188例患者完成了24周的抗病毒治疗,结果显示两组不同基因型患者之间RVR和EVR均无统计学差异,但AA/AC组SVR为72.2%,显著高于CC型的53.3%,说明ITPA 基因多态性与抗病毒治疗效果具有直接的联系。文献提示治疗前血清HCV RNA载量和ITPA基因型是抗病毒治疗效果的独立影响因素【23】。治疗前,血清HCV RNA水平越高,说明体内HCV载量越高,抗病毒治疗更难奏效,患者也难以获得持续病毒学应答。
综上所述,ITPA基因为CC型的CHC患者更易发生RBV 相关溶血,治疗前检测ITPA基因型对抗病毒治疗效果具有预测意义,临床应加以重视。
