多种自身抗体在原发性胆汁性胆管炎中的临床意义
2020-07-09李齐光魏秋静梁雅茹徐令清钟国权
李齐光 魏秋静 梁雅茹 徐令清 钟国权

【摘要】目的 探討多种自身抗体在原发性胆汁性胆管炎(PBC)诊疗中的临床意义。方法 收集58例原发性胆汁性胆管炎患者(PBC组)、60例病毒性肝炎患者(病毒性肝炎组)和60名健康体检者(正常对照组)。应用间接免疫荧光法分别检测抗核抗体(ANA)、抗线粒体抗体(AMA),用线性免疫印迹法分别检测抗线粒体2型抗体(AMA-M2)、抗gp210抗体(抗gp210)和抗sp100抗体(抗sp100),分析各种自身抗体单独检测及并联检测在PBC诊断中的意义。结果 PBC组、病毒性肝炎组和正常对照组患者的ANA阳性率比较差异有统计学意义(P < 0.05),其中PBC组的ANA阳性率最高、正常对照组的ANA阳性率最低,组间两两比较差异均有统计学意义(P均< 0.017)。3组的ANA阳性者中,PBC组以中高滴度(1∶320及以上)为主,中高滴度者比例均高于病毒性肝炎组及正常对照组(P均< 0.017),低滴度(1∶100)者比例低于病毒性肝炎组(P均< 0.017)。PBC组54例ANA阳性患者中,ANA荧光核型以胞浆颗粒型(43%)与着丝点型(20%)为主。PBC组患者的ANA、AMA、AMA-M2、抗gp210、抗sp100及并联检测[ANA、AMA、AMA-M2、抗gp210抗体和(或)抗sp100抗体]的阳性率均高于病毒性肝炎组和正常对照组(P均< 0.017),PBC组中并联检测的阳性率高于单独检测抗gp210和抗sp100(P均< 0.05)。ANA(1∶320及以上)、AMA、AMA-M2、抗gp210和抗sp100以及并联检测在PBC患者中的灵敏度分别为88%、85%、78%、29%、16%和90%;特异度分别为92%、97%、98%、98%、100%和92%;阳性预测值分别为91%、96%、98%、94%、9/9和91%;阴性预测值分别为89%、87%、82%、59%、55%和90%。结论 临床筛查PBC时,仅行ANA检测的患者出现中高滴度胞浆颗粒型结果时,应追加自身免疫肝抗体谱检测;并联检测自身抗体能够提高PBC的灵敏度,为临床提供更多诊断依据。
【关键词】原发性胆汁性胆管炎;抗核抗体;抗线粒体抗体;抗gp210抗体;抗sp100抗体
【Abstract】Objective To explore the clinical significance of multiple autoantibodies in the diagnosis and treatment of primary biliary cholangitis (PBC). Methods A total of 58 patients with PBC, 60 patients with viral hepatitis, and 60 healthy people were recruited and assigned into three groups. The antinuclear antibody (ANA) and anti-mitochondrial antibody (AMA) were detected by indirect immunofluorescence assay (IIF). The anti-mitochondrial antibody M2 type (AMA-M2), anti-gp210 and anti-sp100 were determined by the linear immunoblotting (LIA). The significance of single and combined detection of different autoantibodies in diagnosis and treatment of PBC was evaluated. Results The positive rate of ANA significantly differed among the PBC, viral hepatitis and normal control groups (all P < 0.05). The positive rate of ANA in the PBC group was the highest and that in the normal control group was the lowest. The positive rate of ANA significantly differed between any two groups (all P < 0.017). For individuals with positive ANA, the proportion of patients with medium and high titer (1∶320 or above) in the PBC group was significantly higher compared with those in the viral hepatitis and normal control groups, respectively (both P < 0.017), whereas the proportion of low titer (1∶100) was significantly lower than that in the viral hepatitis group (P < 0.017). Among 54 patients with positive ANA in the PBC group, the ANA fluorescence karyotype mainly consisted of cytoplasmic and granule type (43%) and centromere type (20%). The positive rates of ANA, AMA, AMA-M2, anti-gp210 and anti-sp100 and combined detection of [ANA, AMA, AMA-M2, anti-gp210 and/or anti-sp100] in the PBC group were significantly higher compared with those in the normal control and viral hepatitis groups (all P < 0.017). In the PBC group, the positive rate of combined detection of anti-gp210 and anti-sp100 was significantly higher than single detection of anti-gp210 and anti-sp100 (both P < 0.05). The sensitivity of ANA (1∶320 or above), AMA, AMA-M2, anti-gp210 and anti-sp100 and combined detection in the PBC patients was 88%, 85%, 78%, 29%, 16% and 90%, 92%, 97%, 98%, 100% and 92% for the specificity, 91%, 96%, 98%, 94%, 9/9 and 91% for the positive predictive value, and 89%, 87%, 82%, 59%, 55% and 90% for the negative predictive value, respectively. Conclusions In the clinical screening of PBC, detection of liver autoantibody spectrum should be supplemented for patients presenting with medium and high titer of cytoplasmic granule type after receiving ANA detection alone. Combined detection of multiple autoantibodies can improve the detection rate of PBC, providing more diagnostic basis for clinical practice.
【Key words】Primary biliary cholangitis;Antinuclear antibody;Anti-mitochondrial antibody;Anti-gp210;Anti-sp100
自身免疫性肝病(AILD)主要包括自身免疫性肝炎(AIH)、原发性胆汁性胆管炎(PBC)、原发性硬化性胆管炎(PSC)以及IgG4相关性胆管炎(IAC)[1]。在AILD中,PBC的发病率较高,是一种以肝内胆汁淤积为主要特征的慢性、进行性AILD,其起病隐匿、发病机制尚不完全清楚,组织学以淋巴细胞破坏肝小叶间胆管的非化脓性炎症和肉芽肿为特征,血清学以多种特异度自身抗体、碱性磷酸酶(ALP)和γ-谷氨酰基转移酶(GGT)进行性升高为主要特征[2]。PBC主要以中老年女性多发,早期患者有疲劳和(或)瘙痒等非特异症状,也有半数以上患者并无临床症状,误诊率高[3]。目前,PBC的临床诊断主要根据免疫学、生物化学、病理学和影像学,血清中出现特异度自身抗体为重要的诊断依据。PBC患者血清中常检测到抗核抗体(ANA)、抗线粒体抗体(AMA)、抗线粒体2型抗体(AMA-M2)、抗gp210抗体(抗gp210)和抗sp100抗体(抗sp100)等自身抗体[4]。这些抗体在PBC病情的发生发展中作用复杂多样,诊断价值不同,因此本研究将并联检测PBC患者血清中的各种自身抗体,对其临床价值进行初步探讨,旨在为研究自身抗体在PBC中的作用提供新依据,现报告如下。
对象与方法
一、研究对象
选择2017年7月至2019年3月在中山大學附属第三医院住院的58例PBC患者作为PBC组,其中男7例、女51例,年龄(50.7±11.3)岁,入选患者均符合《PBC诊断和治疗专家共识(2015)》,即符合下列3项中的2项即可诊断为PBC:①反映胆汁淤积的生化指标如ALP或GGT升高;②AMA或AMA-M2阳性;③AMA和AMA-M2阴性,但肝穿刺病理符合PBC。排除标准:①血清病毒性肝炎标志物阳性;②有酗酒史;③服用有损肝脏功能或可致胆道梗阻药物者;④合并干燥综合征或自身免疫性肝炎患者;⑤妊娠引起的胆汁淤积[5]。选择同期在中山大学附属第三医院住院的60例病毒性肝炎患者作为病毒性肝炎组,其中男11例、女49例,年龄(48.9±11.6)岁,乙型病毒性肝炎46例、丙型病毒性肝炎14例。另外选取同期在中山大学附属第三医院就诊的60名健康体检者作为正常对照组,其中男9例、女51例,年龄(49.1±9.6)岁。3组年龄、性别比较差异均无统计学意义(P均> 0.05)。研究方案经中山大学附属第三医院医学伦理委员会批准,所有入组者均已签署知情同意书。
二、检测方法
采用间接免疫荧光法 (IIF) 检测血清ANA、AMA,试剂购自德国欧蒙公司,操作严格按照说明书进行,ANA滴度1∶100为低滴度、1∶320或以上为中高滴度。采用线性免疫印迹分析(LIA)检测AMA-M2、抗sp100、抗gp210,试剂购自深圳亚辉龙公司,操作严格按照说明书进行。统计分析并联结果时,规定5种自身抗体中有任一阳性即计为阳性。将PBC计为病例组,病毒性肝炎计为病例对照组,同时视文中指标均为诊断PBC的指标,在病毒性肝炎出现阳性时视为假阳性,计算各指标诊断PBC的灵敏度、特异度、阳性预测值和阴性预测值。计算公式:灵敏度=真阳性例数/(真阳性+假阴性)×100%,特异度=真阴性例数/(真阴性+假阳性)×100%,阳性预测值=真阳性/(真阳性+假阳性)×100%,阴性预测值=真阴性/(真阴性+假阴性)×100%。
三、统计学处理
采用SPSS 19.0进行统计学分析。计量资料以表示,组间比较采用方差分析。计数资料以例(%)表示,组间比较采用χ2检验,不同抗体间阳性率及诊断效能比较采用McNemar检验。总体比较以P < 0.05为差异有统计学意义,两两比较采用Bonferroni法校正,即P < 0.05/3 = 0.017为差异有统计学意义。
结果
一、PBC组、病毒性肝炎组和正常对照组患者的ANA检出情况比较
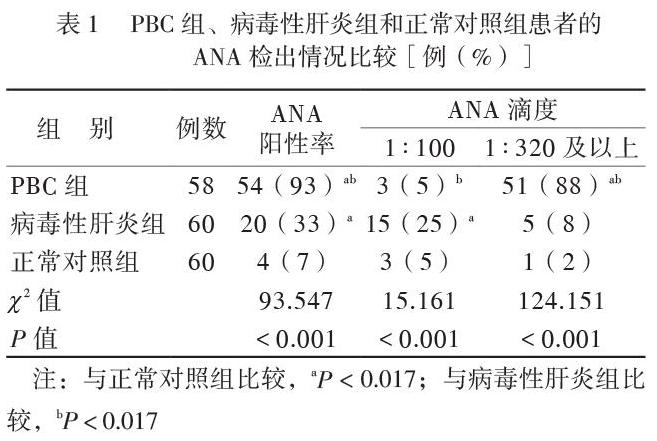
PBC组、病毒性肝炎组和正常对照组患者的ANA阳性率比较差异有统计学意义(P < 0.05),其中PBC组的ANA阳性率最高、正常对照组的ANA阳性率最低,组间两两比较差异均有统计学意义(P均< 0.017)。3组的ANA阳性者中,PBC组以中高滴度为主,中高滴度者比例均高于病毒性肝炎组及正常对照组(P均< 0.017),低滴度者比例低于病毒性肝炎组(P均< 0.017),见表1。
二、PBC组ANA荧光核型检出情况
PBC组ANA荧光核型以胞浆颗粒型与着丝点型为主,其中有部分荧光核型为胞浆颗粒型与其他核型的混合核型,为了方便统计分析,以主要核型为结果计算。PBC组54例ANA阳性患者中,胞浆颗粒型23例(43%)、着丝点型11例(20%)、核膜型6例(11%)、核颗粒型6例(11%)、均质型3例(6%)、核点型3例(6%)、核仁型2例(4%)。
三、PBC组、病毒性肝炎组和正常对照组患者自身抗体单一检测及并联检测的阳性率比较
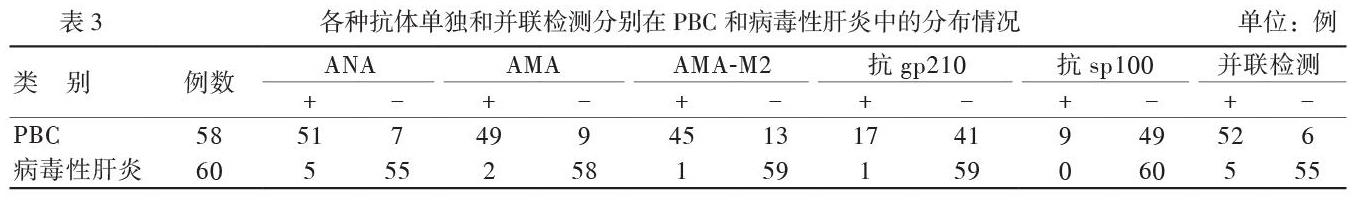
PBC组患者的ANA、AMA、AMA-M2、抗gp210、抗sp100及并联检测的阳性率均高于病毒性肝炎组和正常对照组(P均< 0.017),PBC组中并联检测的阳性率高于单独检测抗gp210和抗sp100(P均< 0.05),见表2。
四、计算各种自身抗体在PBC和病毒性肝炎患者中的诊断效能
所有指标在PBC、病毒性肝炎中的分布情况见表3。ANA(1∶320及以上)、AMA、AMA-M2、抗gp210和抗sp100体以及并联检测在PBC患者中的灵敏度分别为88%(51/58)、85%(49/58)、78%(45/58)、29%(17/58)、16%(9/58)和90%(52/58);特异度分别为92%(55/60)、97%(58/60)、98%(59/60)、98%(59/60)、100%(60/60)和92%(55/60);阳性预测值分别为91%(51/56)、96%(49/51)、98%(45/46)、94%(17/18)、100%(9/9)和91%(52/57);阴性预测值分别为89%(55/62)、87%(58/67)、82%(59/72)、59%(59/100)、55%(60/109)和90%(55/61)。对于鉴别PBC和病毒性肝炎,并联检测、ANA、AMA的灵敏度均高于AMA-M2、抗gp210和抗sp100(P均< 0.05),并联检测、ANA、AMA的阴性预测值均高于抗gp210和抗sp100(P均< 0.05),各种抗体单独和并联检测的特异度、阳性预测值比较差异无统计学意义(P均> 0.05)。
讨论
临床上PBC的自然病史分为4期:第一期为临床前期,肝功能生物化学指标无明显异常,但ANA阳性,这一期持续时间可长达10年以上;第二期为无症状期,肝功能生化指标出现异常,但无明显的临床症状,该期的持续时间可长达5年以上;第三期为症状期,患者出现乏力、皮肤瘙痒等症状,这一期患者的平均生存时间为5 ~ 8年;第四期为失代偿期,该期患者出现腹水、消化道出血、肝性脑病等表现,患者平均生存时间为2 ~ 4年[6]。如果能够在PBC的第一期或第二期及时发现患者,对其及早进行干预和治疗,对改善患者的预后非常重要。另外,广东省是病毒性肝炎的高发地区,病毒性肝炎早期与PBC症状相似,在临床诊断中易混淆,且两者的治疗方案截然不同,因此早期PBC与病毒性肝炎的鉴别诊断非常重要。
PBC属于自身免疫性疾病,自身抗体检测对该类疾病的诊断有很重要的意义,其中ANA筛查很重要,其检测方法有多种,而IIF作为“金标准”,能够比其他方法提供更多的信息,比如ANA核型,虽然不是特定核型出现在相应疾病,但是也起到了一定的提示作用。本研究中,PBC患者核型大部分为胞浆颗粒型或着丝点型,因此建议对于临床表现有乏力、食欲减退、皮肤瘙痒和黄疸等肝损伤症状患者单独检测ANA,若核型出现高滴度胞浆颗粒型或着丝点型,应该进一步做自身免疫性肝炎相关检测,从而为临床诊断和早期干预提供更多理论依据。
AMA是一种以线粒体膜为靶抗原的自身抗体,主要靶抗原是丙酮酸脱氢酶复合物E2亚单位(PDC-E2)。AMA有9种亚型(M1 ~ M9),其中M2亚型对PBC的诊断意义最大[7]。既往研究报道AMA是PBC的特异性指标,阳性率可达90% ~ 95%[8]。本研究中PBC组患者血清AMA的阳性率为84%,AMA-M2的阳性率为78%;而病毒性肝炎组患者血清AMA的阳性率为3%,AMA-M2的阳性率为2%,提示临床医师在接诊病毒性肝炎血清标志物为阴性的肝损伤患者时,应及时筛查患者的AMA及AMA-M2抗体,以早期诊断PBC。另外,临床还存在一部分AMA阴性的PBC患者,国外学者发现有5% ~ 10%的PBC患者血清AMA抗体阴性,而我国学者发现血清AMA抗体阴性的PBC患者约15% ~ 40%,说明PBC患者存在明显的地域差异[6, 9]。既往研究发现,在血清AMA抗体阴性的PBC患者中,约58%的患者血清ANA阳性[10],其中,抗gp210和抗sp100与PBC病情的严重程度相关,是PBC的标志性抗体[11-12]。因此,对疑诊PBC但AMA阴性时,可检测ANA、AMA-M2、抗gp210和抗sp100抗体以协助诊断。本研究中,PBC组患者血清抗gp210和抗sp100抗体的阳性率分别为29%和16%,而病毒性肝炎组患者血清抗gp210和抗sp100的阳性率分别为2%和0%,组间比较差异均有统计学意义,说明抗gp210和抗sp100在诊断PBC患者时特异度较高,但灵敏度较低,这2项指标仅适合PBC诊断中的辅助检查及预后评估,不能用于PBC患者的筛查。临床诊断实验方法可分为3类,即初筛实验、诊断实验和确诊实验,在筛查时选用灵敏度高的初筛实验,确诊时应选用特异度高的确诊实验。
本研究显示,ANA和并联检测均为较佳的诊断指标,但是ANA在其他结缔组织疾病中也有表达,因此单独检测ANA在PBC診断中意义不大,对症状明显的疑似PBC者应同时检查其他自身抗体,如果仅采用LIA筛查PBC,也应选择包含AMA-M2检测项目。
参 考 文 献
[1] Jepsen P, Gr?nb?k L, Vilstrup H. Worldwide incidence of autoimmune liver disease. Dig Dis, 2015,33(Suppl 2):2-12.
[2] Vieira Barbosa J, Vionnet J, Sciarra A, Sempoux C, Aubert V, Moradpour D, Fraga Christinet M. Primary biliary cholangitis : an update. Rev Med Suisse, 2018, 14(616):1489-1494.
[3] 刘伦翠,卢林,高俊英,许秀萍.原发性胆汁性肝硬化22例误诊分析.新医学,2008,39(10):677-678.
[4] 陈欣欣,张海萍,闫惠平.自身免疫性肝病相关自身抗体的检测和临床意义.胃肠病学,2018,23(5):296-299.
[5] 中华医学会肝病学分会.原发性胆汁性肝硬化(又名原发性胆汁性胆管炎) 诊断和治疗共识 (2015).中华肝脏病杂志,2016,20(1):960-968.
[6] 中华医学会肝病学分会,中华医学会消化病学分会,中华医学会感染病学分会.原发性胆汁性肝硬化(又名原发性胆汁性胆管炎)诊断和治疗共识(2015).临床肝胆病杂志,2015,31(12):1980-1988.
[7] 王春霞,王佳佳.原发性胆汁性胆管炎的实验室诊断.中华临床实验室管理电子杂志,2017,5(4):197-199.
[8] European Association for the Study of the Liver. EASL Clinical Practice Guidelines: the diagnosis and management of patients with primary biliary cholangitis. J Hepatol, 2017, 67(1):145-172.
[9] Kaplan MM, Gershwin ME. Primary biliary cirrhosis. N Engl J Med, 2005, 353(12):1261-1273.
[10] Juliusson G, Imam M, Bj?rnsson ES, Talwalkar JA, Lindor KD. Long-term outcomes in antimitochondrial antibody negative primary biliary cirrhosis. Scand J Gastroenterol, 2016,51(6):745-752.
[11] Nakamura M, Kondo H, Mori T, Komori A, Matsuyama M, Ito M, Takii Y, Koyabu M, Yokoyama T, Migita K, Daikoku M, Abiru S, Yatsuhashi H, Takezaki E, Masaki N, Sugi K, Honda K, Adachi H, Nishi H, Watanabe Y, Nakamura Y, Shimada M, Komatsu T, Saito A, Saoshiro T, Harada H, Sodeyama T, Hayashi S, Masumoto A, Sando T, Yamamoto T, Sakai H, Kobayashi M, Muro T, Koga M, Shums Z, Norman GL, Ishibashi H. Anti-gp210 and anti-centromere antibodies are different risk factors for the progression of primary biliary cirrhosis. Hepatology, 2007, 45(1):118-127.
[12] European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol, 2009, 51(2):237-267.
(收稿日期:2019-12-18)
(本文编辑:林燕薇)
