剩余污泥碱性发酵产蛋白酶菌株的筛选与鉴定
2020-07-09接伟光姚延轩彭永臻
接伟光 姚延轩 彭永臻

摘要:为了能够缩短剩余污泥碱性发酵周期,从碱性发酵剩余污泥中筛选产蛋白酶活力较高的耐碱细菌,利用形态学、生理生化、分子生物学特征对筛选到的菌株进行鉴定。结果表明,从碱性厌氧发酵剩余污泥中最终筛选获得2株产蛋白酶活力较高的耐碱细菌HIT-01菌株和HIT-02菌株,经鉴定分别为枯草芽孢杆菌(Bacillus subtilis)和芽孢杆菌属细菌(Bacillus sp.)。为进一步利用筛选获得的优势菌株构建生物菌剂、从而快速启动污泥碱性发酵开拓了新思路。
关键词:剩余污泥;产蛋白酶菌株;筛选;鉴定
中图法分类号:X703 文献标识码:A
文章编号:0439-8114(2020)06-0143-05
DOI:10.14088/j.cnki.issn0439-8114.2020.06.029 开放科学(资源服务)标识码(OSID):
Screening and identification of protease-producing bacteria from
alkaline fermentation of excess sludge
JIE Wei-guang1,2,YAO Yan-xuan2,PENG Yong-zhen1,3,HU Wei2
(1.National Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology,Harbin 150090,China;2.Department of Food and Environment Engineering,East University of Heilongjiang,Harbin 150066,China;3.Key Laboratory of Beijing for Water Quality Science and Water Environment Recovery Engineering,Beijing University of Technology,Beijing 100124,China)
Abstract: In order to shorten the alkaline fermentation period of excess sludge, alkaline-tolerant strains with high protease-producing activity were isolated from alkaline fermentation of excess sludge and identified by morphological. physiological, biochemical, and molecular characteristic analysis. The results showed that the two screened alkali-tolerant bacterial strains (HIT-01 and HIT-02 strains) which of high protease-producing activity were belongs to Bacillus subtilis and Bacillus sp. This study opens a new idea for further utilizing the screened dominant strains to construct microbial agents and quickly activate alkaline fermentation of sludge.
Key words: excess sludge; protease-producing bacteria; screening; identification
城市污泥(简称污泥)是污水处理厂在对城市居民生活污水与工业废水等进行污水处理时所产生的固体废弃物,是污水处理的必然产物,其性状通常是介于固体与液体之间[1]。由于城市和工业的飞速发展,各种生活污水和工业污水等的排放量也随之不断增加,这必然导致污泥产量不断增加[2]。近年来,污泥资源化利用成为了污泥处理处置研究的热点[3-5]。污泥中含有丰富的有机物以及氮、磷等营养元素,其中部分有机物经厌氧消化可产生挥发性脂肪酸(Volatile fatty acids,VFAs),VFAs是污水处理厂生物营养物(氮和磷)去除工艺中最适宜的有机碳源[6,7]。
污泥的种类较多,分类也相对较为复杂,根据污泥的处理方法可以将其分为初次沉淀污泥、剩余活性污泥、腐殖污泥及化学污泥[8,9]。蛋白质和碳水化合物是剩余污泥中的主要有机物,在剩余污泥酸化阶段能够被转化为VFAs,且其中的乙酸和丙酸是污水处理厂用于脱氮除磷工艺优选的有机碳源[10,11]。研究表明,pH显著影响剩余污泥发酵过程中VFAs的产量及组分,且碱性发酵条件能够促进剩余污泥中有机物质的溶出[12-16]。近年来,大量研究结果均表明污泥发酵过程中pH及污泥中微生物菌群结构显著影响VFAs的产量及组分[17-20]。Liu等[21]研究表明,碱性条件有利于污泥中蛋白质转变为VFAs。然而,有关剩余污泥碱性发酵过程中优势产蛋白酶微生物的研究却鲜见报道。
为了能够加速剩余污泥中蛋白质的降解,从而缩短剩余污泥碱性发酵周期并使该過程能够产生更多的VFAs,本研究主要从碱性发酵剩余污泥中筛选产蛋白酶活力较高的耐碱细菌,利用形态学特征、生理生化特征以及分子生物学特征对筛选获得的产蛋白酶菌株进行了鉴定。
1 材料与方法
1.1 污泥来源
试验所用剩余污泥均来自哈尔滨太平污水处理厂二沉池。剩余污泥取回后静置24 h,弃上清液,并置于4 ℃保存。剩余污泥初始性质均在其混合均匀后测定,浓缩后的剩余污泥pH为6.82;总固体含量(TS)为13.68 g/L;挥发性固体含量(VS)为10.36 g/L;溶解性化学需氧量(SCOD)为142.21 mg/L;可溶性蛋白质含量为76.32 mg COD/L;可溶性碳水化合物含量为30.87 mg COD/L。
1.2 培养基
富集培养基:脱脂乳粉10.0 g,酵母提取物3.0 g,(NH4)2SO4 6.7 g,K2HPO4 1.2 g,KH2PO4 0.7 g,MgSO4 0.5 g,NaCl 0.5 g,蒸馏水1 000 mL,pH 10.0,121 ℃灭菌20 min[22]。
琼脂基础培养基:脱脂乳粉10.0 g,酵母提取物3.0 g,(NH4)2SO4 6.7 g,K2HPO4 1.2 g,KH2PO4 0.7 g,MgSO4 0.5 g,NaCl 0.5 g,琼脂粉20.0 g,蒸馏水1 000 mL,pH 10.0,121 ℃灭菌20 min。
透明圈实验培养基:脱脂乳粉10.0 g,可溶性淀粉10.0 g,蛋白胨5.0 g,酵母提取物2.5 g,KH2PO4 0.5 g,MgSO4 0.5 g,NaCl 1.0 g,琼脂粉20.0 g,蒸馏水1 000 mL,pH 10.0,121 ℃灭菌20 min。
LB液体培养基:胰蛋白酶胨10.0 g,酵母提取物5.0 g,NaCl 5 g,蒸馏水1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min。
1.3 菌株的分离与鉴定
1.3.1 菌株的分离 取2.0 g碱性发酵剩余污泥,将其接种于500 mL富集培养基中,通入氮气3 min以保证驱除培养瓶内的氧气,用橡胶塞密封后于120 r/min、30℃条件下厌氧培养48 h。将富集后的培养液进行梯度稀释,取适当梯度的培养液涂布于琼脂基础培养基中,继续在30 ℃条件下厌氧培养48 h。挑选琼脂基础培养基中长势良好的单菌落,并将其在琼脂基础培养基中进行三区划线,然后继续在30 ℃条件下厌氧培养48 h,重复以上操作步骤直至获得细菌纯培养。将以上初筛试验所获得的菌株分别涂布于透明圈实验培养基中,30 ℃条件下厌氧培养48 h后,挑选水解圈直径与菌落直径比值相对较大的单菌落。
1.3.2 菌落形态及透射电镜下菌株形态鉴定 将筛选到的菌株分别接种于LB液体培养基中,30 ℃条件下厌氧培养48 h。观察单菌落颜色、形状和大小等菌落表面特征,并分别对筛选到的菌株进行革兰氏染色。
利用透射电子显微镜观察菌株形态特征。在无菌操作条件下分别挑取筛选到的菌株单菌落,并将其分别接种至100 mL LB液体培养基中,37 ℃条件下恒温培养至其对数生长期,每个菌株取2片带膜铜网制备电镜样品。首先将制备好的菌悬液滴加至硫酸纸上,并将带膜铜网放在菌悬液液滴上吸附3~5 min,然后用滤纸将铜网边缘的菌液吸干;加等量的3%磷钨酸溶液覆盖染色40 s后,立即用滤纸将染液吸干,透射电镜观察。
1.3.3 菌株的生理生化鉴定 根据《伯杰氏细菌鉴定手册》[23]和《常见细菌系统鉴定手册》[24]对分离获得的菌株进行生理生化鉴定,每项检测指标3次重复。
1.3.4 菌株分子生物学鉴定 根据形态学特征将筛选到的菌株初步归类后对其进行分子生物学鉴定。取在LB液体培养基中培养48 h后的细菌培养液1~2 mL,10 000 r/min离心2 min,弃上清液,沉淀物以无菌去离子水反复洗涤并离心2次。采用细菌基因组DNA提取试剂盒(Tiangen,北京)提取洗涤并离心后的沉淀物中细菌基因组DNA。利用1.0%琼脂糖凝胶电泳检测提取到的基因组DNA,采用紫外分光光度计(DU800型,美国 Beckman)测定提取的基因组DNA在260 nm和280 nm波长处的吸收度,计算提取的基因组DNA的浓度及纯度。
采用引物fD1(5′-AGAGTTTGATCCTGGCTCAG -3′)和rP2(5′-ACGGCTACCTTGTTACGACTT-3′)[25],扩增细菌核糖体16S rDNA,扩增片段大小约为1.6 kb。PCR扩增条件为:95 ℃预变性5 min;94 ℃变性1 min,57 ℃退火50 s,72 ℃延伸1 min,30个循环;72 ℃继续延伸10 min,4 ℃保存。用1.2%琼脂糖凝胶电泳检测PCR扩增产物。挑选阳性克隆结果送往生工生物工程(上海)股份有限公司测序,将测序获得的16S rDNA序列提交至GenBank数据库,利用NCBI的BLASTN程序对测序所得16S rDNA序列进行同源性比对,得到相关细菌种属的序列信息,使用MEGA5.1软件对其进行系统发育分析。
2 结果与分析
2.1 形态学特征
从碱性(pH 10.0)发酵剩余污泥中共筛选分离出17株细菌,通过初筛获得6株生长稳定且耐碱能力较强的产蛋白酶菌株,经进一步复筛最终获得2株产蛋白酶活力较高的耐碱细菌,将其分别命名为HIT-01菌株和HIT-02菌株,并对其进行鉴定。
菌株HIT-01在LB液体培养基上生长时,所形成的菌落颜色呈浅黄色、不透明,菌落形状呈圆形、扁平、边缘整齐、表面干燥且不容易被挑起。菌株HIT-02在LB液体培养基上生长时所形成的菌落颜色呈乳白色、不透明,菌落形状呈圆形、中心微凸起、边缘呈锯齿形、表面湿润且容易被挑起。革兰氏染色后经镜检,菌株HIT-01和HIT-02均为革兰氏阳性杆菌,能形成芽孢,芽孢为椭圆状。菌株HIT-01芽孢位于菌体极端或次极端,芽孢形成后菌体不膨大;菌株HIT-02芽孢位于菌体中央或次极端,芽孢形成后菌体膨大。通过透射电镜观察菌株HIT-01的菌体形态如图1A所示,菌株HIT-01为杆菌,单个或成对排列,菌体大小约为(0.82~1.13) μm×(3.16~3.57) μm,周生鞭毛;菌株HIT-02菌體形态如图1B所示,为杆菌,成对或链状排列,菌体大小约为(0.72~1.06) μm×(1.83~2.19) μm,极生鞭毛。
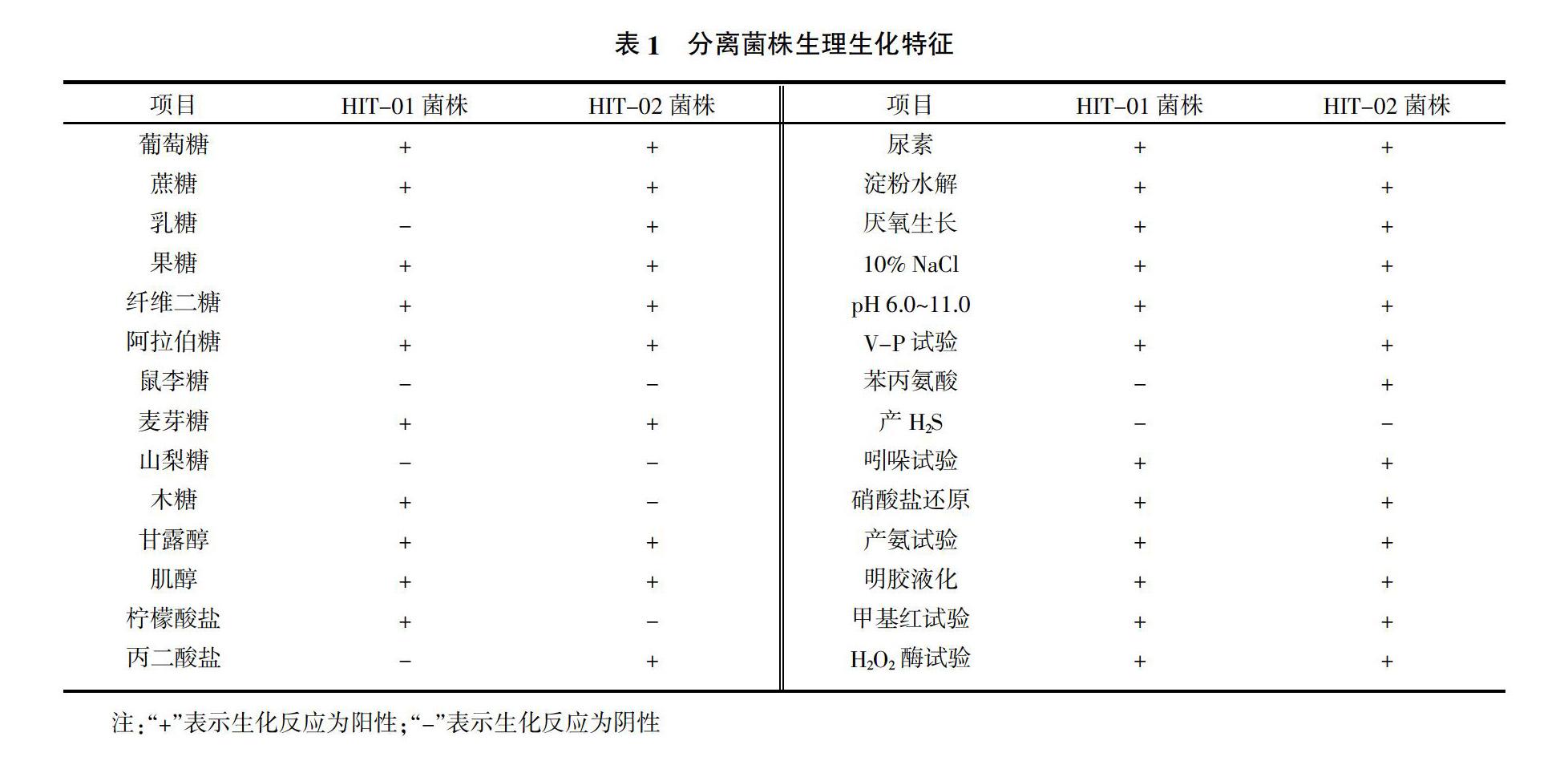
2.2 生理生化特征
HIT-01菌株LB液體静置培养时培养基表面产生菌膜,液体澄清无沉淀;HIT-02菌株LB液体静置培养时培养基表面不产生菌膜,液体混浊有沉淀。根据HIT-01和HIT-02菌株生理生化特征(表1),并参照《伯杰氏细菌鉴定手册》[23]和《常见细菌系统鉴定手册》[24]进行相关分析,初步鉴定HIT-01菌株和HIT-02菌株均为芽孢杆菌属(Bacillus sp.)细菌。
2.3 分子生物学特征
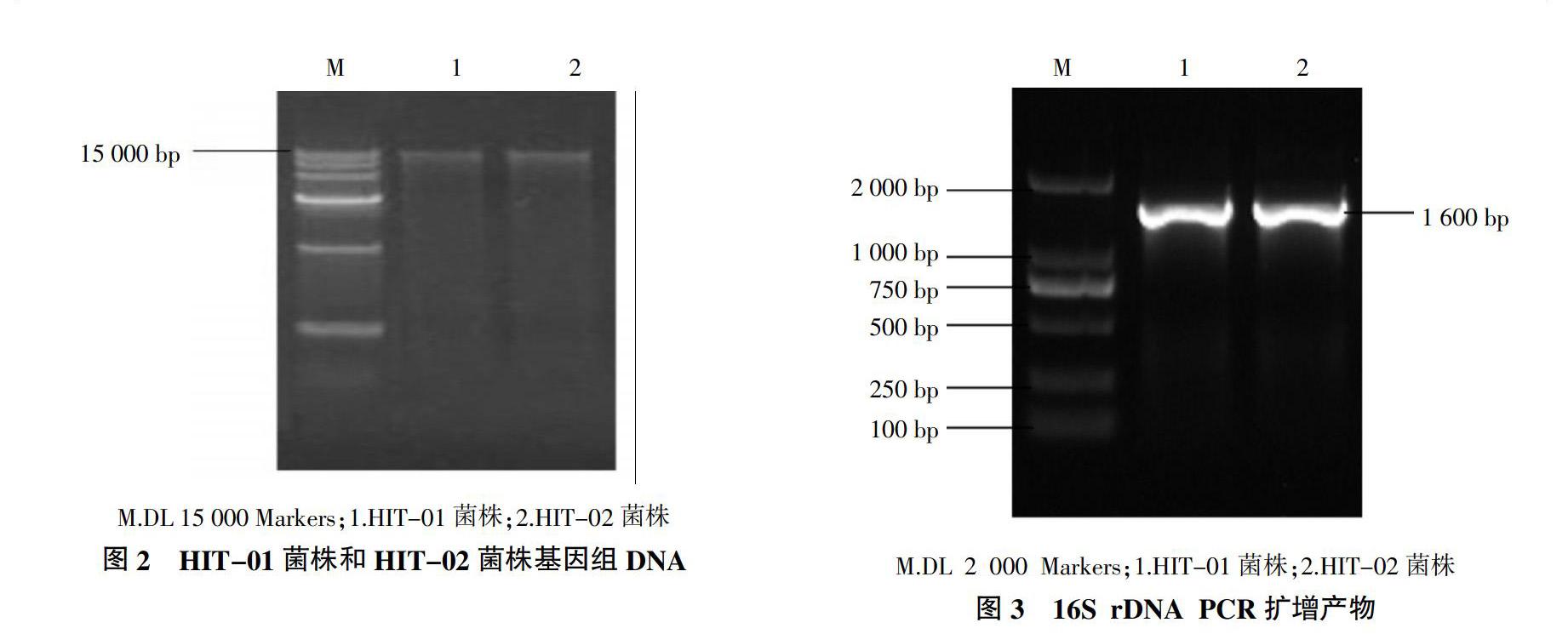
2.3.1 基因组DNA的提取 利用1.0%琼脂糖凝胶电泳检测采用细菌基因组DNA提取试剂盒提取的HIT-01菌株和HIT-02菌株基因组DNA。由图2可知,HIT-01菌株和HIT-02菌株基因组DNA片段大小均在15 000 bp以上,而且条带清晰。
由表2可知,HIT-01菌株和HIT-02菌株基因组DNA浓度以及OD260 nm/280 nm和OD260 nm/230 nm均符合PCR要求,可以进行后续试验。
2.3.2 PCR扩增结果 HIT-01菌株和HIT-02菌株的16S rDNA PCR扩增产物经1.0%琼脂糖凝胶电泳检测,目的DNA条带大小均约为1 600 bp(图3),条带大小正确,条带清晰,可进行后续试验。
2.3.3 测序结果分析 将HIT-01与HIT-02菌株的16S rDNA测序结果分别提交至GenBank数据库,获得的GenBank登录号分别为KF738663与KF738664。为显示HIT-01和HIT-02菌株与GenBank数据库中已知菌株之间的亲缘关系及其系统地位,分别将HIT-01与HIT-02菌株的16S rDNA序列与GenBank数据库中的已知菌株序列进行比对,并获得同源性信息,结果HIT-01菌株的16S rDNA序列与Bacillus subtilis(DQ993674)的相似性最高,其相似性高达99%;HIT-02菌株的16S rDNA序列与Bacillus sp.(AB243843)的相似性最高,其相似性为98%。利用MEGA 5.1软件对HIT-01和HIT-02菌株的16S rDNA序列与GenBank数据库中的已知近缘菌株序列构建系统发育进化树,采用Neighbor-joining法对其进行评价(图4)。由图4可知,HIT-01菌株与Bacillus subtilis(DQ993674)、Bacillus amyloliquefaciens(KF156785)和Bacillus velezensis(EF433407)聚为一簇,说明他们之间的相似性较高。而HIT-02菌株与由GenBank数据库中所获得的其他15个已知近缘细菌16S rDNA序列相似性较高并聚为一簇。研究表明,芽孢杆菌属(Bacillus)中的一些细菌能够在强碱性条件下生存或产生碱性蛋白酶[25]。然而,由于HIT-02菌株与GenBank数据库中已知近缘细菌16S rDNA序列同源性相对较低,因此无法将其准确鉴定到种的水平。
基于HIT-01菌株和HIT-02菌株的形态学特征、生理生化特征和分子生物学特征鉴定结果,将其分别鉴定为Bacillus subtilis和Bacillus sp.。
3 结论
为了能够缩短剩余污泥碱性发酵周期,并使剩余污泥在碱性发酵过程中能够产生更多的VFAs,本研究从碱性发酵剩余污泥中筛选产蛋白酶菌株,并对筛选获得的菌株进行了形态学特征、生理生化特征以及分子生物学特征鉴定。同时,为保证筛选获得的产蛋白酶菌株应用于剩余污泥碱性发酵,得出以下结论。
1)从碱性发酵剩余污泥中共筛选出17株细菌,经初筛后获得6株生长稳定且耐碱能力较强的产蛋白酶菌株,通过进一步复筛最终获得2株产蛋白酶活力较高的耐碱细菌,并将其分别命名为HIT-01菌株和HIT-02菌株。
2)经形态学特征、生理生化特征以及分子生物学特征鉴定,将本研究筛选获得的耐碱且产蛋白酶能力较高的菌株HIT-01和HIT-02分别鉴定为枯草芽孢杆菌(Bacillus subtilis)和芽孢杆菌属细菌(Bacillus sp.)。
参考文献:
[1] 白莉萍,伏亚萍.城市污泥应用于陆地生态系统研究进展[J].生态学报,2009,29(1):416-426.
[2] 李 琼,华 珞,徐兴华,等.城市污泥农用的环境效应及控制标准的发展现状[J].中国生态农业学报,2011,19(2):468-476.
[3] YUAN H Y,CHEN Y G,ZHANG H X,et al. Improved bioproduction of short-chain fatty acids (SCFAs) from excess sludge under alkaline conditions[J].Environmental science and technology,2006,40(6):2025-2029.
[4] WU H Y,YANG D H,ZHOU Q,et al. The effect of pH on anaerobic fermentation of primary sludge at room temperature[J].Journal of hazardous materials,2018,172(1):196-201.
[5] YAN Y Y,FENG L Y,ZHANG C J,et al. Ultrasonic enhancement of waste activated sludge hydrolysis and volatile fatty acids accumulation at pH 10.0[J].Water research,2010,44(11):3329-3336.
[6] ZHANG C,CHEN Y,RANDALL A A,et a1. Anaerobic metabolic models for phosphorus and glycogen accumulating organisms with mixed acetic and propionic acids as carbon sources[J].Water research,2008,42(14):3745-3756.
[7] ZHANG C,CHEN Y G. Simultaneous nitrogen and phosphorus recovery from sludge-fermentation liquid mixture and application of the fermentation liquid to enhance municipal wastewater biological nutrient removal[J].Environmental science and technology,2009,43(16):6164-6170.
[8] 趙 璇,张 蓓,李 琛.城市污泥综合利用研究进展[J].化工技术与开发,2011,40(6):56-60.
[9] 高 鹏,张 栋,贾舒婷,等.污水厂污泥厌氧消化产短链脂肪酸研究进展[J].化工进展,2013,32(9):2227-2232.
[10] YANG X,DU M A,LEE D J,et al. 2012. Enhanced production of volatile fatty acids (VFAs) from sewage sludge by β-cyclodextrin[J].Bioresource technology,2012,110:688-691.
[11] LUO K,YANG Q,YU J,et al. Combined effect of sodium dodecyl sulfate and enzyme on waste activated sludge hydrolysis and acidification[J].Bioresource technology,2011,102(14):7103-7110.
[12] ZHANG P,CHEN Y,ZHOU Q. Waste activated sludge hydrolysis and short-chain fatty acids accumulation under mesophilic and thermophilic conditions:Effect of pH[J].Water research,2009,43(15):3735-3742.
[13] YU H,WANG Z,WANG Q,et al. Disintegration and acidification of MBR sludge under alkaline conditions[J].Chemical engineering journal,2017,231:206-213.
[14] YU H Q,ZHENG X J,HU Z H,et al. High-rate anaerobic hydrolysis and acidogenesis of sewage sludge in a modified upflow reactor[J].Water science and technology,2003,48(4):69-75.
[15] ELEFSINIOTIS P,WAREHAM D G,SMITH M O. Use of volatile fatty acids from an acid-phase digester for denitrification[J].Journal of biomedicine & biotechnology,2004,114(3):289-297.
[16] 苏高强,汪传新,郑冰玉,等.pH对混合污泥水解酸化的影响[J].环境工程学报,2012,6(12):4257-4262.
[17] WU H Y,GAO J Y,YANG D H, et al. Alkaline fermentation of primary sludge for short-chain fatty acids accumulation and mechanism[J].Chemical engineering journal,2010,160(1):1-7.
[18] YU H Q,FANG H H P. Acidogenesis of dairy wastewater at various pH levels[J].Water science and technology,2002,45(10):201-206.
[19] HORIUCHI J I,SHIMIZU T,KANNO T,et al. Dynamic behavior in response to pH shift during anaerobic acidogenesis with a chemostat culture[J].Biotechnology techniques,1999,13(3):155-157.
[20] HORIUCHI J I,SHIMIZU T,TADA K,et al. Selective production of organic acids in anaerobic acid reactor by pH control[J].Bioresource technology,2002,82(3):209-213.
[21] LIU H,WANG J,LIU X,et al. Acidogenic fermentation of proteinaceous sewage sludge:Effect of pH[J].Water research,2012,46(3):799-807.
[22] LEE S H,CHUNG W C,YU Y J,et al. Effect of alkaline protease-producing Exiguobacterium sp. YS1 inoculation on the solubilization and bacterial community of waste activated sludge[J].Bioresource technology,2009,100(20):4597-4603.
[23] BRENNER D J,KRIEG N R,STALEY J T. Bergeys Manual of systematic bacteriology[M].Second edition.New York,USA:Williams wilkins,2005.
[24] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].第二版.北京:科学出版社,2001.
[25] WEISBURG W G,BARNS S M,PELLETIER D A,et al. 16S ribosomal DNA amplification for phylogenetic study[J].Journal of bacteriology,1991,173(2):697-703.
