重庆市豌豆枯萎病病原菌的分离与鉴定
2020-07-09张慧马连杰冯牧野
张慧 马连杰 冯牧野


摘要:采用组织分离法,对重庆市豌豆枯萎病病原菌进行分离和纯化,结合形态学和基因序列分析对分离物进行鉴定,采用无伤接种法测定分离物对豌豆离体叶片、茎秆的致病性。结果表明,从枯萎病样品中分离获得5株菌株,菌落为圆形,初期为白色絮状,后期呈黄棕色至褐色;供试菌株的ITS序列和G3PDH基因序列与Ascochyta pinodes的同源性达到99%;致病性测定结果表明,供试菌株对豌豆叶片及茎秆均有致病性。表明引起重庆市豌豆枯萎病的病原菌为Ascochyta pinodes。
关键词:豌豆;豌豆枯萎病;病原鉴定;Ascochyta pinodes
中图分类号:S436.43 文献标识码:A
文章编号:0439-8114(2020)06-0084-04
DOI:10.14088/j.cnki.issn0439-8114.2020.06.016 开放科学(资源服务)标识码(OSID):
Isolation and identification of pathogen of pea fusarium wilt in Chongqing city
ZHANG Hui,MA Lian-jie,FENG Mu-ye,LU Wen-cai,LIAO Dun-xiu
(Institute of Agricultural Resources and Environment,Chongqing Academy of Agricultural Sciences,Chongqing 401329,China)
Abstract: The tissue isolation method was used to isolate and purify the pathogen of spot of fusarium wilt of peas in Chongqing city, and the isolates were identified by combining with the analysis of morphology and gene sequence. The pathogenicity of the isolates to the leaves and stems of isolated peas was determined by the method of inoculation without injury. The results showed that five strains were isolated from infected leaves. The colony was round, white flocculent in the early stage and yellowish brown to brown in the later stage; The homology of ITS sequence and G3PDH gene sequences of the tested strain reached 99% with that of Ascochyta pinodes; The results of pathogenicity determination showed that the strain had pathogenicity to both leaves and stems of pea. It indicated that Ascochyta pinodes was the cause of pea blight in Chongqing city.
Key words: pea; pea fusarium wilt; pathogens identified; Ascochyta pinodes
豌豆是中国食用豆的一个主要品种,中国豌豆生产量占全球豌豆总产量的60%以上。中国是第二大干豌豆生产国家,2013年干豌豆产量达1 566亿t。在生产上,豌豆病害是制约产量提高的重要因素。已报道的豌豆病害有25余种[1],而豌豆壳二孢枯萎病(常被称为黑斑病)是豌豆最严重的病害之一,分布于世界各地,包括几乎所有种植豌豆的区域[2]。该病菌可为害植株的根、茎、叶和豆荚,造成豌豆产量减少10%~60%[1,3]。壳二孢枯萎病是由Ascochyta pinodes(有性态Mycosphaerella pinodes)、Phoma medicaginis、Ascochyta pisi(有性态Didymella pisi)和Phoma koolunga复合侵染引起的真菌病害[4,5]。这种枯萎病复合物引起一系列不同的症状,包括黑斑、脚腐、茎腐、叶片和荚果斑点。Ascochyta pinodes可以侵染豌豆植株的幼苗和所有地上部分,引起壞死性叶斑,茎基部变黑,幼苗蛀烂。由Phoma pinodella引起的症状与Ascochyta pinodes症状相似。然而,Phoma pinodella侵染可导致更严重的基部腐烂症状,可以延伸到地面以下,同时对叶、茎和荚果造成的损害较小。Ascochyta pisi侵染叶片、荚果和茎,这种病原菌通常不会侵染豌豆植物茎基部,引起脚腐[6]。这3种病原菌均可以引起豌豆枯萎病,且又极其相似,鉴定过程中容易将其混淆。通过调查发现豌豆枯萎病在重庆市普遍发生,且严重影响豌豆的产量和品质,但目前国内对该病害的报道较少[7],并且不同地区引起该病害的病原菌种类也各不相同。鉴于此,本研究基于形态学特征、ITS序列和功能基因G3PDH序列分析鉴定病原菌种类,并经柯赫氏法则对病菌的致病性进行验证,以明确重庆市豌豆枯萎病的致病菌,为进一步研究该病害的发病规律、防治措施和豌豆抗病品种的培育提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试植物 于2016年11—12月从永川区和垫江县沙坪镇发现豌豆病株,采集具有典型症状的豌豆叶片及茎秆,将病叶及茎秆保存于标本袋内带回实验室进行病原菌分离。
1.1.2 培养基 ①马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂12 g,去离子水1 000 mL。②燕麦琼脂培养基(OA):燕麦片30 g,琼脂15 g,去离子水1 000 mL。
1.1.3 试剂及仪器 PCR扩增试剂盒2×Taq PCR Mix,生工生物工程(上海)股份有限公司;DL 2 000 DNA Marker,宝生物工程大连有限公司;其余试剂均为国产分析纯。MJ Mini PCR 扩增仪,美国伯乐公司;DYY-7B电泳仪,北京六一仪器厂;UVP凝胶成像系统,美国UVP公司;BPX-272恒温培养箱,上海博迅实业有限公司医疗设备厂。
1.2 方法
1.2.1 病原菌的分离与纯化 每株豌豆选取茎、叶2个部位,先用无菌水冲洗,从病叶病健交界处剪切2~3 mm小块组织,在75%乙醇中浸泡2~3 s,再用1%的氯化汞溶液浸泡3 min,再用灭菌水冲洗4次,然后用无菌滤纸吸去多余的水分,用无菌镊子将组织块放在PDA培养基上培养。25 ℃恒温、黑暗培养5 d后,将长出的菌落进行纯化,纯化后的菌株于4 ℃冰箱中保存备用。
1.2.2 菌株的致病性测定 采用无伤接种法进行致病性测定。随机选取1株纯化菌株WHYC2平板培养活化。取健康新鲜无伤的豌豆叶10片,用自来水冲洗干净,经75%乙醇表面消毒,晾干,将测试菌株菌饼(5 mm)贴接于叶片和茎基部,对照用无菌培养基块,放入铺有湿润滤纸的发芽盒内,每个测试菌株分别接种豌豆叶片及茎秆,每个叶片、茎秆接种1个位点,于25 ℃恒温培养7 d,观察发病情况。
1.2.3 病原菌的鉴定 ①病原菌的形态鉴定。将菌株接种于PDA培养基、OA培养基中,25 ℃光暗交替培养,6 d后观察菌落颜色、形状。②病原菌的分子鉴定。用CTAB法提取基因组DNA,采用通用引物ITS4/ITS5和AscGAPDH-F/AscGAPDH-R[7]进行PCR扩增,引物合成及测序由北京六合华大基因科技有限公司完成。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min。采用1.0%琼脂糖凝胶电泳检测扩增结果,测序所得序列在GenBank中进行同源性比对,用MEGA 6.0软件以邻接法构建系统发育树。
2 结果与分析
2.1 病原菌的分离
从豌豆病叶病茎上共分离得到5株菌株,从永川区分离到2株,垫江县分离到3株,该菌为害豌豆植物的幼苗和所有地上部分,在葉上形成病斑,并不断扩展,形成棕色和褐色的圆环(图1a)。茎上的病斑一般是蓝黑色或黑紫色,造成茎基部变黑坏死和叶斑症状(图1b),坏死斑很少扩展至土表以下,引起种子皱缩和变色,病斑上生小黑点。发生严重时病斑密集成片,叶片枯死,全田发病植株茎叶灰色干枯死亡(图1c)。
2.2 病原菌的致病性
菌株WHYC1接种3 d后接种部位出现明显的病害症状,接种点发暗,周围出现水渍状腐烂。继续保湿条件下,叶部病斑继续扩大,水渍状部位连成一片呈软腐状(图2a)。茎秆的接种部位变黑呈长条状,棕褐色病斑(图2b)。采集发病叶片进行病原菌再次分离,所得的分离物与WHYC1菌落形态一致,证实分离菌为豌豆枯萎病病原菌。
2.3 病原菌的形态特征
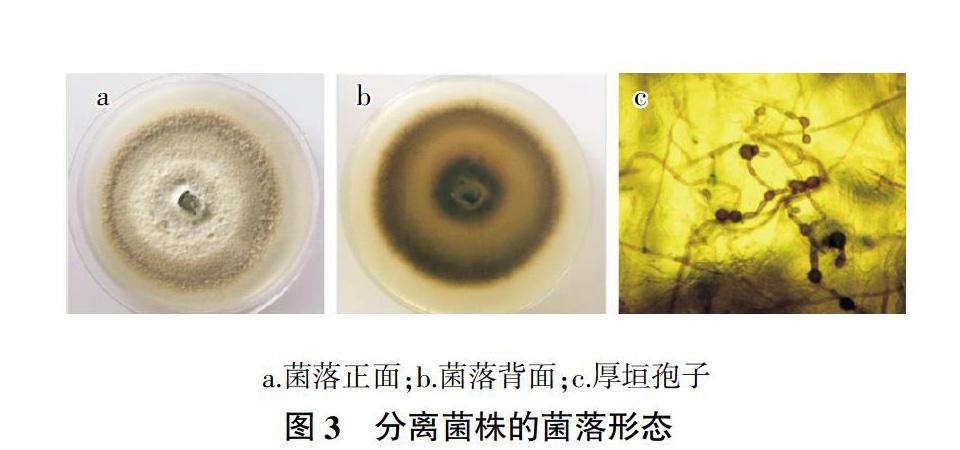
菌株WHYC1在PDA上进行纯培养,前6 d内,菌落为白色,圆形,菌丝絮状,致密,不易产生子座、分子孢子器等子实体(图3a、图3b);15 d后,菌落变成黄棕色至褐色;在PDA长时间培养后,菌丝老熟变褐色并产生厚垣孢子(图3c),厚垣孢子单个或成串产生在菌丝顶端或中间,黑褐色,球形至不规则形,多数光滑。培养条件下未发现分生孢子器及分生孢子。
2.4 病原菌rDNA-ITS
利用真菌通用引物ITS1/ITS4对菌株WHYC1的基因组DNA进行PCR扩增,获得约520 bp的序列。BLAST分析结果表明,菌株WHYC1的ITS序列与GenBank中Ascochyta pinodes(FJ165554.1)、Ascochyta pinodes(FJ200219.1)、Phoma pinodella PC2(DQ826427.1)和Phoma pinodella CBS(AY831562.1)的同源性高达99%。从GenBank数据库中选取代表菌株ITS序列,以Phoma macrostoma ATCC 24524 (DQ474069.1)、Pleosporales sp. M1C(KP122266.1)、Peyronellaea prosopidis CPC(KF777180.1)作为外群建立系统发育树,结果显示,病原菌菌株WHYC1与亲缘关系较近的Ascochyta pinodes和Phoma pinodella菌株在系统发育树中聚为一类,但ITS不能区分Ascochyta pinodes和Phoma pinodella(图4)。
2.5 病原菌G3PDH基因序列分析
利用引物AscGAPDH-F/AscGAPDH-R对代表菌株WHYC1进行G3PDH基因序列扩增,均获得约492 bp的序列。BLAST分析结果表明,菌株WHYC1的G3PDH序列与GenBank中Ascochyta pinodes MP2(DQ383976.1)同源性高达99%。从GenBank数据库中选取代表菌株G3PDH序列,以Ascochyta pisi AP5(DQ383965.1)作为外群建立系统发育树,结果显示,G3PDH基因序列可将壳二孢属(Ascochyta)的不同种显著区分,菌株WHYC1与Ascochyta pinodes位于同一分支,聚为一类,壳二孢属的其他种位于不同分支,进一步确定重庆豌豆枯萎病的病原菌为Ascochyta pinodes(图5)。
3 小結与讨论
壳二孢属引起的豌豆枯萎病是由多种真菌引起的病害,包括Ascochyta pinodes、Phoma pinodella、Ascochyta pisi、Phoma koolunga,Phoma herbarum和Phoma glomerata。这些病原菌可以同时发生在一块豌豆田,甚至同时发生在一株豌豆上。然而,壳二孢真菌的种群结构和分布在不同地区均有所不同,Ascochyta pinodes是加拿大和法国豌豆的主要致病菌[8-13]。Ascochyta pinodes和Phoma pinodella是澳大利亚豌豆主要致病菌,而Phoma koolunga主要分布在澳大利亚南部[14]。在立陶宛Ascochyta pisi是豌豆枯萎病主要的致病菌,占复合物分离的一半,而在某些地方,Ascochyta pinodes和Phoma pinodella则是主要致病菌[15]。在本研究中,从永川区以及垫江县分离得到5株病原菌,通过ITS和G3PDH序列鉴定,5株菌均为Ascochyta pinodes。前人研究表明,ITS序列可以将Ascochyta pinodes和Phoma pinodella与Ascochyta pisi和Phoma koolunga区分开,但是不能区分Ascochyta pinodes和Phoma pinodella[4,15,16],与本研究结果一致。通过G3PDH序列构建系统发育树进行分析能有效地区分Ascochyta pinodes和Phoma pinodella[15]。本研究中,根据形态学特征ITS和G3PDH序列分析确定,Ascochyta pinodes是引起重庆市蚕豆枯萎病的主要病原菌。有关该病害的发生流行规律、侵染循环及防治措施等还需进一步研究。
参考文献:
[1] KRAFT J M,PFLEGER F L. Compendium of pea diseases and pests[M].St Paul,Minnesota:American phytopathological society press,2001.
[2] BRETAG T W,KEANE P J,PRICE T V. The epidemiology and control of ascochyta blight in field peas: A review[J].Australian journal of agricultural research,2006,57(8):883-902.
[3] TIVOLI B,B?魪ASSE C,LEMARCHAND E,et al. Effect of ascochyta blight (Mycosphaerella pinodes) on yield components of single pea (Pisum sativum) plants under field conditions[J].Annals of applied biology,1996,129(2):207-216.
[4] DAVIDSON J A,HARTLEY D,PRIEST M,et al. A new species of Phoma causes ascochyta blight symptoms on field peas (Pisum sativum) in South Australia[J].Mycologia,2009,101(1):120-128.
[5] LIU J F,CAO T S,FENG J,et al. Characterization of the fungi associated with ascochyta blight of field pea in Alberta,Canada[J].Crop protection,2013,54:55-64.
[6] CHILVERS M I,ROGERS J D,DUGAN F M,et al. Didymella pisi sp. nov.,the teleomorph of Ascochyta pisi[J].Mycological research,2009,113(3):391-400.
[7] LIU N,XU S C,YAO X F,et al. Studies on the control of ascochyta blight in field peas (Pisum sativum L.) caused by Ascochyta pinodes in Zhejiang province,China[J].Frontiers microbiology,2016,7:481.
[8] MOUSSART A,TIVOLI B,LEMARCHAND E,et al. Role of seed infection by the ascochyta blight pathogen of dried pea (Mycosphaerella pinodes) in seedling emergence, early disease development and transmission of the disease to aerial plant parts[J].European journal of plant pathology,1998,104(1):93-102.
[9] TIVOLI B,BANNIZA S. Comparison of the epidemiology of ascochyta blights on grain legumes[J].European journal of plant pathology,2007,119:59-76.
[10] GOSSEN B D,HWANG S F,CONNER R L,et al. Managing the ascochyta blight complex on field pea in western Canada[J].Prairie soils and crops journal,2011,4:135-141.
[11] LE MAY C,GUIBERT M,LECLERC A,et al. A single,plastic population of Mycosphaerella pinodes causes ascochyta blight on winter and spring peas (Pisum sativum) in France[J].Applied and environmental microbiology,2012,78(23):8431-8440.
[12] AHMED H,CHANG K F,HWANG S F,et al. Morphological characterization of fungi associated with the ascochyta blight complex and pathogenic variability of Mycosphaerella pinodes on field pea crops in central Alberta[J].The crop journal,2015,3(1):10-18.
[13]ESNULEVIIEN R,GAURILIKIEN I,RAMANAUSKIEN J. Control of ascochyta blight (Ascochyta complex) in pea under Lithuanian conditions[J].Zemdirbyste-Agriculture,2014,101(1):101-108.
[14] FATEHI J,BRIDGE P D,PUNITHALINGAM E. Molecular relatedness within the “Ascochyta pinodes-complex”[J].Mycopathologia,2003,156(4):317-327.
[15] PEEVER T L,BARVE M P,STONE L J,et al. Evolutionary relationships among Ascochyta species infecting wild and cultivated hosts in the legume tribes Cicereae and Vicieae[J].Mycologia,2007,99(1):59-77.
[16] TADJA A,BENKADA M Y,RICKAUER M,et al. Characterization of ascochyta as pathological species of pea (Pisum sativum L.) at the north-west of Algeria[J].Journal of agronomy,2009,8(3):100-106.
