噻托溴铵联合BiPAP 呼吸机对COPD伴呼吸衰竭患者的疗效
2020-07-07周延生
周延生
(汝阳县人民医院,河南 洛阳471200)
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Diseases,COPD)多发于老年人,以气流受限不完全可逆为特征,患者发病后,存在呼吸障碍,出现胸闷、气喘、咳嗽、咳痰等症状[1]。如不及时接受治疗,可引发呼吸肌疲劳、呼吸道感染及呼吸衰竭等严重并发症,危及患者生命安全。目前临床治疗COPD合并呼吸衰竭可采用辅助通气及呼吸兴奋剂等药物治疗,但单独采用呼吸机或呼吸兴奋剂治疗效果不佳,可导致呼吸机相关肺炎[2-3]。而在呼吸机基础上加用噻托溴铵等选择性抗胆碱药物治疗,可扩张患者支气管,改善患者病情[4]。本研究自2018年1月—2019 年1 月选取了70 例COPD 合并呼吸衰竭患者,采用噻托溴铵联合双水平气道内正压无创通气(Bi-Level Positive Airway Pressure,BiPAP)呼吸机进行治疗,取得满意效果,现报道如下。
1 资料与方法
1.1 一般资料 选择我院收治的COPD伴呼吸衰竭患者70 例,随机分为对照组和观察组,每组35 例。对照组男18 例,女17 例;年龄63~81 岁,平均年龄(69.42±3.57)岁;COPD 病程2~7 年,平均病程(5.52±1.28)年;肺功能分级:Ⅱ级15 例,Ⅲ级20例。观察组男19例,女16例;年龄62~82岁,平均年龄(69.51±3.18)岁;COPD 病程2~9 年,平均病程(5.39±1.42)年;肺功能分级:Ⅱ级13 例,Ⅲ级22例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院医学伦理委员会批准,患者及家属均签署知情同意书。
纳入标准:符合《慢性阻塞性肺疾病诊治指南(2013 年修订版)》[5]诊断标准,并经胸部CT 确诊;符合《慢性呼吸衰竭中医证候诊断标准(2012版)》[6]诊断标准;患者有胸闷、气短、痰液颜色变化等症。排除标准:合并支气管哮喘等呼吸系统疾病;合并肺部感染史;入组前1 个月接受过药物治疗者;对本研究药物有过敏反应者;合并意识障碍、不配合治疗者。
1.2 方法 均给予抗感染、纠正电解质、止咳、化痰、呼吸兴奋等常规治疗。对照组采用BiPAP 呼吸机治疗,采用飞利浦公司生产的ST30型呼吸机进行辅助通气,模式选择自主呼吸/定时模式,参数设置:呼吸频率(10~16)次/min,吸气时间0.8~1.2 s,吸氧浓度30% ~50% ,呼气相正压(2~4)cm H2O,吸气相正压(6~8)cm H2O,根据患者情况每10 min 调整一次呼吸参数,逐渐将吸气相正压增加至(4~6)cm H2O,将吸气相正压增加至(12~20)cm H2O。使用呼吸机过程中监测患者血氧饱和度,使其维持在90% ~95% 为适宜。每次使用>10 h,2次/d,两次使用间隔时间>20 min,给予患者进食、休息,并进行排痰或吸痰。观察组在对照组基础上,给予噻托溴铵吸入粉雾剂(南昌弘益药业有限公司,国药准字H20130110,规格:18 μg)治疗,18 μg/次,1 次/d。两组患者均连续治疗7 d为1疗程。
1.3 评价指标 治疗前及治疗1 个疗程后,比较两组血清炎症因子水平、呼吸指数(Respiratory Index,RI)及氧合指数(Oxygenation Index,OI);采集患者空腹静脉血3 ml,离心取血清,选用美国thermo scientific全自动酶标仪及上海巧伊生物有限公司生产的试剂盒,按照说明书,采用双抗体夹心酶联免疫吸附试验检测C反应蛋白(C-reactive protein,CRP)、白细胞介素-6(Inter leukin 6,IL-6)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)。指导患者呼吸,取半卧位,静卧10 min 后,采集股动脉血3 ml,进行肝素抗凝,采用ITC公司生产的IRMATRUPOINT型血气分析仪及配套试剂检测RI及OI。
1.4 统计学处理 应用SPSS24.0软件,计量资料以±s表示,采用t 检验;计数资料以n(% )表示,采用χ2检验;以P<0.05为差异具有统计学意义。
2 结果
2.1 两组氧合功能比较 见表1。
2.2 两组血清炎症因子比较 见表2。
表1 两组氧合功能比较(±s)
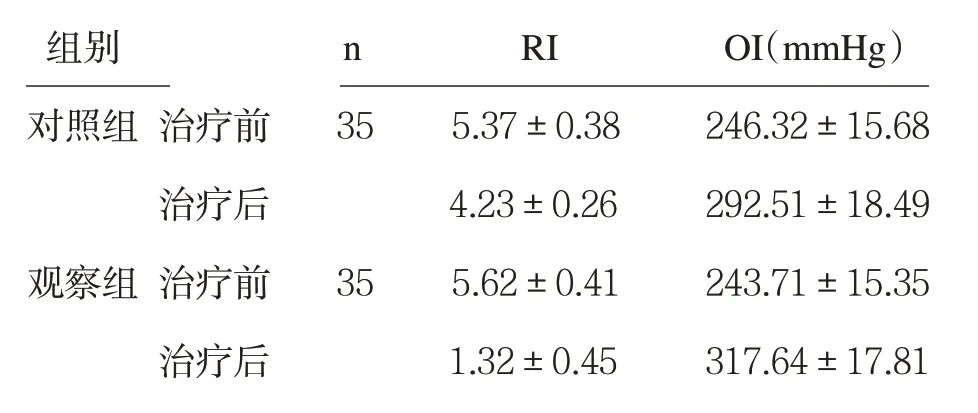
表1 两组氧合功能比较(±s)
两组治疗前RI 及OI 值比较,P>0.05;两组治疗后RI值均低于治疗前,OI值均高于治疗前,且观察组治疗后RI值低于对照组,OI值高于对照组,两组比较,P均<0.05。
组别 n RI OI(mmHg)对照组 治疗前 35 5.37±0.38 246.32±15.68治疗后 4.23±0.26 292.51±18.49观察组 治疗前 35 5.62±0.41 243.71±15.35治疗后 1.32±0.45 317.64±17.81
表2 两组血清炎症因子比较()

表2 两组血清炎症因子比较()
两组治疗前CRP、IL-6、TNF-α水平比较,P均>0.05;两组治疗后CRP、IL-6、TNF-α水平均低于治疗前,且观察组治疗后CRP、IL-6、TNF-α水平均低于对照组,两组比较,P均<0.05。
组别 n CRP(mg/L) IL-6(ng/L) TNF-α(ng/L)对照组 治疗前 35 12.03±1.94 46.25±9.74 75.61±9.23治疗后 9.69±1.34 25.12±8.94 43.17±8.25观察组 治疗前 35 12.12±1.86 45.92±9.98 76.14±9.15治疗后 5.91±1.27 19.85±8.76 30.69±8.19
3 讨论
COPD发病后,多数患者会出现全身低度炎症反应、氧化应激、肺功能降低、蛋白质代谢障碍等病理性改变[7]。而并发呼吸衰竭患者,则有低氧血症、呼吸困难等症状。COPD合并呼吸衰竭发病机制复杂,可能与气道黏液分泌增加、黏膜水肿、支气管平滑肌痉挛等多种因素有关,临床治疗难度大[8-9]。
目前临床治疗COPD 合并呼吸衰竭均以纠正缺氧、减轻呼吸肌疲劳、改善二氧化碳储留为原则。Bi-PAP呼吸机是治疗首选方式,但由于该病病程较长,并发症多,需在BiPAP呼吸机使用基础上,增加有效的药物治疗[10]。临床可用于治疗COPD 合并呼吸衰竭的药物种类较多,但尚无特效药,多数常规药物起效缓慢,毒副作用大,不被患者广泛接受。本研究结果显示,观察组治疗后CRP、IL-6、TNF-α 水平均低于对照组,RI 值低于对照组,OI 值高于对照组。其中,IL-6是二级炎症反应介质的重要成分,可反映炎症反应的程度,其对于CRP的合成可起到一定作用,并能诱导B淋巴细胞产生抗体,加重免疫受损程度;TNF-α可激活炎症介质,发挥促炎作用,其在细胞因子调节网络中有启动作用,当患者肺部发生感染时,其可破坏溶酶体,持续损伤肺组织结构,研究表明噻托溴铵联合BiPAP 呼吸机可改善COPD 合并呼吸衰竭患者的炎症因子水平,提高其氧合功能。其原因是BiPAP 呼吸机治疗COPD 合并心力衰竭可克服气道阻力,减少气管插管、气管切开导致的多种并发症,但呼吸机相关肺炎、脱机困难等并发症发病率仍居高不下[11]。此外,在采用BiPAP 呼吸机治疗过程中,受患者机体因素影响,内源性呼气末,导致呼吸肌疲劳及通气功能障碍,可引发缺氧、二氧化碳储留等,易导致肺源性心脏病,具有一定致死率[12]。而本研究在BiPAP 基础上加用噻托溴铵,噻托溴铵是一种长效抗胆碱药物,其可通过舒张气道平滑肌,扩大气道横截面积,降低肺通气阻力,优化肺通气功能,因此可改善患者氧合功能,降低肺部炎症反应水平[13]。
综上所述,噻托溴铵联合BiPAP 呼吸机可改善COPD合并呼吸衰竭患者的炎症因子水平,提高其氧合功能。
