单倍体诱导创建二倍体技术在油菜遗传育种中的研究进展
2020-07-06万丽丽王转茸范志雄辛强洪登峰杨光圣孙玉宏谭庆
万丽丽 王转茸 范志雄 辛强 洪登峰 杨光圣 孙玉宏 谭庆
摘要:单倍体诱导创建二倍体的技术体系主要包括2种类型。(1)对植物中雄性或者雌性生殖器官进行培养获得具有单套染色体组的组织,经过天然或者加倍剂处理获得二倍体;(2)对CENH3基因进行修饰获得单倍体诱导系,利用单倍体诱导系与不同材料杂交获得后者的单倍体,进而加倍成二倍体。在油菜中应用最广泛的单倍体诱导创建二倍体植株的技术是小孢子培养方法,其过程受到3个因素的影响,分别为小孢子胚发生能力、小孢子天然加倍和加倍剂处理后的加倍效率、从胚再生成完整植株的能力。经过多年研究,在油菜中建立的小孢子诱导创建二倍体的技术为油菜遗传育种研究提供了重要的技术支持。小孢子和小孢子培养得到的胚均能用于创造突变体及遗传转化试验。通过遗传学方法定位了决定油菜小孢子胚发生、天然加倍以及胚状体直接成苗的数量性状基因座(QTLs),可在不同群体中验证候选基因。深入挖掘调控小孢子胚发生和再生成苗的分子机制,分析胚性细胞发育的转变、起始细胞的分化以及胚形态发生的基因调控网络,进而为理解油菜单倍体诱导以及二倍体发生的作用机制提供依据。随着植物单倍体诱导发生的分子机制被逐步揭示,在油菜中对与拟南芥染色体减数分裂相关的同源基因进行修饰能够获得单倍体诱导系,将其与待改良的父母本进行杂交可快速获得具有不同亲本背景的单倍体,经过加倍剂处理可快速获得纯系,单倍体诱导技术能够用于反向育种研究以及品种的遗传改良。
关键词:双单倍体;油菜;遗传育种;小孢子培养;遗传转化;单倍体诱导;数量性状基因座(QTLs);分子机制
中图分类号: S634.303.2 文献标志码: A 文章编号:1002-1302(2020)10-0038-08
收稿日期:2019-04-29
基金项目:中国博士后科学基金第65批面上资助项目(编号:2019M652726);武汉市农业科学院博士后项目。
作者简介:万丽丽(1982—),女,湖北武汉人,博士,农艺师,主要从事油菜分子设计育种研究。E-mail:wanlili13226@163.com。
单倍体是含有单套染色体组的细胞或植株,由单倍体经过染色体加倍后得到的二倍体被称为双单倍体(double haploid,DH)。单倍体或双单倍体的获得是单倍体育种的基础,通常可以通过不同的方法来诱导单倍体形成,如将植株离体的花药或者分离的小孢子进行培养,形成胚状体或者经过愈伤组织脱分化成植株,或将植物未受精的胚珠或者子房进行离体培养,使胚囊细胞发育成胚,继而分化成单倍体植株。在油菜中应用最为广泛的单倍体诱导创建二倍体的技术体系是通过分离油菜花蕾中的单倍体小孢子,并对其进行加倍处理、成胚培养和胚性转换成苗,最终获得双单倍体植株的过程。单倍体诱导小孢子胚发生途径主要受供体植物的基因型、生长环境、选择的小孢子发育阶段(如单核小孢子的胚发生能力最强)、样品预处理方法、胚发生培养基组分以及小孢子培养的温度和光照度的影响[1]。通过单倍体诱导所得到的双单倍体的优势是基因型纯合,通过其创建的群体能够直接用于育种以及基因定位研究[2]。单倍体小孢子由于具有细胞类型一致性、体积小等优点,适合基因突变和遗传转化研究。小孢子染色体加倍以及植株再生的试验体系等重要因素决定了双单倍体的创建能否成功。大量研究表明,单倍体以及双单倍体技术已成为植物尤其是芸薹属植物遗传学和基因组学研究的重要工具[3-8]。DH育种技术目前已经被用于超过250种作物的育种过程,为植物的遗传研究和品种选育提供了有利条件。近年来,研究者们对玉米单倍体诱导系的分子机制进行了大量研究,并在模式作物拟南芥中开发了着丝粒介导染色体消失的技术,通过修饰着丝粒相关蛋白质的重要基因,使得转基因亲本的染色体被选择性丢失,进而诱导出父本或者母本单倍体[9]。这些基因广泛存在于真核生物中,理论上在作物中应用着丝粒介导法能够产生单倍体后代。
1 小孢子诱导单倍体创建DH系的应用现状
1.1 小孢子诱导获得的双单倍体在油菜育种中的应用
通过双单倍体技术创建油菜DH系受到小孢子胚发生能力、小孢子对有丝分裂抑制剂(加倍剂)的敏感性和胚再生成苗能力等3个因素的影响。由于不同基因型材料受以上3个因素的影响且遗传模式存在显著差异,研究人员对不同基因型材料探索出不同的试验条件,以获得较高的加倍成苗率[10-12]。为进一步优化双单倍体技术,研究者们挖掘了在小孢子培养过程中表现再生能力强的株系作为育种研究的供体。Ferrie等在甘蓝型油菜中通过小孢子培养获得了胚再生能力强的品种Topas DH系用于育种[13]。在自花授粉或者常异花授粉作物中培育新品种需要10年时间,自交授粉6代也只能获得98%的纯合率;而通过创建DH系能将育种时间缩短至3~4年,且基因型纯合率为100%。在开放授粉作物中,DH植株可以作为亲本自交系用于杂交种制种。此外,构建DH系能够固定重要性状以及定位显性和隐性基因或在一个较小群体中进行选择研究。Dirks等利用DH系群体进行反向育种(reverse breeding,RB)[14],这种育种方法可以从杂交种中分离得到不同来源的亲本材料,但是这种方法并不能完全有效地应用到育种程序中,因为有利的基因重组伴随着不利的连锁累赘,且DH技术受到基因型和物种的限制[15]。Thomas等总结了12种作物中的200个DH商业种信息,其中甘蓝型油菜有49个栽培种,芥菜型油菜中有2个栽培种[16]。目前加拿大育种单位利用DH技术选育出了双低优质油菜品种。总之,DH技术在植物遗传研究和品种选育中的优势表现在以下几个方面:(1)显著缩短育种周期。传统育种须要连续自交多个世代才能选育出纯合度高达99%的自交系。(2)简化育种流程。通過DH技术的应用,减少了纯系选育所需要的时间、人力资源,降低了成本。(3)提高选育效率。通过结合分子标记辅助选择技术和加代繁育技术提高了选育的效率。(4)符合植物新品种保护中植物新品种测试(DUS测试)的品种要求。对通过优势组合构建的DH群体进行直接评价,能够获得符合品种独特性、一致性和稳定性测试要求的优势组合。
此外,研究人员采用小孢子成胚率高的油菜品种Topas和成胚率低的品种Westar构建了F2代群体和2个DH群体,分子标记分析结果显示,在DH群体中与Topas成胚率高的等位基因连锁的标记表现为偏分离,而在F2代群体中没有这种现象,这可能是由于在DH群体中,等位基因高度纯合化,导致隐性致死基因大量表达,进而出现较高的偏分离比例[47]。Cloutier等发现,定位在第1条连锁群(LG1)和第18条连锁群(LG18)上的标记在2个DH群体中与Topas等位基因偏分离,而在F2代群体中符合孟德尔分离比例,由此推测在LG1和LG18上的部分染色体区段与小孢子胚发生能力相关[48]。同样的现象也发生在采用大白菜Homei09(产胚力高)和萝卜Siloga S2(產胚能力低)构建的DH群体和F2代群体的RAPD标记分析试验中,在6个连锁群中,与Homei09等位基因连锁标记发生偏分离,而在2个连锁群中,与Siloga S2等位基因连锁的标记发生偏分离;对F2代群体进行分析发现,来自Homei 09的优良等位基因并没有总是表现出与较高胚发生频率相关[49]。有研究者采用花椰菜DH系(early big)和DH rapid cycling(TO1000DH3)构建DH群体并对其进行分析,发现了139个与产胚能力相关的标记,其中分布在C1、C2、C4、C5和C7染色体上的77个位点与产胚率低的性状相关;与产胚率高的性状相关的62个位点分布在C3、C6、C8染色体上[15,50]。研究人员认为,与小孢子胚发生相关的标记能够用于胚再生能力性状的遗传选择。实际上胚再生能力只是产胚能力的单一表现,而胚发生后秋水仙碱加倍以及直接再生成苗的过程也是双单倍体育种的关键,所以要排除胚再生但不能成苗的表型,因此在偏分离标记与MDE表型相关性分析试验中还需要考虑胚活力、加倍率和植株再生频率3个因素的作用[51]。
研究者认为,在DH群体中偏分离标记可能与减数分裂早期遗传因素控制的单核小孢子胚再生能力有关,如果在减数分裂过程中配子体发育受到抑制,那么在F2代群体和DH群体中会发生同样的偏分离现象;此外在100多个DH系的出胚能力评估试验中,由于小孢子发生与供体植株的生长状态以及花蕾发育时期密切相关,导致统计上出错的概率增加[52]。假设在DH群体中偏分离的标记位点与小孢子胚发生相关的基因是连锁的,那么从双亲而来的DH群体中优良等位基因组合的DH系与没有聚合优良等位基因的DH系比较,会表现出超高的小孢子胚发生频率。研究人员结合之前发现的在DH群体中偏分离标记所在的基因组区段,在不同品种间构建替换系,并验证了这些区段与小孢子胚发生率的相关性。通过繁殖纯合的品种间替换系使小孢子培养试验获得稳定、准确、可重复的数据。分离F2代群体虽然能够避免发生偏分离现象,但是F2代群体的高度杂合性使得表型考察结果不具有代表性,采用重组自交系能够保证后代基因型纯合,使小孢子胚发生能力的表型数据准确,此外通过关联分析群体能够在丰富的种质资源群体中评估小孢子出胚能力[53-54]。
1.5 小孢子诱导单倍体发生途径中关键基因的研究现状
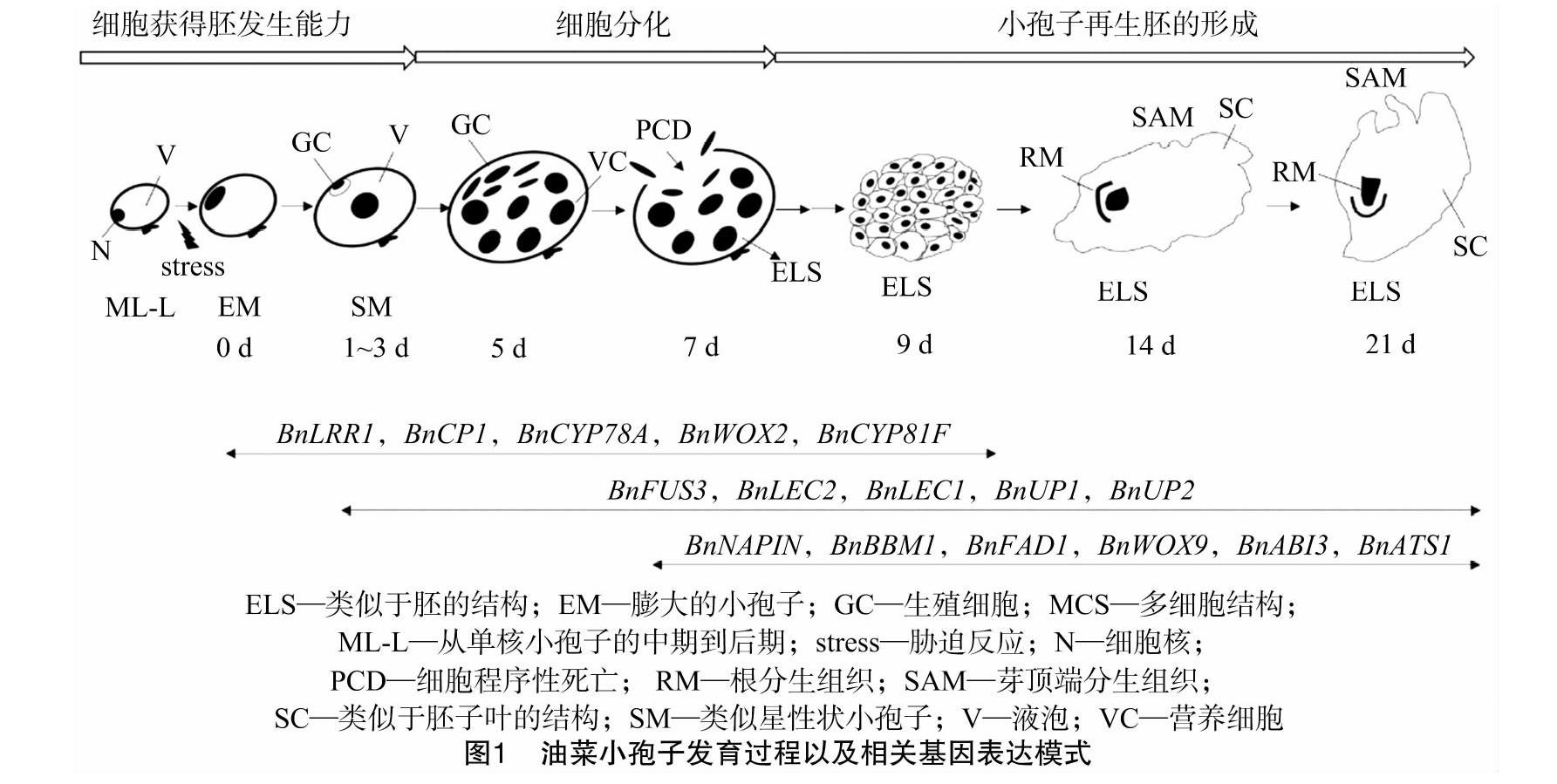
在单核小孢子向胚发育的过程中涉及很多基因的差异表达,这些基因参与的生物学功能主要分为3类,分别为胁迫诱导反应途径介导的胚性细胞发育转变、起始细胞的分化、胚形态发生途径。在甘蓝型油菜小孢子培养试验中,将单核小孢子置于42 ℃条件下胁迫处理2 d,促使与热激反应相关的基因表达;小孢子再生成胚的过程是单核小孢子终止了向正常花粉发育的程序,转向成胚发育途径,该过程涉及花粉发育中淀粉以及蔗糖等生物合成相关基因的下调表达[55]。对出胚率高和低的材料进行基因差异表达谱分析,挖掘出与胚发生频率相关的基因(图1),通过分析获得的16个决定小孢子胚发生的关键基因发现,BnFUS3、BnLEC2、BnLEC1、BnUP1、BnUP2基因在小孢子诱导、发育以及合子胚发育时期表达,BnNAPIN、BnBBM1、BnFAD1、BnWOX9、BnABI3、BnATS1基因在胚诱导和发育阶段以及根系中表达,BnLRR1、BnCP1、BnCYP78A、BnWOX2、BnCYP81F在发育的胚以及孢子体组织中表达,目前还没有找到从小孢子向配子体(花粉)发育转化的关键基因。调控小孢子发生的大多数基因都是转录因子,如LEC1、LEC2、FUS3、ABI3、BBM1、WOX2和WOX9等。Malik等取培养3 d或 7 d 后产胚率高的Topas-DH4079和产胚率低的Allons、Westar以及Garrison等材料的小孢子研究基因表达谱,发现BnLEC1、BnLEC2、BnBBM1和BnUP1诱导模式与产胚率紧密相关;异位表达分析结果表明,LEC1、LEC2和BBM1是体细胞组织中诱导胚发生的关键基因,LEC1、LEC2和FUS3是拟南芥合子胚和体细胞胚发生途径中的关键基因;从胚再生能力低的油菜品种Westar中再生获得4个DH系,这4个DH系具有比Westar材料更强的再生能力,且能够稳定遗传[56-57]。通过分析胚发生相关基因在DH2家系与Westar材料中的表达模式发现,BnLEC1在Westar材料的小孢子培养中比DH2材料培养的1、3 d明显推迟表达,BnLEC2、BnABI3、BnBBM1、BnUP1和BnWOX9的表达量在Westar品种小孢子培养的整个过程比DH2材料低。然而,花粉特异表达基因优先在胚再生能力低的Westar品种中表达,结合油菜种子cDNA芯片数据发现,在Westar和DH2材料热处理7 d的小孢子中存在117个差异表达基因,其中部分差异表达基因可能由小孢子供体植株杂合基因型决定,或者是体细胞变异导致了基因功能的多方面改变。
油菜小孢子雄性单性生殖过程包含3个阶段(1)胚性细胞发育途径;(2)细胞起始分化;(3)小孢子胚形成过程。
2 单倍体诱导技术的研究现状
2.1 单倍体诱导技术分子机制
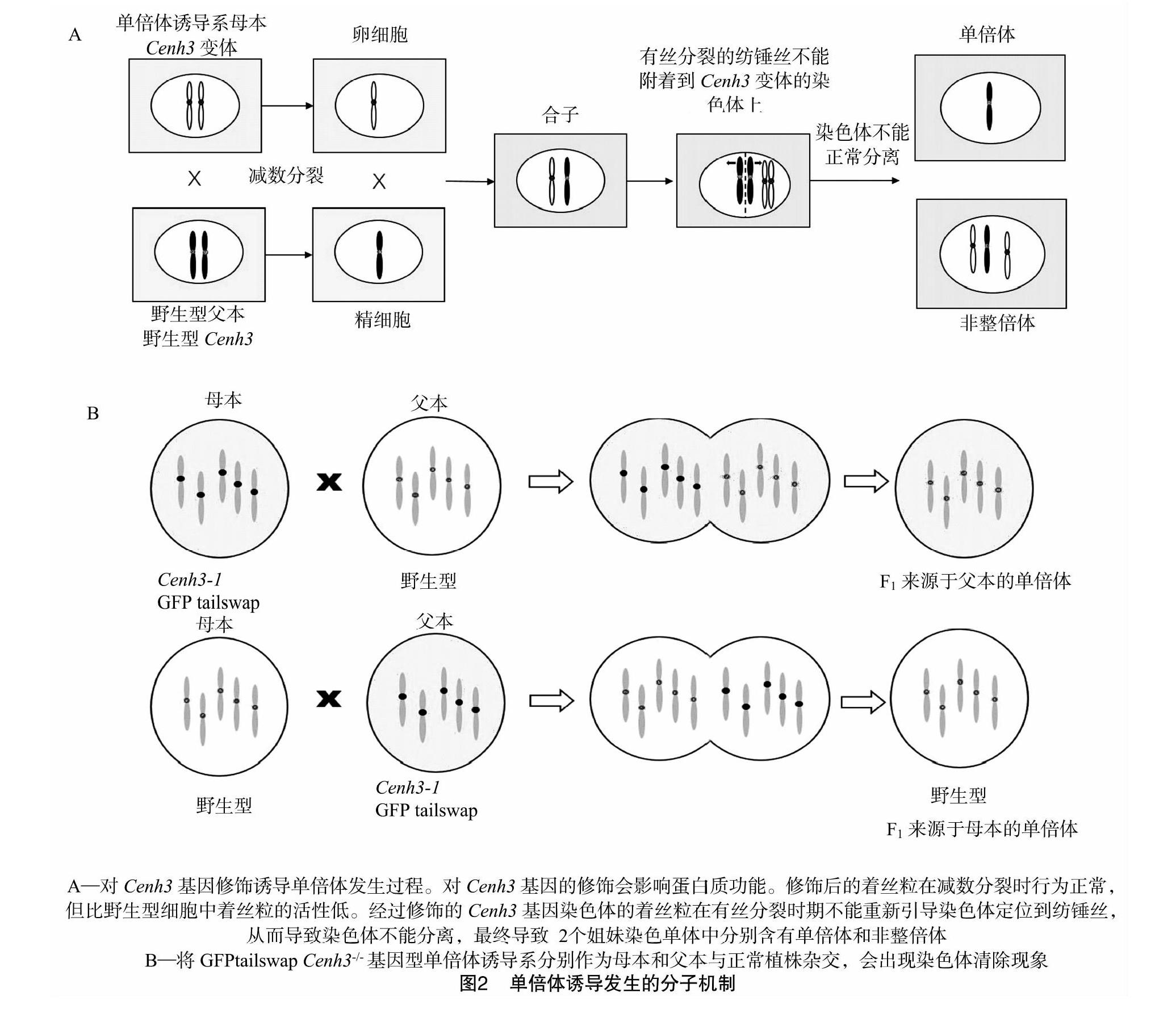
首先在玉米中发现天然单倍体,之后对玉米自交系Stock6进行改良获得一批优良的玉米单倍体诱导系,诱导率高达11%~16%[58]。经过研究其作用机理是双受精完成后,原基细胞分裂前诱导系染色体逐渐消失而形成单倍体(图2-A)[59-60]。Xu等发现,在授粉后7 d内大部分诱导系的染色体被排出细胞外,初步确定了染色体选择性消失的原因,另外在单倍体后代中发现了约44 Mb的父本染色体片段,证实了诱导系染色体发生渗入的过程[61]。为了开发出能够在多数物种中都适用的单倍体诱导方法,近年来在模式植物拟南芥中采用着丝粒介导染色体消失的方法诱导单倍体,Cenh3(由CENH3在H3位点突变形成)是组蛋白H3的一个突变体,其特异性定位于着丝粒上,Dwivedi等通过对CENH3蛋白进行改造,如将CENH3的N末端用组蛋白H3的N末端代替,或对CENH3蛋白进行点突变以及用其他类型的突变体进行替代等使得CENH3异位着陆形成双着丝粒染色体,导致染色体在分离的时候发生断裂[62]。拟南芥Cenh3突变体具有致死性,利用组蛋白H3的N末端尾部替换CENH3的N末端尾部,同时将绿色荧光蛋白(GFP)添加到N端终点,形成的GFPtailswap蛋白,定位于着丝粒上,该结构克服了Cenh3突变体的致死表型。利用转基因技术获得GFPtailswap Cenh3-/-基因型植株,该植株雄性不育但是能够产生少量花粉,作为父本与野生型进行杂交能够产生5%的母本单倍体,作为母本与野生型进行杂交能够产生25%~50%的父本单倍体(图2-B)。虽然GFPtailswap技术过程是含有转基因事件的,但所得的单倍体植株的基因都来源于非转基因的亲本,不含有转基因成分。CENH3在不同物种中存在进化的保守性,因而可以通过对油菜等近缘物种的CENH3基因进行修饰来获得单倍体诱导系。
2.2 单倍体诱导技术的应用前景
CENH3介导的单倍体诱导相比目前单倍体诱导方法的优势在于不须要经过组织培养的过程,能够避免组织培养中小孢子胚的发生过程受限于植株基因型。花粉培养产生来源于父本的单倍体,雌蕊培养产生来源于母本的单倍体。而单倍体诱导系统既可用于父本又可用于母本单倍体的诱导。单倍体诱导系能够用于细胞质雄性不育(cytoplasmic male sterility,CMS)系的背景改良,比如具有CMS遗传背景的单倍体诱导系作为母本与不同基因型的材料进行杂交所得到的单倍体后代具有母本的CMS遗传背景。虽然单倍体诱导系是转基因材料,但是杂交后所得到的单倍体是非转基因材料,能够直接应用于植物育种。此外,单倍体诱导技术能够用于反向育种的研究,2012年Wijnker等将拟南芥Landsberg和Columbia 2种生态型F1代杂交种中决定减数分裂交换的DMC1基因进行突变,使得杂交种重组抑制[63]。采用单倍体诱导系与杂交种进行杂交得到单倍体,加倍后获得双单倍體。对含有不同亲本染色体组合的双单倍体进行基因分型,选择不同亲本染色体的组合进行性状考察,可确定原始杂交种的类别。油菜与拟南芥属于近缘种,通过GFPtailswap技术创建油菜单倍体诱导系,能够重现优势杂交油菜品种的亲本基因型。
3 展望
从20世纪60年代单倍体诱导创建二倍体技术体系建立以来,研究者们不断致力于体系改进,以提高效率。随着在育种过程中的不断实践,该技术体系在遗传转化以及基因组研究等领域的应用不断拓展,与此同时,人们对其提出了更高的要求,建立适用性更广泛、效率更高的技术体系是目前研究的重点。
前人利用单倍体诱导创建二倍体的技术创建了不同的DH群体,并分别定位了小孢子胚再生途径的主效QTL,同时通过比较基因组学挖掘出大量在小孢子胚发生过程中的相关基因,将这些基因与QTL定位区间进行比较,可以快速获得油菜小孢子诱导胚发生的关键基因。由于甘蓝型油菜基因组复杂,数量性状控制基因的图位克隆进展缓慢,同源基因的拷贝数较多,阻碍了差异表达基因与定位区间的匹配。目前可以利用白菜、甘蓝和甘蓝型油菜的基因组比对,筛选出更为准确的候选基因。此外,基于华中农业大学建立的60K SNP芯片检测平台,利用与油菜重要性状关联的分子标记,加快重要农艺性状关键基因的克隆。如果利用分子设计育种方法将与小孢子胚发生途径相关的基因组区间与控制油菜产量以及含油量的位点关联,则可以在对小孢子胚发生、秋水仙碱诱导染色体加倍以及诱导小孢子直接成苗等3个关键步骤进行改良的同时,快速获得油菜栽培种或者育种材料。随着模式植物拟南芥单倍体诱导系统的创建和完善,在油菜中开发的着丝粒蛋白修饰介导的单倍体诱导系统可被用于不同细胞质来源亲本的改良以及反向育种研究。
参考文献:
[1]Ferrie A M R,Caswell K L. Isolated microspore culture techniques and recent progress for haploid and doubled haploid plant production[J]. Plant Cell Tissue and Organ Culture,2011,104(3):301-309.
[2]Szarejko I,Forster B P. Doubled haploidy and induced mutation[J]. Euphytica,2007,158(3):359-370.
[3]Custers J B M. Microspore culture in rapeseed (Brassica napus L.)[M]. Dordrecht:Springer Netherlands,2003.
[4]da Silva D J C.Protocol for broccoli microspore culture[M]. Dordrecht:Springer Netherlands,2003.
[5]Ferrie A. Microspore culture of Brassica species[M]. Dordrecht:Springer Netherlands,2003.
[6]Ferrie A M R,Keller W A. Optimization of methods for using polyethylene glycol as a non-permeating osmoticum for the induction of microspore embryogenesis in the Brassicaceae[J]. In Vitro Cellular & Developmental Biology Plant,2007,43(4):348-355.
[7]Friedt W,Zarhloul M K. Haploids in the improvement of Crucifers[M]. Berlin:Springer,2005.
[8]Hansen M. Protocol for microspore culture in Brassica[M]. Dordrecht:Springer Netherlands,2003.
[9]Ravi M,Chan S W L. Haploid plants produced by centromere-mediated genome elimination[J]. Nature,2010,464(7288):615-618.
[10]Barro F,Martín A. Response of different genotypes of Brassica carinata to microspore culture[J]. Plant Breeding,2008,118(1):79-81.
[11]Siebel J,Pauls K P. A comparison of anther and microspore culture as a breeding tool in Brassica napus[J]. Theoretical and Applied Genetics,1989,78(4):473-479.
[12]Takahata Y,Fukuoka H,Wakui K. Utilization of microspore-derived embryos[M]//Biotechnology in Agriculture and Forestry,2005.
[13]Ferrie A M R,Palmer C E,Keller W A. Haploid embryogenesis[M]//Thorpe T A. In vitro embryogenesis in plants. Dordrecht:Kluwer Academic Publishers,1995:309-344.
[14]Dirks R,van Dun K,de Snoo C B,et al. Reverse breeding:a novel breeding approach based on engineered meiosis[J]. Plant Biotechnology Journal,2009,7(9):837-845.
[15]Pink D,Bailey L,McClement S,et al. Double haploids,markers and QTL analysis in vegetable brassicas[J]. Euphytica,2008,164(2):509-514.
[16]Thomas W T B,Forster B P,Gertsson B. Doubled haploids in breeding[M]. Dordrecht:Springer Netherlands,2003.
[17]Maluszynski M. Officially released mutant varieties — The FAO/IAEA database[J]. Plant Cell Tissue and Organ Culture,2001,65(3):175-177.
[18]Ferrie A M R,Taylor D C,Mackenzie S L,et al. Microspore mutagenesis of Brassica species for fatty acid modifications:a preliminary evaluation[J]. Plant Breeding,2008,127(5):501-506.
[19]Barro F,Fernandezescobar J,Mdela V,et al. Modification of glucosinolate and erucic acid contents in doubled haploid lines of Brassica carinata by UV treatment of isolated microspores[J]. Euphytica,2003,129:1-6.
[20]Beaith M E,Fletcher R S,Kott L S. Reduction of saturated fats by mutagenesis and heat selection in Brassica napus L.[J]. Euphytica,2005,144:1-9.
[21]Sonntag K,Rudloff E. Microspore mutagenesis in transgenic oilseed rape for the modification of fatty-acid composition[J]. Acta Universitatis Latviensis Biology,2004,676:227-230.
[22]Barro F,Fernandez-Escobar J,de la Vega M,et al. Doubled haploid lines of Brassica carinata with modified erucic acid content through mutagenesis by EMS treatment of isolated microspores[J]. Plant Breeding,2008,120(3):262-264.
[23]McClinchey S L,Kott L S. Production of mutants with high cold tolerance in spring canola (Brassica napus)[J]. Euphytica,2008,162(1):51-67.
[24]Liu S,Wang H,Zhang J,et al. In vitro mutation and selection of doubled-haploid Brassica napus lines with improved resistance to Sclerotinia sclerotiorum[J]. Plant Cell Reports,2005,24(3):133-144.
[25]Beversdorf W D,Kott L S. An in vitro mutagenesis/selection system for Brassica napus[J]. Iowa State Journal of Research,1987(4):435-443.
[26]Xu L,Najeeb U,Naeem M S,et al. In vitro mutagenesis and genetic improvement[M]. New York:Springer,2012.
[27]Yun H E,Wan G,Chen S,et al. Effects of mutagenic treatments of isolated microspores and microspore-derived embryos on embryogenesis and plant regeneration in oilseed rape[C]//International Rapeseed Congress,2007.
[28]Dormann M,Oelck M,Wang H M. Transformed embryogenic microspores for the generation of fertile homozygous plants:USA,6316694[P]. 2001-11-13.
[29]Fukuoka H,Ogawa T,Matsuoka M,et al. Direct gene delivery into isolated microspores of rapeseed (Brassica napus L.) and the production of fertile transgenic plants[J]. Plant Cell Reports,1998,17:323-328.
[30]Guerche P,Charbonnier M,Jouanin L,et al. Direct gene transfer by electroporation in Brassica napus[J]. Plant Science,1987,52(1/2):111-116.
[31]Jardinaud M F,Souvré A,Alibert G. Transient GUS gene expression in Brassica napus electroporated microspores[J]. Plant Science,1993,93:177-184.
[32]Jones-Villeneuve E,Huang B,Prudhomme I,et al. Assessment of microinjection for introducing DNA into uninuclear microspores of rapeseed[J]. Plant Cell Tissue & Organ Culture,1995,40(4):97-100.
[33]Nehlin L,Mllers C,Bergman P,et al. Transient β-gus and gfp gene expression and viability analysis of microprojectile bombarded microspores of Brassica napus L.[J]. Journal of Plant Physiology,2000,156(2):175-183.
[34]Pechan P M. Successful cocultivation of Brassica napus microspores and proembryos with Agrobacterium[J]. Plant Cell Reports,1989,8(7):387.
[35]Abdollahi M R,Moieni A,Salmanian A H,et al. Secondary embryogenesis and transient expression of the β-glucuronidase gene in hypocotyls of rapeseed microspore-derived embryos[J]. Biologia Plantarum,2009,53(3):573-577.
[36]Chugh A,Amundsen E,Eudes F. Translocation of cell-penetrating peptides and delivery of their cargoes in triticale microspores[J]. Plant Cell Reports,2009,28(5):801-810.
[37]Chen J L,Beversdorf W D. A combined use of microprojectile bombardment and DNA imbibition enhances transformation frequency of canola (Brassica napus L.)[J]. Theoretical & Applied Genetics,1994,88(2):187.
[38]Huang B. Genetic manipulation of microspores and microspore-derived embryos[J]. Vitro Plant,1992,28:53-58.
[39]Neuhaus G,Spangenberg G,Scheid O M,et al. Transgenic rapeseed plants obtained by the microinjection of DNA into microspore-derived embryoids[J]. Theoretical & Applied Genetics,1987,75(1):30-36.
[40]Swanson E B,Erickson L R. Haploid transformation in Brassica napus using an octopine-producing strain of Agrobacterium tumefaciens[J]. Theoretical & Applied Genetics,1989,78(6):831-835.
[41]Abdollahi M R,Moieni A,Mousavi A,et al. High frequency production of rapeseed transgenic plants via combination of microprojectile bombardment and secondary embryogenesis of microspore-derived embryos[J]. Molecular Biology Reports,2011,38(2):711-719.
[42]Cegielska-Taras T,Pniewski T,Szaa L. Transformation of microspore-derived embryos of winter oilseed rape (Brassica napus L.) by using Agrobacterium tumefaciens[J]. Journal of Applied Genetics,2008,49(4):343-347.
[43]hman I M,Kazachkova N I,Kamnert I M,et al. Characterisation of transgenic oilseed rape expressing pea lectin in anthers for improved resistance to pollen beetle[J]. Euphytica,2006,151(3):321-330.
[44]Reiss E,Schubert J,Scholze P,et al. The barley thaumatin-like protein Hv-TLP8 enhances resistance of oilseed rape plants to Plasmodiophora brassicae[J]. Plant Breeding,2010,128(2):210-212.
[45]Zhang F L,Takahata Y. Inheritance of microspore embryogenic ability in Brassica crops[J]. Theoretical & Applied Genetics,2001,103(2/3):254-258.
[46]Zhang F,Aoki S,Takahata Y. RAPD markers linked to microspore embryogenic ability in Brassica crops[J]. Euphytica,2003,131(2):207-213.
[47]Wan Y,Rocheford T R,Widholm J M. RFLP analysis to identify putative chromosomal regions involved in the anther culture response and callus formation of maize[J]. Theoretical & Applied Genetics,1992,85(2/3):360-365.
[48]Cloutier S,Cappadocia M,Landry B S. Study of microspore-culture responsiveness in oilseed rape (Brassica napus L.) by comparative mapping of a F2 population and two microspore-derived populations[J]. Theoretical & Applied Genetics,1995,91(6/7):841-847.
[49]Ajisaka H,Kuginuki Y,Shiratori M,et al. Mapping loci affecting the cultural efficiency of microspore culture of Brassica rapa L. syn. campestris L. using DNA polymorphism[J]. Breed Sci,1999,49(3):187-192.
[50]Iniguez-Luy F L,Lukens L,Farnham M W,et al. Development of public immortal mapping populations,molecular markers and linkage maps for rapid cycling Brassica rapa and B. oleracea[J]. Theoretical & Applied Genetics,2009,120(1):31-43.
[51]Ujjalkumar N,Mohammedcm I,Christian M. Early,non-destructive selection of microspore-derived embryo genotypes in oilseed rape (Brassica napus L.) by molecular markers and oil quality analysis[J]. Molecular Breeding,2007,19(3):285-289.
[52]Kitashiba H,Taguchi K,Kaneko I,et al. Identification of loci associated with embryo yield in microspore culture of Brassica rapa by segregation distortion analysis[J]. Plant Cell Reports,2016,35(10):2197-2204.
[53]Ecke W,Clemens R,Honsdorf N,et al. Extent and structure of linkage disequilibrium in canola quality winter rapeseed (Brassica napus L.)[J]. Theoretical & Applied Genetics,2010,120(5):921-931.
[54]Hasan M,Friedt W,Ponskühnemann J,et al. Association of gene-linked SSR markers to seed glucosinolate content in oilseed rape (Brassica napus ssp. napus)[J]. Theoretical & Applied Genetics,2008,116(8):1035-1049.
[55]Maraschin S F,de Priester W,Spaink H P,et al. Androgenic switch:an example of plant embryogenesis from the male gametophyte perspective[J]. Journal of Experimental Botany,2005,56(417):1711-1726.
[56]Malik M R,Wang F,Dirpaul J M,et al. Transcript profiling and identification of molecular markers for early microspore embryogenesis in Brassica napus[J]. Plant Physiology,2007,144(1):134-154.
[57]Malik M R,Wang F,Dirpaul J M,et al. Isolation of an embryogenic line from non-embryogenic Brassica napus cv. Westar through microspore embryogenesis[J]. Journal of Experimental Botany,2008,59(10):2857-2873.
[58]Rotarenco V,Dicu G,State D,et al. New inducers of maternal haploids in maize[J]. Maize Genet Coop Newslett,2010,84:1-7.
[59]Britt A B,Kuppu S. Cenh3:an emerging player in haploid induction technology[J]. Front. Plant Sci,2016,7,357.
[60]Watts A,Kumar V,Bhat S R. Centromeric histone H3 protein:from basic study to plant breeding applications[J]. Plant Biochem,Biotechnol,2016,25:339-348.
[61]Xu X W,Li L,Dong X,et al. Gametophytic and zygotic selection leads to segregation distortion through in vivo induction of a maternal haploid in maize[J]. J Exp Bot,2013,64(4):1083-1096.
[62]Dwivedi S L,Britt A B,Tripathi L,et al. Haploids:constraints and opportunities in plant breeding[J]. Biotechnol Adv,2015,33(6):812-829.
[63]Wijnker E,van Dun K,de Snoo C B,et al. Reverse breeding in Arabidopsis thaliana generates homozygous parental lines from a heterozygous plant[J]. Nature Genetics,2012,44(4):467-470.
