Caspase3在游泳运动促进骨关节炎康复中的影响
2020-07-06林晓敏潘伟滨吴玉琼
林晓敏,潘伟滨,吴玉琼
(漳州卫生职业学院,福建漳州363000)
关节炎(osteoarthritis,OA)是临床常见的一种关节炎性疾病,好发于膝关节,其主要病理改变为软骨破坏和骨质增生,关节疼痛和活动功能受限是患者最常见的临床表现,严重影响患者的生活质量[1].目前,OA 的准确发病原因和发病机制尚不清楚.但是,年龄因素、遗传因素和机械力被认为是OA 发病的主要危险因素[2].研究表明,关节软骨细胞凋亡是OA的重要病理反应之一,两者之间有密切的关系[3].Caspase3作为半胱氨酸蛋白酶家族的重要成员之一,是凋亡过程的重要参与者和执行者[4].研究显示,Caspase3 在骨关节炎软骨中高表达,且其表达量与骨关节炎严重程度呈正相关性[5].游泳运动是常用的康复治疗方法,其优势包括:主动运动生物调节准确性较高;水中运动进行康复治疗.临床常用于关节炎等疾病的康复治疗,具有良好疗效.本研究旨在探讨游泳运动对骨关节炎软骨细胞凋亡基因Caspase3表达的影响,明确游泳运动的作用机制.
1 材料
1.1 实验动物及分组
购入36 只成年SPF 级雄性SD 大鼠.采用随机数表法将上述36 只大鼠随机分为每组12 只的正常组、模型组和游泳运动组.大鼠在22℃的室温下正常喂养1周以适应实验室环境。
1.2 实验试剂及仪器
一抗:anti-Caspase3 抗体(Abcam,美国)、anti-β-actin 抗体;HE 染色试剂盒(索莱宝,北京);光学显微镜(Leica DMI 4000B/DFC425C,德国).
2 方法
2.1 建立大鼠骨关节炎模型
大鼠麻醉前需禁食12 h.配比浓度为7%的水合氯醛,按照5 mL/kg 的注射量通过腹腔注射入大鼠体内. 大鼠麻醉后,将其仰卧固定于手术台,暴露膝关节,脱毛,消毒,一次向膝关节内注入2%木瓜蛋白酶0.1 mL和0.05 mmol/L的L-半胱氨酸0.05 mL,4天后重复上述操作,再次注入2%木瓜蛋白酶0.1 mL和0.05 mmol/L的L-半胱氨酸0.05 mL即建立大鼠关节炎模型.
2.2 各组处理
正常组正常饲养,不做任何处理;模型组采用上述方法制备关节炎模型,不给于任何干预;游泳运动组采用上述方法制备关节炎模型,造模后3 d 给予游泳运动治疗,具体方法为:将大鼠放于深36 cm,温度32~36℃的水池里,使其以3 cm/s的速度进行游泳,每次持续15 min,每天进行1次,连续干预4周.
2.3 取材
麻醉具体方法同模型建立.待大鼠麻醉后,选择每组6只大鼠进行多聚甲醛灌注固定,取膝关节软骨组织,沉降静置于4%多聚甲醛中,在4℃冰箱中固定48 h,取出后浸泡于EDTA脱钙液中进行脱钙,每3天换液1次,直至组织完全脱钙.将此批标本进行石蜡制作及组织切片,用于HE 染色.每组剩余的6只大鼠采用直接快速取其膝关节软骨组织,放置于EP管中,用于Western blot检测.
2.4 检测方法
2.4.1 HE染色
将5 μm 厚的石蜡组织切片常规脱蜡、入水,采用HE 染色试剂盒,按照说明书进行操作,观察大鼠膝关节的组织形态.
2.4.2 Western blot检测
将-20℃保存备用的软骨组织加入裂解液,冰浴60 min.14 000 g离心10 min,采用BCA法计算蛋白浓度.蛋白变性后,使用SDS-PAGE 凝胶电泳分离样品蛋白.转膜后封闭.封闭液封闭1.5 h,加入anti-Caspase3(1:2 000),然后显影.将膜置于化学发光试剂中反应1 min,在避光条件下显影,凝胶扫描成像系统进行分析.
2.4.3 TUNEL凋亡检测
将5 μm 厚的石蜡组织切片常规脱蜡、入水,采用TUNEL 凋亡检测试剂盒,按照说明书进行操作,以检测大鼠膝关节软骨细胞凋亡情况.
2.5 统计学方法
本研究采用SPSS 22.0 软件进行统计分析,计数资料以均数±标准差表示,根据正态分布及方差齐性的情况选择t检验或非参数检验.
3 结果
3.1 HE染色观察组织形态
如图1 所示,正常组膝关节形态正常,结构完整,软骨细胞正常,排列紧密有序,可见完整潮线且距离关节表面较远;模型组膝关节软骨遭到破坏,形态异常,结构不完整,部分缺失,软骨细胞数量减少,排列紊乱,潮线不完整且距离关节表面较近;游泳运动组膝关节软骨虽然可见部分损伤,但形态、结构较模型组改善,软骨细胞数量较多且排列较有序,潮线较完整且距离关节表面较远.
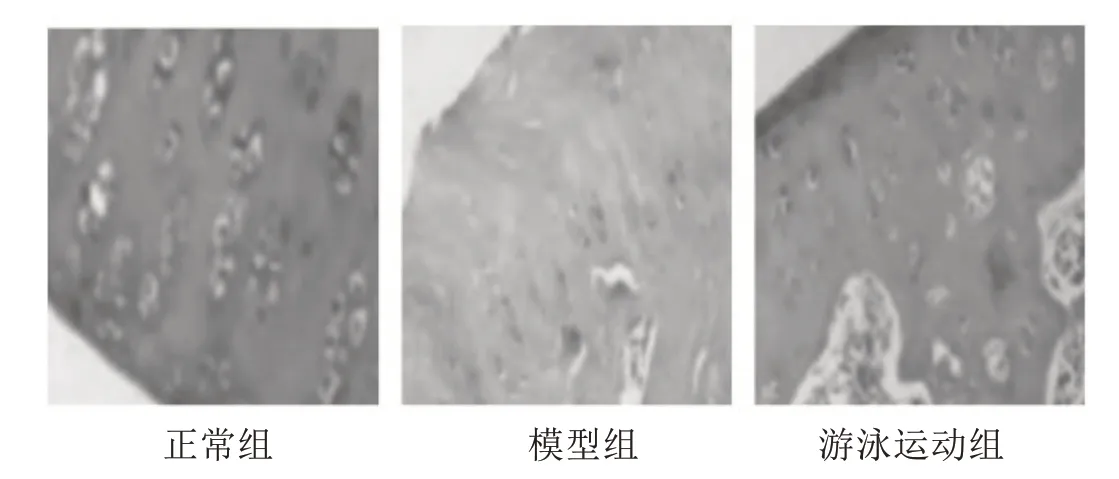
图1 HE染色观察组织形态(X200)Fig.1 The observation of tissue morphology by HE staining(X200)
3.2 Western blot检测Caspase3蛋白表达
如图2 所示,正常组Caspase3 蛋白表达量较少,模型组和游泳运动组Caspase3 蛋白表达量较多;对Caspase3 蛋白相对表达量进行统计分析,结果如图3所示,模型组和游泳运动组与正常组比较,Caspase3蛋白相对表达量显著增多(P<0.05);与模型组比较,游泳运动组Caspase3蛋白相对表达量显著减少(P<0.05).

图2 WB检测Caspase3蛋白表达Fig.2 The protein expression of Caspase3 by WB
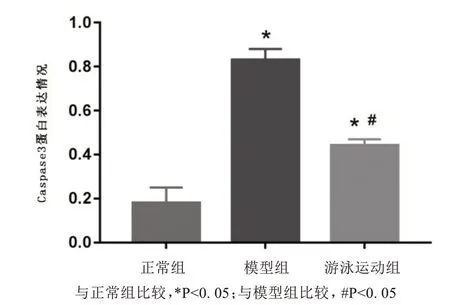
图3 Caspase3蛋白表达情况Fig.3 The protein expression of Caspase3
3.3 TUNEL凋亡检测
如图4 所示,模型组和游泳运动族的凋亡率与正常组相比较显示较高(P<0.05);游泳运动组与模型组比较,其凋亡率显著减少(P<0.05).
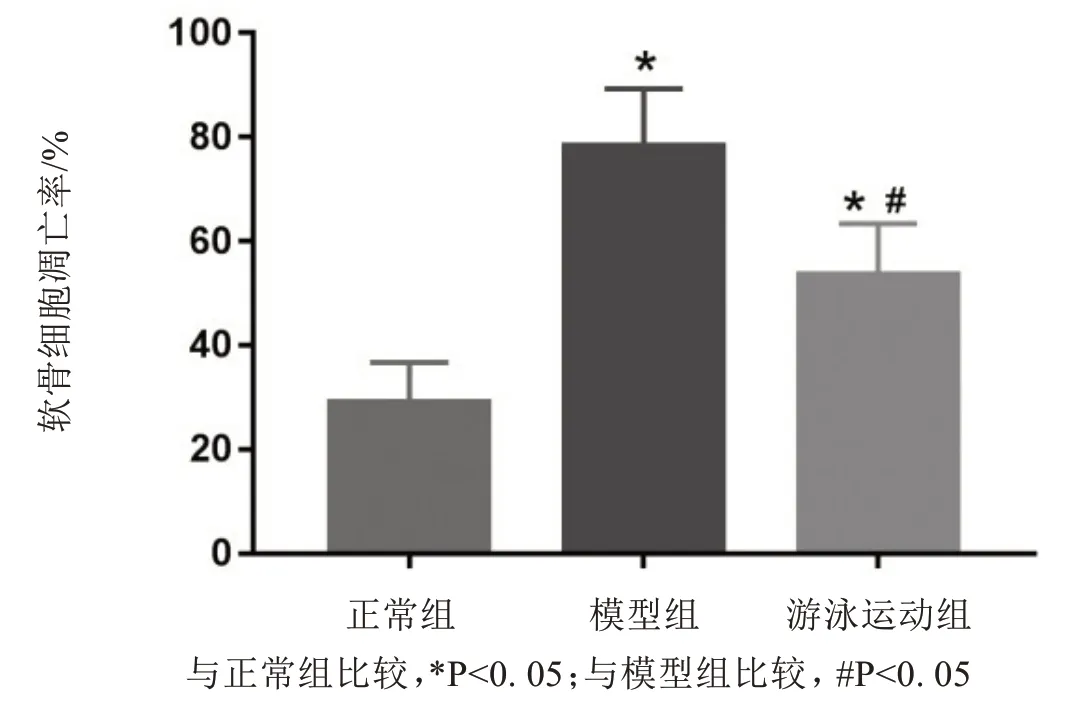
图4 软骨细胞凋亡率Fig.4 The Apoptotic rate of chondrocyte
4 讨论
4.1 Caspase3与软骨细胞凋亡的关系
OA作为临床常见的关节退行性改变疾病,关节软骨降解和软骨细胞凋亡是其主要病理反应.研究表明,与正常软骨细胞相比较,关节炎患者软骨细胞的凋亡损伤程度显著增高,提示软骨细胞凋亡与OA 的关系非常密切:软骨的退化,是骨关节炎的显著标志之一[6].而关节软骨由于缺少神经及血管,损伤后往往很难再生,为骨关节炎的恢复制造了极大的阻碍.因此,研究探讨关节软骨细胞凋亡的机制具有十分重要的意义.有研究进一步证实,实验性兔关节炎模型与人关节炎原位杂交结果相一致,同时TUNEL 细胞凋亡检测显示在关节炎模型中的软骨细胞凋亡程度显著高于正常软骨细胞,进一步说明软骨细胞凋亡是OA 的重要病理机制之一[7].Caspase3 作为已知的死亡受体信号传导重要组成部分之一,其介导的细胞凋亡与关节炎关系密切[8].而应用Caspase3抑制剂则可有效降低关节炎软骨细胞Caspase3的表达,同时抑制软骨细胞凋亡,这都说明Caspase3与关节炎病变和软骨细胞凋亡密切相关[9].Caspase3作为半胱氨酸蛋白酶的执行蛋白,对细胞凋亡具有重要作用.目前已经证实,在骨关节炎患者中和由手术造模引起的啮齿类动物骨关节炎中,均可发现Caspase3高表达和软骨细胞凋亡的发生[10].国外研究也表明:软骨细胞凋亡率与Caspase3 的表达水平呈正相关,并且二者同时升高也与骨关节炎的发病率呈正相关[11].因此,Caspase3可作为抑制关节炎软骨细胞凋亡的重要靶点之一.
4.2 游泳运动促进骨关节炎的康复
游泳运动的优势在于:1)水的浮力减轻运动时体重对关节造成的负荷;2)水对关节运动时的阻力起到强化训练的作用;3)合适的水温可起到缓解肌肉痉挛、镇痛和改善关节血液循环的作用.同时,研究显示,运动作用于机体代谢及结构形态变化的作用具有较高的特异性,只有一定变化范围的负荷类型、强度、频率及持续时间的运动才对维持关节软骨的正常发挥积极作用[12].游泳作为一种典型的肢体周期性循环运动,临床具有较好的康复治疗作用.著名的Halliwick 理念是一种以游泳为核心手段的康复方法,临床已广泛运用于OA、类风湿性关节炎(Rheumatoid Arthritis,RA)、下腰痛等骨性疾病中,且取得显著效果[13].游泳运动时,OA 关节主动运动过程中复杂的生物阻力与不适可被机体能通过精细的本体感觉而感知,从而使机体及时做出调整运动,使机体的功能和病理变化与游泳状态相适合[14].
4.3 游泳运动可抑制凋亡基因Caspase3的表达
本研究结果中,HE 染色显示在形态方面游泳运动组大鼠结构较完整,软骨细胞数量多于模型组;免疫组化及Western blot等实验从形态学及蛋白分子方面观察凋亡基因Caspase3 均发现其在模型组大鼠中表达明显增加;TUNEL凋亡检测也同样证实模型组细胞凋亡率较游泳运动组高.以上实验结果说明游泳运动可显著抑制骨关节炎细胞凋亡基因Caspase3 的表达,从而抑制骨关节炎软骨细胞凋亡.这可能是游泳运动对骨关节炎具有良好康复治疗作用的原因之一.
5 结论
本实验通过观察正常组、模型组和游泳运动组3组的凋亡基因Caspase3的蛋白表达,并通过HE 染色观察3组的软骨细胞形态及TUNEL凋亡检测各组细胞凋亡率,初步探究游泳运动促进骨关节炎康复的可能机制.但其具体的上下游因子如何作用尚不明晰,这可以是未来进一步研究的方向和思路.
