扶肾方调节各种细胞因子干预腹膜间皮细胞EMT的实验研究
2020-07-06杨波王孟孟李洁乔延恒杨洪涛
杨波,王孟孟,李洁,乔延恒,杨洪涛△
腹膜透析(PD)是终末期肾脏病(ESRD)患者的重要肾脏替代疗法。目前,全球PD患者约占透析人群的11%,并正以每年8%的速度增长[1]。长期PD易发生腹膜纤维化,导致超滤衰竭,最终迫使患者退出治疗[2]。研究表明,裸露的腹膜间皮细胞从上皮细胞表型向间充质细胞表型转化即上皮间质转化(EMT)是腹膜纤维化的起始和可逆环节[3]。因此,明确腹膜间皮细胞EMT具体机制,对于防治腹膜纤维化具有重要意义。中药复方因其多靶点调节的特点,在防治腹膜纤维化方面具有较好前景[4]。本课题组前期研究发现,扶肾方(院内制剂:津药制字Z20130941)具有防治腹膜纤维化,延缓超滤衰竭的作用,但具体机制尚不明确[5]。本研究通过体外实验探讨扶肾方含药血清对转化生长因子-β1(TGF-β1)干预腹膜间皮细胞EMT过程中E-钙黏蛋白(E-cadherin)、紧密连接蛋白-1(ZO-1)、转化生长因子-β 受体Ⅰ(TGF-βRⅠ)、TGF-βRⅡ、泛素连接酶Smad泛素化相关因子2(Smurf2)的影响及抑制腹膜间皮细胞EMT 的机制,为其应用于PD 相关腹膜纤维化防治提供参考。
1 材料与方法
1.1 主要仪器与试剂 清洁级SD雄性大鼠26只,6周龄,体质量150~180 g,购于北京华阜康生物科技股份有限公司,实验动物许可证:SCXK(京)2016-0006。胰蛋白酶、DMEM 完全培养基、TGF-β1(母液浓度50 mg/L)、蛋白酶体抑制剂MG132(母液浓度10 mmol/L)、一抗β-actin(1∶500)、Smurf2(1∶200)购自北京中杉金桥生物有限公司;75%乙醇,10%水合氯醛购自成都市科龙化工试剂厂;手术器械(剪刀和镊子),无菌注射器(20 mL 和1 mL),50 mL 无菌离心管购自北京市瑞康达医疗器械有限公司。
1.2 方法
1.2.1 腹膜间皮细胞分离及原代培养 大鼠20 只(每次5只,共4 次),行肌内注射10%水合氯醛约1 mL,待麻醉后向大鼠腹腔内注射20~30 mL 0.25%胰蛋白酶/0.02% EDTA 消化液。30 min 后断颈处死大鼠,消化l h,75%乙醇全身浸泡消毒5 min。将大鼠仰面放置于超净工作台上,沿腹中线依次剪开腹壁皮肤及肌肉,吸出腹腔内液体,移入50 mL 离心管中。1 500 r/min离心15 min,弃上清,加入含10%胎牛血清(fetal bovine serum,FBS)的DMEM/F12 培养液,轻轻用吸管吹打使之成为细胞混悬液,种植于细胞培养瓶中。放入37 ℃、5%CO2的细胞培养箱中培养。约每3 d 更换1 次完全培养基。待细胞生长至培养瓶底60%~70%时,进行传代培养,第2代用于后续实验。
1.2.2 腹膜间皮细胞EMT 模型建立及鉴定 基于前期实验和参考文献[6],采用40 μg/L TGF-β1 因子刺激培养的2 代大鼠腹膜间皮细胞24 h建立EMT模型。模型鉴定:倒置显微镜下观察细胞数量、生长状态及形态变化;上皮E-cadherin、ZO-1可作为腹膜间皮细胞EMT的特异生物标志物。
1.2.3 扶肾方含药血清的制备 采用大鼠灌胃法制备含药血清,6只大鼠按随机数字表法分为空白对照组和扶肾方组,每组3只,扶肾方组每只大鼠灌胃2 mL(扶肾方含量为162 g/L)连续7 d,最后一次灌胃后2 h,麻醉后经股动脉取血10 mL,分离含药血清,空白对照组大鼠灌胃等剂量生理盐水,其他操作同扶肾方组。扶肾方以中药饮片为原料,经过提取、分离、浓缩、干燥、制粒而成。按照药物人和大鼠体表面积计算方法,折算系数为0.018。扶肾方颗粒成人服用剂量为每次18 g,按照折算系数计算出大鼠等效剂量为0.324 g。分离得到的血清经0.45 μm微孔滤膜过滤除菌,56 ℃30 min灭活补体,制成含药血清,-20 ℃冰箱保存备用。
1.2.4 细胞实验分组及干预 细胞实验分为5组:空白对照组(C组,正常培养基培养腹膜间皮细胞24 h);最佳含药血清组(B 组,正常培养基加大鼠含药血清培养腹膜间皮细胞24 h);模型组(T组,40 μg/L TGF-β1因子刺激腹膜间皮细胞24 h);模型+含药血清组(T+B 组,在模型组处理上加上最佳含药血清干预24 h);模型+MG132组(T+M组,在模型组处理上加 MG132 干预 24 h)。将 40 μg/L TGF-β1 干预腹膜间皮细胞,作用时间选择 6、12、24 及 48 h,通过MTT 检测细胞的活力,最终确定24 h为干预时间。
1.2.5 实时荧光定量 PCR(qPCR)检测E-cadherin、ZO-1、TGF-βRⅠ,TGF-βRⅡ的mRNA 水平 按试剂盒步骤提取每组细胞总RNA,测定提取RNA纯度,逆转录反应合成cDNA,再进行qPCR,引物序列见表1。PCR 反应体系:2×SYBR Premix Ex Taq 12.5 μL,上、下游引物(10 μmol/L)各0.5 μL,模板2 μL,加ddH2O至总体系25 μL。扩增条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,30个循环。将各样品cDNA稀释10倍后取2 μL 作模板,分别用目的基因引物和内参基因(GAPDH)引物进行扩增,重复检测孔道数为3,在60~95 ℃进行熔解曲线分析。采取2-ΔΔCt进行数据的相对定量分析。

Tab.1 Primer sequences and amplified fragment length表1 引物序列及扩增片段长度
1.2.6 蛋白印迹法检测Smurf2 蛋白的表达 将培养的各组细胞弃上清,用无菌PBS清洗3次后,加入细胞裂解液冰上裂解30 min,低温高速离心机4 ℃、12 000 r/min 离心15 min,取其上清液,BCA 法测定蛋白浓度。以30 μg 蛋白质溶液为总上样量,取适量体积5×SDS(十二烷基苯磺酸钠)上样缓冲液充分混匀,100 ℃变性10 min,经凝胶电泳分离后,将蛋白转移到PVDF 膜上,脱脂奶粉室温封闭2 h,4 ℃摇床孵育一抗β-actin(1∶500)、Smurf2(1∶200)过夜。缓冲液洗膜3次,每次10 min,室温下孵育带有HRP标记羊抗鼠IgG(1∶20 000)二抗1.5 h,缓冲液洗膜3次,每次10 min。使用化学发光成像系统采集图像,Image J v2.1.4.7软件进行分析统计,计算各组蛋白的相对表达量。
1.3 统计学方法 采用SPSS 21.0软件进行统计学分析。符合正态分布的计量资料用均数±标准差()表示,多组比较采用单因素方差分析,以Levene 法进行方差齐性检验,若方差齐,采用LSD-t法,若方差不齐,采用Games-Howell 法。P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态的观察 原代培养的细胞在第1天可见呈分散的小圆形细胞,24 h 后大部分细胞开始贴壁生长,形态仍为圆形,细胞数量较多。第3天细胞的形态趋于一致,数量较第1 天少;第5 天细胞形态多种多样,有圆形、椭圆形、梭形、多角形等,边缘不齐。第7天细胞经过充分融合,细胞呈现多边形,形态较一致,部分细胞间连接较为紧密。见图1。
2.2 各组腹膜间皮细胞E-cadherin、ZO-1mRNA比较 与 C 组比较,T 组E-cadherin、ZO-1mRNA 表达均下调(P<0.05);与 T 组比较,B 组和T+B 组E-cadherin、ZO-1mRNA 表 达 均 上 调 ,T+M 组E-cadherin、ZO-1mRNA表达均下调(P<0.05);与B组比较,T+B 组和 T+M 组E-cadherinmRNA 表达下调,T+M 组ZO-1mRNA 表达下调(P<0.05);与T+B 组比较,T+M 组E-cadherin、ZO-1mRNA 表达均下调(P<0.05),见表2。
Tab.2 Transcription levels of E-cadherin and ZO-1 mRNA in peritoneal mesothelial cells in five groups表2 5组腹膜间皮细胞E-cadherin、ZO-1 mRNA转录水平 (n=6,)
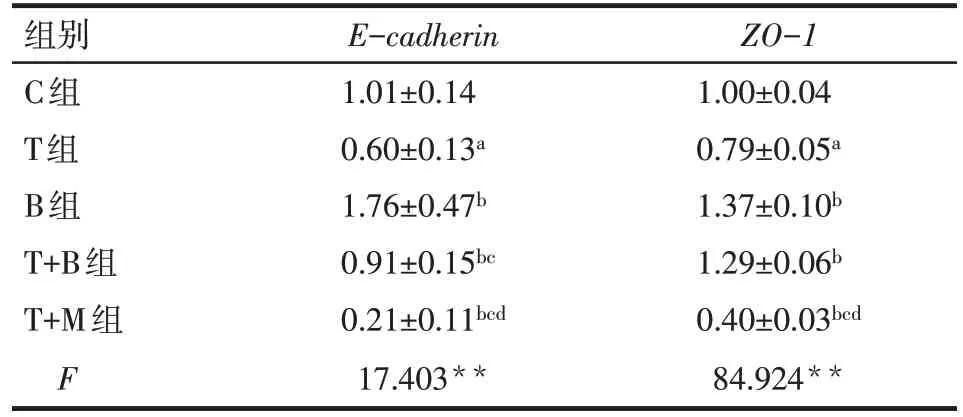
Tab.2 Transcription levels of E-cadherin and ZO-1 mRNA in peritoneal mesothelial cells in five groups表2 5组腹膜间皮细胞E-cadherin、ZO-1 mRNA转录水平 (n=6,)
**P<0.01;a与C 组比较,b与 T 组比较,c与B 组比较,d与T+B 组比较,P<0.05;表3同
ZO-1 1.00±0.04 0.79±0.05a 1.37±0.10b 1.29±0.06b 0.40±0.03bcd 84.924**组别C组T组B组T+B组T+M组F E-cadherin 1.01±0.14 0.60±0.13a 1.76±0.47b 0.91±0.15bc 0.21±0.11bcd 17.403**
2.3 各干预组腹膜间皮细胞形态 取培养的第2代腹膜间皮细胞进行实验,镜下细胞生长状态较好,细胞完全融合后进行实验干预。C组腹膜间皮细胞呈圆形、椭圆形、多边形的上皮样细胞。T 组经造模后,细胞数量明显减少。B 组细胞数量也较C 组减少,但较T 组细胞数量多,且有少量细胞呈现长梭形。T+B组干预后,细胞数量较模型组明显增多,细胞形态较为一致。T+M 组细胞数量明显减少,见图2。
2.4 各组细胞TGF-βR Ⅰ、TGF-βR ⅡmRNA 及Smurf2蛋白的表达比较 与C组比较,T组TGF-β1RⅡmRNA、Smurf2 蛋白表达上调(P<0.05);与T 组比较,T+B组TGF-β1RⅡmRNA表达上调,Smurf2蛋白表达下调,而T+M 组TGF-β1RⅠmRNA、Smurf2蛋白表达均下调,TGF-β1RⅡmRNA 表达上调(P<0.05);与 B 组比较,T+M 组TGF-β1RⅠmRNA 表达下调(P<0.05);与T+B 组比较,T+M 组TGF-β1RⅠ和TGF-β1RⅡmRNA 表达均下调(P<0.05),见图3、表3。
3 讨论
PD 是ESRD 患者的主要替代疗法之一,目前全世界有超过272 000例患者接受PD治疗[1]。中国国家肾脏病数据系统显示,截至2017 年底我国PD 患者达86 264例[7]。腹膜纤维化发生的原因和机制复杂,作为腹膜结构基础的间皮细胞发挥了重要作用。现代医学主要采用预防腹腔感染、改善腹透液生物相容性、改进PD 技术等手段抑制腹膜间皮细胞EMT,防治腹膜纤维化,近年也有相关基因治疗的报道[8]。部分单味及复方中药具有抑制EMT、抗纤维化的作用,临床用于慢性肾脏病(chronic kidney disease,CKD)及ESRD 的治疗。中医药抑制腹膜间皮细胞EMT,防治腹膜纤维化备受研究者的关注。研究表明,大黄素、丹参酮、黄芪甲苷、参芎注射液、肾康注射液等可改善由高糖腹透液诱导的大鼠腹膜功能减退及腹膜间皮细胞EMT,防治腹膜纤维化[9]。
Tab.3 Transcription levels of TGF-β1RⅠ and TGF-β 1RⅡmRNA and expression levels of Smurf2 protein in peritoneal mesothelial cells in five groups表3 5组腹膜间皮细胞TGF-β1RⅠ、TGF-β1RⅡmRNA转录水平及Smurf2蛋白水平 (n=6,)
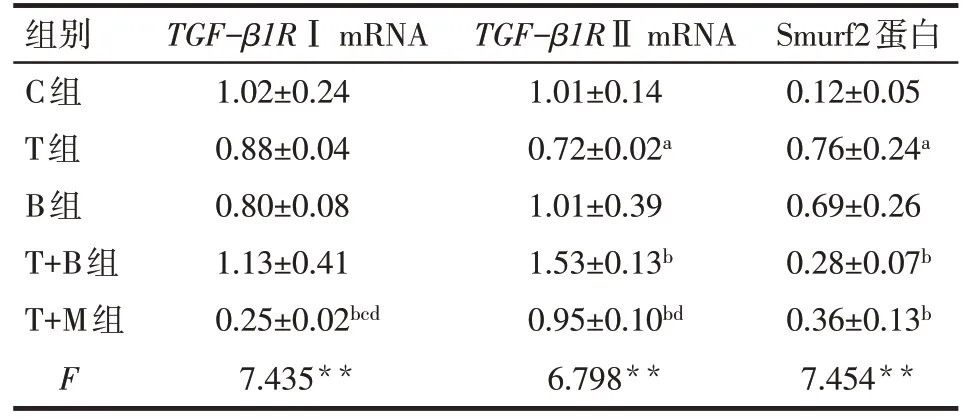
Tab.3 Transcription levels of TGF-β1RⅠ and TGF-β 1RⅡmRNA and expression levels of Smurf2 protein in peritoneal mesothelial cells in five groups表3 5组腹膜间皮细胞TGF-β1RⅠ、TGF-β1RⅡmRNA转录水平及Smurf2蛋白水平 (n=6,)
组别C组T组B组T+B组T+M组F TGF-β1RⅠ mRNA 1.02±0.24 0.88±0.04 0.80±0.08 1.13±0.41 0.25±0.02bcd 7.435**TGF-β1RⅡ mRNA 1.01±0.14 0.72±0.02a 1.01±0.39 1.53±0.13b 0.95±0.10bd 6.798**Smurf2蛋白0.12±0.05 0.76±0.24a 0.69±0.26 0.28±0.07b 0.36±0.13b 7.454**
PD 相关腹膜炎、腹膜透析液生物不相容性、高糖腹透液发生糖基化反应产生的糖基化终末产物等是导致腹膜间皮细胞EMT 的主要原因。其中TGF-β1 是目前公认的最强的促纤维化因子,TGF-β1 能促进上皮细胞EMT,还可以增加细胞外基质合成和减少细胞外基质降解,引起胶原沉积,加速腹膜纤维化。TGF-β1 需通过其受体TGF-βRⅠ和(或)TGF-βRⅡ而发挥作用。TGF-β1 先与TGF-βRⅡ结合形成复合物,之后TGF-βRⅠ再与形成的TGF-β1/TGF-βRⅡ复合物结合成聚合体形式,最终该聚合体进入细胞核发挥信号转导作用[10]。TGF-βRⅠ、TGF-βRⅡ、Smurf2 是腹膜间皮细胞EMT 中起重要作用的细胞因子。E-cadherin、ZO-1 是腹膜间皮细胞EMT的标志物,是上皮细胞侧面表达的重要连接蛋白。在EMT 早期,E-cadherin、ZO-1 表达降低,是导致细胞融合变松散,直至细胞脱落的原因[11]。Smurf 是一种含E6 同源相关蛋白羧基端(Homologous to the E6-AP Carboxyl Terminus,HECT)结构域的E3泛素连接酶,通过选择性地降解Smad 通路的关键组分,在调节TGF-β1 信号转导中起着举足轻重的作用[12]。Smurf2在TGF-β1信号活性调节中起枢纽作用,一旦功能失调,会导致一系列病理生理学改变[13]。Smurf2对TGF-β/Smads通路的调节是双向的,既有正调节也有负调节作用,主要取决于通过WW结构域与不同蛋白结合以发挥不同作用。Smurf2与Smad2和Smad3直接结合诱导其降解发挥抑制作用。Smurf2还可以与Smad7结合使之发生泛素化降解,从而活化TGF-β1/Smad 信号通路[14]。Smurf2的双向调节功能在维持TGF-β/Smads信号通路平衡中起了重要作用。因此,如何积极运用Smurf2 抑制通路的作用减少EMT 发生也是研究的重点。MG132是一种醛基肽类泛素-蛋白酶体抑制剂,能够抑制细胞中不同类型蛋白酶的活性,从而阻断靶蛋白的泛素化降解,目前在实验研究中得到广泛应用[15]。前期笔者课题组研究发现,一定浓度的扶肾方可通过调节尿毒症腹膜透析大鼠腹膜TGF-βRⅠ、TGF-βRⅡ的表达抑制腹膜间皮细胞EMT,改善腹膜纤维化[16]。
本研究通过体外腹膜间皮细胞培养,观察扶肾方对TGF-β1 干预的腹膜间皮细胞的E-cadherin、ZO-1、TGF-βRⅠ、TGF-βRⅡ和Smurf2表达的影响。PD 相关腹膜纤维化细胞因子的研究主要采用高浓度葡萄糖腹透液诱导制备模型,上皮细胞转分化模型则多采用TGF-β1干预腹膜间皮细胞制备[17]。本实验采用40 μg/L TGF-β1 干预腹膜间皮细胞制备EMT 模型。研究显示,TGF-β1 干预腹膜间皮细胞后,EMT 模型成功,E-cadherin、ZO-1mRNA 表达降低,而扶肾方含药血清干预后则明显增加E-cadherin、ZO-1mRNA 表达 。 模 型 组TGF-βR ⅡmRNA 表达明显降低,扶肾方含药血清可明显上调TGF-βRⅡmRNA 表达。另外,本实验采用MG132作为靶蛋白泛素化的抑制剂,经TGF-β1干预后,模型组Smurf2蛋白表达量明显升高,而MG132干预后明显下调,扶肾方含药血清组Smurf2 蛋白表达也明显下调,作用与MG132组类似。笔者推测扶肾方在TGF-β1 干预的腹膜间皮细胞EMT 模型中,通过上调TGF-βRⅡmRNA 表达,下调Smurf2蛋白含量,促进腹膜间皮细胞E-cadherin、ZO-1mRNA 表达,达到抑制腹膜间皮细胞EMT的作用。
传统医学认为,ESRD 的病机多为本虚标实证,本虚属脾肾亏虚,标实表现为湿浊、瘀血,脾肾亏虚是浊、瘀产生的主因。患者PD治疗后,仍不失ESRD病机关键,因此PD相关腹膜纤维化的主要病机仍为脾肾亏虚,湿浊瘀血内蕴。扶肾方是根据以上关键病机而配伍的临床效方,由陈皮、半夏、黄芪、当归、丹参、鬼箭羽、熟大黄、淫羊藿等组成,功效为“健脾益肾,化瘀降浊”,组方科学合理,融中医“和、消、补”三法于一体,前期临床研究及动物实验表明,该方能改善肾功能,减轻PD 腹膜纤维化[5],但目前离体细胞实验靶点尚不明确。
综上所述,本研究从体外细胞实验初步证实,扶肾方可通过上调TGF-βR ⅡmRNA 表达,下调Smurf2蛋白含量,抑制腹膜间皮细胞EMT,达到防治腹膜纤维化的作用,为临床应用扶肾方防治腹膜纤维化提供了实验依据及理论支持,但扶肾方抑制腹膜间皮细胞EMT,防治腹膜纤维化是否还通过其他信号通路发挥作用还需进一步深入探索。
