紫外光辐射山茱萸水提液制备纳米银及生物活性
2020-07-05魏思敏王英辉唐志书胡锦航蒋金涛宋忠兴
魏思敏, 王英辉, 唐志书, 苏 瑞, 胡锦航,郭 惠, 李 琛, 蒋金涛, 宋忠兴
(1. 陕西中医药大学, 陕西省中药资源产业化协同创新中心,秦药特色资源研究开发国家重点实验室(培育),陕西省创新药物研究中心, 咸阳 712083; 2. 长安大学理学院, 西安 710064)
纳米银(AgNPs)具有独特的光、 电、 磁等特性, 已被广泛应用于催化、 防静电材料、 低温超导材料[1]、 电子浆料和生物传感器材料等领域[2]. 作为抗菌剂纳米银属于非抗生素类, 可以克服细菌的耐药性[3], 并且具有很强的抗癌活性[4], 所以被广泛用于生物医药领域. 基于银纳米材料广阔的应用前景, 其制备方法的研究备受关注[5].
目前, 纳米银的制备方法主要有物理法、 化学还原法及生物还原法. 物理法通常需要使用大型仪器, 生产费用昂贵、 耗能较大; 化学法需要引入大量的有机试剂易造成污染, 同时合成的银纳米材料中残留有难以去除的有毒物质, 会影响其在医药领域的应用. 生物还原法是近年来发展的一类新方法, 包括微生物合成法[6]及植物还原法[7]. 微生物合成法通常在培养细菌、 藻类过程中加入硝酸银溶液, 微生物表面产生的还原性物质会将Ag+还原为纳米银[8]; 植物还原法则是利用植物提取液中的还原性成分还原硝酸银制备纳米银[9]. 植物还原法无需细菌培养, 具有操作简单、 资源可再生及安全有效等特点[10], 已成为当前研究的热点. 然而, 现有的使用植物法还原制备纳米银的研究大多需要在高温条件下进行[11], 制备条件比较苛刻且方法单一, 极大地限制了植物还原法在制备纳米银材料方面的发展.
为了解决植物还原法合成纳米银材料过程中反应条件苛刻、 方法单一等缺点, 本文采用紫外光照射法制备纳米银. 因为植物提取液中含有大量有机分子, 其对光的吸收很多都处在紫外区域, 所以利用紫外光照射植物水提液可以使这些分子到达更高的能级, 如单重激发态或者三重激发态, 处于更高能级的分子特别是具有还原性的分子更容易失去电子[12], 从而可与Ag+发生电荷转移反应, 使Ag+变为Ag单质.
山茱萸(Cornusofficinalis)属于山茱萸科山茱萸属植物, 是我国传统的中药材[13], 其水提液中主要含有环烯醚萜及其苷、 三萜、 黄酮、 鞣质及有机酸等化学成分[14,15]. 本文使用254 nm紫外光照射山茱萸水提液, 将其中具有还原性的活性成分活化, 进而将Ag+还原为AgNPs; 探讨了溶液pH值、 料液比及反应时间对还原反应的影响; 对制备的银纳米材料的理化性质以及抗菌、 抗氧化和抗癌活性进行了研究.
1 实验部分
1.1 试剂与仪器
硝酸银(纯度>99%)、 胰蛋白胨、 氯化钠、 酵母粉和琼脂粉均为分析纯, 购于成都科隆化学品有限公司; 1,1-二苯基-2-三硝基苯肼(DPPH), 分析纯, 购于上海阿拉丁生化科技股份有限公司; MTT试剂盒、 青霉素/链霉素双抗购于北京索莱宝科技有限公司; DMEM 基础培养基、 胎牛血清和胰蛋白酶购于Biological Industries公司; 山茱萸购于陕西兴盛德药业有限公司; 供试菌种大肠杆菌和金黄色葡萄球菌Escherichiacoli(E.coli)和Staphylococcusaureus(S.aureus)由陕西中医药大学陕西省中药资源产业化协同创新中心提供, 购于陕西乐博生化有限科技公司.
UV-2600型紫外-可见分光光度计, 日本岛津公司; ZEN 3600型激光粒度仪, 英国马尔文仪器有限公司; JEM-2010型透射电子显微镜, 日本理化株式会社; SW-CJ-2FD 型超净工作台, 苏净集团安泰公司; DSZ2000X型倒置显微镜, 重庆澳浦光电技术有限公司; Thermo Multiskan GO型多功能酶标仪, 美国Thermo公司.
1.2 实验过程
1.2.1 山茱萸水提液的制备 准确称取5.0 g干燥山茱萸粉末, 加入100 mL超纯水超声提取4 h, 过滤收集滤液备用, 经测定山茱萸水提液原液的pH=3.0.
1.2.2 山茱萸水提液制备AgNPs 取6份3 mL山茱萸水提液原液, 用NaOH(质量分数为10%)水溶液将调节pH分别为4.0, 5.0, 6.0, 7.0, 8.0和9.0, 分别加入3 mL 0.01 mol/L的AgNO3溶液, 室温下用254 nm紫外灯照射混合液, 以考察山茱萸水提液pH值对还原反应的影响.
在上述确定的最佳pH值下, 调节山茱萸水提液与硝酸银体积比分别为1∶1, 1∶2, 1∶4, 1∶5和1∶10, 室温下用254 nm紫外灯照射混合液, 考察了料液比对还原反应的影响.
在确定的最佳pH值和料液比条件下进行反应, 从加入硝酸银的时刻起开始计时, 考察了反应时间对还原反应的影响.
在最佳pH值、 料液比和反应时间条件下, 取5 mL山茱萸水提液, 加入相应量的硝酸银溶液, 室温下用254 nm紫外灯照射混合液. 反应完成后取反应悬浮液, 以9000 r/min转速离心30 min, 弃去上层清液得到沉淀, 用超纯水洗涤3次, 收集沉淀, 冷冻干燥至质量恒定备用.
1.2.3 AgNPs的表征 采用X射线晶体衍射仪、 激光粒度仪和透射电子显微镜对制备的AgNPs的晶体性质、 形貌、 粒径及表面特征等进行了表征.
1.2.4 AgNPs的抗菌活性测试 将测试用的S.aureus和E.coli分别接种于含有LB固体培养基的培养皿中划线, 于37 ℃培养18 h. 取已灭菌的2支试管分别加入LB液体培养基约15 mL, 用接种环挑取一环单菌落加入试管中, 置于水浴摇床中, 在37 ℃, 150 r/min条件下培养18 h. 取少许活化的菌体加入装有生理盐水的试管中, 摇匀, 制成1×105cfu/mL的菌悬液, 备用.
AgNPs抑菌活性的测定: 取一定量的AgNPs配制成浓度为1000 μg/mL的样品母液, 随后用无菌水逐步稀释至浓度分别为15.6, 7.8, 3.9, 2.0和1.0 μg/mL. 将待测样品溶液分别加入96孔板中, 每孔中均加入100 μL样品液和100 μL菌悬液, 每个样品重复3次, 每次均加入无菌水200 μL作为阴性对照和200 μL菌悬液作为阳性对照. 将96孔板置于37 ℃培养箱中培养, 经一定时间间隔测量其在600 nm处的吸收值.
1.2.5 AgNPs的抗氧化性能测试 参照文献[16]方法, 准确称取2.5 mg DPPH溶解于100 mL乙醇中, 置于冰箱中避光保存. 将AgNPs配制成不同浓度梯度的样品溶液. 精密量取1 mL样品溶液加入5 mL试管中, 再加入1 mL DPPH溶液, 将上述反应液置于室温下暗处反应30 min, 测量517 nm处的吸光度值(A), 重复3次. 按下式计算清除率(Scavenging rate, %):
Scavenging rate=[1-(A1-A2)/A0]×100% (1)
式中:A0为1 mL DPPH+1 mL 超纯水在517 nm处的吸光度值;A1为1 mL DPPH + 1 mL 样品在517 nm处的吸光度值;A2为1 mL样品+1 mL 乙醇在517 nm处的吸光度值.
1.2.6 AgNPs的抗癌活性测试 采用噻唑蓝(MTT)法测定肿瘤细胞的活力[17]. 取对数生长期的结直肠癌细胞HCT-116和SW620进行消化, 得到细胞悬液后计数, 按照计数结果将细胞浓度调整为约5×104cell/mL, 以每孔200 μL分别接种于 96 孔板中, 在5%CO2和37 ℃条件下于细胞培养箱中培养24 h后, 吸除上层清液. 将浓度分别为 100.0, 50.0, 25.0, 12.5, 6.3, 3.1, 1.6和0.8 μg/mL的AgNPs溶液加入到96孔板中, 每个浓度梯度设置3个复孔, 未加入AgNPs溶液的细胞作为对照组, 置于 5% CO2, 37 ℃培养箱中培养24 h. 然后, 每孔加入20 μL MTT溶液(5 mg/mL), 继续培养4 h, 最后每孔加入150 μL DMSO, 用酶标仪测定490 nm处的吸光度A, 按下式计算AgNPs对肿瘤细胞HCT116 和SW620的抑制率(Cell inhibition, %):
Cell inhibition=[1-(A-Ab)/(A0-Ab)]×100% (2)
式中:A0为对照组在490 nm处的吸光度;A为AgNPs处理组在490 nm处的吸光度;Ab为背景在490 nm处的吸光度.
2 结果与讨论
2.1 山茱萸水提液pH值对还原反应的影响
据文献[18]报道, 山茱萸水提液和硝酸银水溶液在>400 nm处均无明显吸收, 而纳米银在410 nm附近具有明显的表面等离子体共振峰(SPR峰)[19], 因此, 可利用UV-Vis吸收光谱监测纳米银的生成. 首先, 将山茱萸水提液原液(pH=3.0)与AgNO3水溶液混合, 在室温下用254 nm紫外灯照射10 min后, 测定混合液的UV-Vis光谱. 结果如图1所示, 混合液在>400 nm处未见明显吸收, 表明没有纳米银生成. 前文[18]中将山茱萸水提液原液与硝酸银溶液混合液超声反应4 h后即可制得银纳米材料, 因此推测紫外光照射混合液后不能还原AgNO3得到银纳米材料, 这可能是由于在山茱萸水提液原液中具有还原性的活性成分以阳离子形式存在, 虽然254 nm紫外灯照射可以使这些阳离子处于相对高的能级, 但是仍然不能将电子传递给Ag+而将其还原为AgNPs. 基于以上推测, 尝试调节山茱萸水提液的pH值, 使水提液中的活性还原成分处于中性或者负离子形式. 如图1(A)所示, 当将山茱萸水提液的pH值升高至5.0时, UV-Vis吸收光谱中410 nm附近出现纳米银的SPR峰, 表明在此条件下用 254 nm紫外灯照射山茱萸水提液(pH=5.0)与AgNO3水溶液混合液后有纳米银生成. 这表明在山茱萸水提液中, 如果还原性物质处于阳离子形式, 即使其处于高能级也不能将Ag+还原为AgNPs. 继续提高山茱萸水提液的pH值发现: (1) 当pH=6.0时, 410 nm附近纳米银的SPR峰强度与pH=5.0时未见明显变化, 但是其在500 nm之后的吸光度却比pH=5.0时明显增强. 纳米银的聚集会使其在长波长处吸收, 故推测这可能是由于在pH=6.0时有小部分纳米银聚集所致; (2) 当pH提高至7.0时, 纳米银在410 nm附近的SPR峰强度急剧增强, 推测在pH接近中性的溶液中, 山茱萸水提液中的还原性成分可能以负离子形式存在, 当处于高能级的还原性活性成分将Ag+还原为Ag后, 以负离子形式存在的活性物质会很快吸附在纳米银表面将其稳定, 而在pH=6.0或5.0时, 山茱萸水提液中的活性成分大部分以中性形式存在, 相比于负离子形式并不容易吸附在纳米银表面而稳定纳米银. 此外, 与中性形式相比, 以负离子形式存在的还原性活性物质被254 nm紫外灯激发至高能级后, 因为缺少1个质子, 更容易失去电子将Ag+还原为Ag, 所以在pH=7.0或9.0时生成的纳米银量更多; (3) 继续提高山茱萸水提液pH值至9.0后, 观察到410 nm附近纳米银的SPR峰强度增大的程度并没有水提液pH值从6.0变化到7.0时大, 表明当pH>7.0后升高溶液pH值, 生成纳米银的效率并不会再提高, 这主要是由于当溶液的pH大于水提液中活性成分的pKa后, 其大部分以负离子形式存在, 并不会产生更多负离子形式的活性成分, 所以生成纳米银的效率不会继续增加; (4) 随着溶液pH从5.0升高至9.0时, 纳米银的SPR峰最大吸收波长有微小变化, 这主要是由于在不同pH值时制得的纳米银粒径不同所致. 在不同pH值时测得的平均粒径[图1(B)]也证实了此推测. 为了更加高效地制得纳米银, 在考察料液比及反应时间等的影响时, 均在山茱萸水提液pH=7.0条件下进行实验.

Fig.1 UV-Vis spectra of the mixtures after the reaction between Cornus officinalis aqueous extract and AgNO3 at different pH values(A) and the size of as-synthesized AgNPs(B)
2.2 料液比对还原反应的影响
在pH=7.0条件下考察了山茱萸水提液与硝酸银体积比(料液比)对还原反应的影响. 保持硝酸银的用量不变, 在料液比分别为1∶1, 1∶2, 1∶3, 1∶5, 1∶10时进行实验. 由图2所示UV-Vis光谱可见, 纳米银的生成量与反应体系中山茱萸水提液的用量直接相关, 山茱萸水提液的用量越多, 生成纳米银就越多; 同时, 在不同料液比下纳米银SPR峰的最大吸收波长也不同, 表明制得的纳米银粒径可能不同. 当料液比增大至1∶1时, 在640 nm附近出现一个吸收峰, 此吸收峰应该来源于纳米银的聚集体. 出现聚集体可能是由于体系中还原性物质的量增加导致纳米银的成核速度加快, 还未被稳定剂稳定的纳米银通过形成更大尺寸的聚集体的方式最终稳定下来. 基于此, 不需要继续增加山茱萸水提液的用量.

Fig.2 UV-Vis spectra of the mixtures after the reaction between Cornus officinalis aqueous extract and AgNO3 with different volume ratios
2.3 反应时间对还原反应的影响
在pH=7.0和料液比为1∶1条件下考察了反应时间对还原反应的影响. 从加入硝酸银且用紫外灯照射的时刻起开始计时. 由图3可见, 254 nm紫外灯照射山茱萸水提液和硝酸银混合液10 min后体系中有大量纳米银生成, 并且随着反应时间的延长, 纳米银的生成量逐渐增加, 直至反应3 h后, 体系中不再继续生成纳米银(410 nm附近的吸收峰强度不再增加). 其中, 在反应前1 h内410 nm附近吸收峰强度的变化率最大, 表明反应1 h后生成纳米银的速率逐渐变慢. 出现这种现象的原因可能是: 在反应初始阶段, 体系中含有大量的还原性物质, 以254 nm紫外灯照射反应体系后会迅速生成纳米银, 同时会有相应量的活性物质吸附在纳米银表面; 这会导致体系中具有还原性的活性物质的量逐渐减少, 所以反应进行到1 h后还原反应速率会逐渐减慢.

Fig.3 UV-Vis spectra of the mixtures after the reaction between Cornus officinalis aqueous extract and AgNO3 at different times
基于以上反应条件对还原体系的影响结果, 选择如下的纳米银合成条件: 反应液pH=7.0, 山茱萸水提液/AgNO3体积比为1∶1, 反应时间为1 h.
2.4 纳米银材料的表征
采用X射线晶体衍射(XRD)仪对制备的纳米银进行了表征, 结果如图4(A)所示, 位于 2θ=37.8°, 44.0°, 64.4°和77.4°处的4个衍射峰可分别归属于纳米银的(111), (200), (220)和(311)面(JCPDS No. 04-0783), 表明合成的纳米银为面心立方结构.
使用TEM对制得的纳米银材料的形貌进行了表征. 将pH=7.0, 料液比为1∶1, 反应1 h后的混合液离心, 取出沉淀洗涤数次, 分散在铜网附有碳膜支持的一面, 将铜网自然晾干3 h后, 利用TEM进行表征, 结果如图4(B)所示. 可见, 制得的纳米银材料呈近球形, 分散较均匀, 有小部分的聚集体, 与紫外-可见光谱表征结果一致, 粒径主要分布在50~60 nm之间.

Fig.4 XRD pattern(A) and TEM image(B) of the synthesized AgNPs
2.5 纳米银材料的平均粒径及Zeta电位
在25 ℃下, 对制得的纳米银材料的平均粒径和Zeta电位分别测量了3次. 如图5所示, 平均粒径为(55.4±0.9) nm, 与TEM表征结果基本一致;Zeta电位为-10.2 mV, 说明纳米银材料表面吸附的物质带有负电荷, 这进一步证实了上文推测的结论: 在反应液pH>6.0时, 山茱萸水提液中的活性物质可能以负离子形式存在. 正是由于纳米银表面所带负电荷之间的静电排斥作用使制备的纳米银材料不易发生团聚. 对制得的纳米银材料的稳定性进行了考察, 平均粒径测量结果显示, 纳米银材料放置15 d后平均粒径为(55.4±1.0) nm, 放置至30 d后平均粒径为(55.8±1.1) nm, 与新制备的纳米银平均粒径基本一致, 表明该纳米银材料具有良好的稳定性.

Fig.5 Size and zeta potential of synthesized AgNPs
2.6 纳米银材料的抑菌率
细菌培养液的吸光度可以反映培养液中细菌的增殖速度, 故通过测量细菌培养液在600 nm处的吸光度值来确定制备的纳米银对金黄色葡萄球菌(S.aureus)和大肠杆菌(E.coli)生长的抑制作用[20]. 由图6可见, 随着培养时间的增加, 加入生理盐水的对照组菌液的OD600值不断增大; 而加入不同浓度纳米银后其OD600值则发生了明显变化. 对于S.aureus, 加入浓度为1.0和2.0 μg/mL的纳米银材料后, 其OD600值与对照组相比明显变小, 表明纳米银抑制了S.aureus生长[图6(A)]; 将纳米银浓度继续增大至3.9 μg/mL后, 在6 h内其OD600值基本不发生变化, 表明此浓度下在6 h内S.aureus的生长被完全抑制. 对于E.coli, 也观察到了类似的结果: 当在培养液中加入不同浓度的纳米银后,E.coli的生长明显受到抑制, 但是直到将纳米银的浓度增大至7.8 μg/mL时, 6 h内E.coli的生长才会被完全抑制[图6(B)]. 可见, 制备的纳米银对S.aureus的抑制作用更明显. 在光照条件下用山茱萸水提液制备的纳米银和He等[20]使用莲子水提液制备的(10.0 μg/mL)纳米银对S.aureus均有较好的抑制效果, 但也存在微小的差异, 我们推测这可能是由于在纳米银合成过程中吸附在纳米银表面的化学成分不同所致; 此外, He等[20]合成的纳米银粒径为(12.9±3.7) nm, 通常, 纳米粒子的粒径越小, 比表面积越大, 与细胞的接触面越多, 其抗菌作用应该越强; 但实际上本文制备的纳米粒子抑菌效果更强, 表明在植物还原法中吸附在纳米粒子表面的物质在杀菌中也会发挥重要作用.
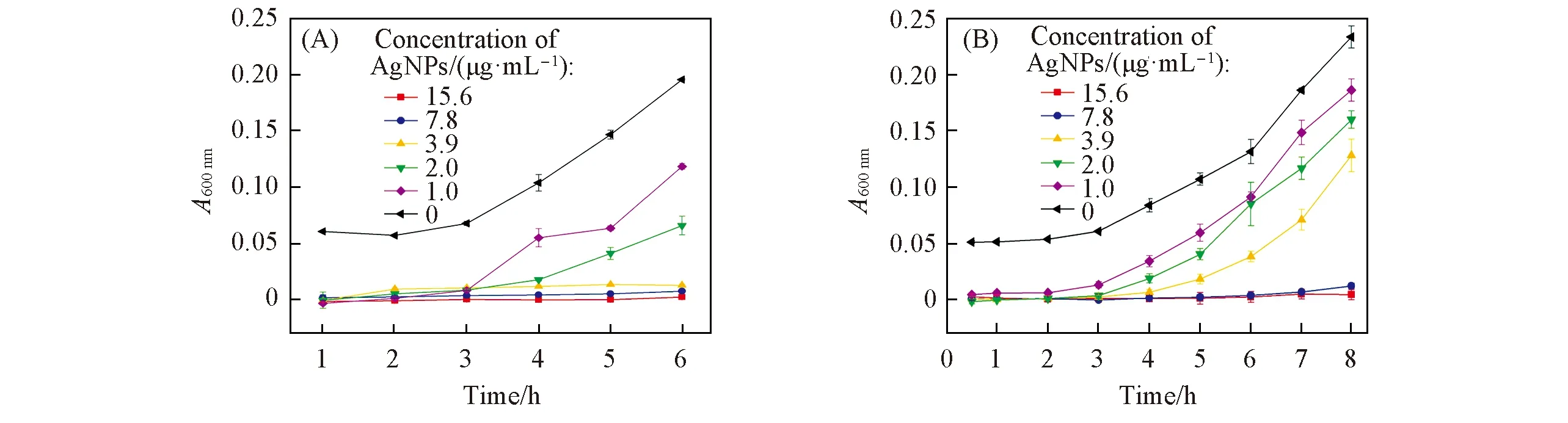
Fig.6 Antibacterial activity for S. aureus(A) and E. coli(B) of AgNPs generating byCornus officinalis aqueous extract
2.7 纳米银材料的抗氧化作用
对制备的纳米银材料对DPPH自由基的清除能力进行了评价. 由图7可见, 纳米银材料对DPPH有明显的清除作用, 并且清除率随着纳米银材料浓度的增大显著增加, 在0~62.5 μg/mL范围内呈一定量效关系; 当纳米银材料的浓度达到62.5 μg/mL时, 其对DPPH自由基的清除率达到70.0%, 说明制得的纳米银材料具有较强的自由基清除能力; 但是当纳米银材料的浓度大于62.5 μg/mL后, 清除率不再随浓度改变而产生明显变化.
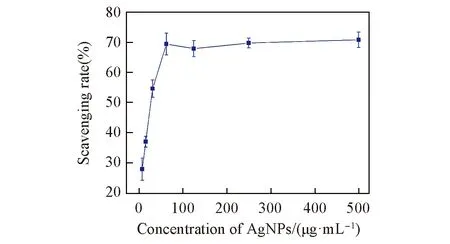
Fig.7 Free radical scavenging rate of AgNPsagainst DPPH
2.8 纳米银材料的抗癌活性
对制备的纳米银材料的抗癌活性进行了研究. 选取结直肠癌细胞HCT116和SW620作为研究对象, 结果如图8所示. 可见, 随着纳米银的加入, 2种结直肠癌细胞的存活率均明显下降, 与之对应的是其对2种肿瘤细胞的抑制率明显增强, 表明所制备的纳米银材料具有抗癌活性. 其中, 对于HCT116, 当纳米银的浓度增大至50 μg/mL时, 其存活率仅有15.7%, 即对肿瘤细胞HCT116的抑制率为84.3%; 继续增加纳米银浓度至100 μg/mL后, 细胞的存活率变为6.6%(抑制率93.4%), 根据线性回归方程计算其半数抑制浓度IC50为23.1 μg/mL. 而对于SW620, 当纳米银的浓度为50 μg/mL时, 肿瘤细胞的存活率更低, 仅为9.4%(抑制率90.6%); 继续增大纳米银的浓度, 肿瘤细胞的存活率变化没有HCT116明显, 为9.0%(抑制率91.0%), 半数抑制浓度IC50为35.1 μg/mL. 制备的纳米银对2种结直肠癌细胞的半数抑制浓度稍有不同, 这可能是因为这2种肿瘤细胞对于纳米银的吞噬效果不同; 此外, 当纳米银被肿瘤细胞吞噬后, 因为2种细胞的微环境不同, 可能也会导致其产生的活性氧物种(ROS)的含量不同[21], 而纳米银的抗肿瘤活性很大程度上源于其产生的ROS氧化癌细胞的DNA, 造成癌细胞无法复制, 从而杀死癌细胞[22]. 本文制备的纳米银对癌细胞的毒性与文献报道的使用莲子[20]、 红叶苋[23]和木田菁[24]等制备的纳米银基本相同.

Fig.8 Inhibition effects of AgNPs on HCT116(A) and SW620(B)
3 结 论
以山茱萸水提液作为还原剂, 利用254 nm紫外光辐射, 在室温下制备了纳米银材料; 考察了溶液pH值、 料液比和反应时间对还原反应的影响, 当反应液pH>5.0时, 用254 nm紫外灯照射山茱萸水提液与AgNO3的混合液即可生成纳米银, 且当pH>7.0时纳米银的生成效率不会随着pH值的增大继续增加; 当山茱萸水提液/AgNO3体积比为1∶1时, 纳米银的生成效率最高; 还原反应在前1 h内效率最高. 对pH=7.0, 山茱萸水提液/AgNO3体积比1∶1和反应时间1 h条件下制备的纳米银的理化性质进行了表征, 发现制得的纳米银材料为面心立方结构, 呈近球形, 分散均匀, 平均粒径为(55.4±1.0) nm; 表面带有负电性(-10.2 mV), 具有较高的稳定性, 在30 d内其粒径未发生明显变化. 生物活性研究结果显示, 制得的纳米银对DPPH自由基的清除率很高, 当纳米银浓度为62.5 μg/mL时其自由基捕获率为70.0%; 纳米银可以有效抑制金黄色葡萄球菌和大肠杆菌的生长, 最小抑菌浓度分别为3.9和7.8 μg/mL; 并且具有明显的抗肿瘤活性, 对结直肠癌细胞HCT116和SW620的IC50值分别为23.1和35.1 μg/mL. 本文结果不仅为纳米银的制备提供了一种新方法, 也为山茱萸资源的开发利用提供了新思路.
