催化剂表面Cu0含量对二氧化碳加氢合成C2+醇性能的影响
2020-07-05张维中温月丽宋镕鹏
张维中, 温月丽, 宋镕鹏, 王 斌, 张 倩, 黄 伟
(1. 太原理工大学环境科学与工程学院,2. 煤科学与技术教育部和山西省重点实验室, 太原 030024)
近年来, 化石燃料的大量燃烧导致了大气中CO2浓度的增加, 对气候和环境造成的严重影响. 因此, CO2的捕集与利用(CUU)受到了越来越多的关注[1]. 低碳醇作为一种新能源, 具有辛烷值高的特点, 与汽油具有良好的掺混性能, 可以代替甲基叔丁基醚(MTBE)作为汽油添加剂, 并且可以作为清洁燃料等[2].
通过催化剂将二氧化碳转化为低碳醇不仅可以降低大气中二氧化碳的浓度, 有助于缓解气候变化的问题, 还可以缓解全球范围内的能源危机. 目前, 二氧化碳加氢合成低碳醇的催化剂主要由一氧化碳加氢的基础上发展而来, 主要分为改性的甲醇催化剂、 改性的F-T合成催化剂、 钼基催化剂和贵金属催化剂4类催化剂[3~6]. 其中改性甲醇催化剂的主要产物为甲醇和异丁醇, 钼基催化剂的反应条件严苛, 而贵金属催化剂的成本较高. 因此, 价格低廉、 反应条件温和、 活性高的改性F-T催化剂成为研究的热点, 被认为是最具工业化前景的催化剂之一. 目前常用的F-T改性催化剂有CuCo和CuFe催化剂, CuCo催化剂通常稳定性较差, 并且醇类选择性较低, 因此价格更为低廉, 稳定性更好的铁基催化剂受到关注, 其中CuFe催化剂制备低碳醇的研究是当前的热点[7]. 在CuFe催化剂中, 铜铁物种不仅是逆水煤气反应的活性物质, 同时也是合成醇类产物的活性位点, 因此研究不同状态的铜铁分布对产物分布的影响具有很大的意义.
金属有机骨架材料(MOFs)由于独特的孔道结构、 大的比表面积而受到关注[8]. 这种材料可以通过孔道的限域功能将活性组分均匀分散, 有效防止了活性组分团聚的现象. 由于独特的结构和金属组分的含量较高, 通常可以通过焙烧MOFs材料得到金属氧化物材料甚至是碳材料[9,10], 有效解决了传统(碳)材料不能均匀大量浸渍活性组分的问题, 已被逐渐应用于二氧化碳加氢反应中[11~13], 如ZIF-8, UiO-67, CuZn-BTC等在二氧化碳加氢生成甲醇、 甲烷方面都有研究, 此外Fe基MOFs材料在生成短链烯烃、 烷烃方面也被广泛关注[14,15].
本文利用Fe基MOFs材料负载铜活性组分, 并在空气气氛下焙烧、 预还原得到了CuFe基系列催化剂, 将其应用于二氧化碳加氢制备低碳醇的反应, 通过改变还原温度研究了催化剂中铜铁物种价态分布对反应产物分布的影响.
1 实验部分
1.1 试剂与仪器
硝酸铜[Cu(NO3)2·3H2O]、 硝酸铁[Fe(NO3)3·9H2O]、 无水氢氧化钠(NaOH)、N,N二甲基甲酰胺(DMF)和甲醇(CH3OH)均为分析纯, 购于天津市科密欧化学试剂有限公司; 对苯二甲酸为分析纯, 购于美国Sigma-Aldrich公司.
DX-2700型 X射线衍射仪(XRD, 日本理学公司); TP-5000型吸附仪(天津先权公司); Quantachrome SI型N2吸附仪(美国Quanta Chrome公司); ESCALAB 250型X射线光电子能谱仪(美国赛默飞公司); Quanta 400 FEG型扫描电子显微镜(SEM)和Tecnai G2 F20型透射电子显微镜(TEM, 美国FEI公司).
1.2 催化剂的制备
1.2.1 Fe-MIL-88B的合成 参照文献[16]方法合成Fe-MIL-88B, 首先, 将4.04 g Fe(NO3)3·9H2O和1.66 g对苯二甲酸分别溶解于DMF溶液中, 然后将两个溶液快速混合在一起并且加入到8 mL 4 mol/L的氢氧化钠溶液中, 在室温下搅拌30 min. 将得到的溶液移入100 mL内衬为聚四氟乙烯的反应釜中, 在100 ℃下水热反应24 h, 用DMF和甲醇进行洗涤, 在烘箱中于60 ℃进行干燥即得到Fe-MIL-88B样品.
1.2.2 Cu/Fe-MIL-88B的制备 通过溶液浸渍的方法来将铜组分负载进入MOFs. 首先, 将0.15 g Cu(NO3)2·3H2O加入100 mL甲醇中, 搅拌溶解完全后, 将1 g Fe-MIL-88B加入溶液内, 并使其均匀分散, 在室温下搅拌24 h后, 在90 ℃下搅拌蒸干, 并在烘箱中于60 ℃干燥12 h得到浸渍铜的MOFs材料, 记为Cu/Fe-MIL-88B.
1.2.3 催化剂R-T的制备 将Cu/Te-MIL-88B置于马弗炉中在空气气氛下于350 ℃焙烧4 h, 得到催化剂前驱物R-N, 然后将R-N样品在n(H2)/n(N2)=1∶4的气氛下于不同温度(250, 350, 450 ℃)进行6 h的还原, 得到的样品记为R-T. 其中, R代表还原,T代表还原温度, 按照还原温度的不同, 此系列催化剂依次标记为R-250, R-350, R-450.
1.3 CO2加氢反应
CO2加氢反应在连续性固定床反应器上进行. 将0.5 mL催化剂置于内径为8 mm的反应管中. 反应前, 先将催化剂置于n(H2)/n(N2)=1∶4的混合气中在常压下不同温度下还原6 h. 还原后将H2和N2的混合气切换为n(CO2)/n(H2)=1∶3的混合气, 并在4 MPa, 310 ℃, 空速为7200 h-1的条件下对催化剂进行活性评价. 反应后的气相和液相产物采用GC-950N型气相色谱仪(南京伽诺仪器仪表有限公司)进行分析. 其中, 醇类、 烃类物质等有机物成分经PEG-20M填充柱分离后由火焰离子化(FID)检测器检测, CO和CO2等经TDX-01填充柱分离后由热导(TCD)检测器检测.
1.4 表 征
XRD表征: 以CuKα作为辐射源, 扫描范围为5°~85°, 扫描速率为8°/min. 氢气程序升温还原(H2-TPR)表征: 将50 mg的催化剂在150 ℃下用氦气吹扫30 min, 然后降温至50 ℃, 将氦气切换为还原气(5%H2-95%N2, 体积分数), 以10 ℃/min的速率升温至800 ℃, 用热导检验器检验耗氢量. 氮气吸附-脱附表征: 将样品在200 ℃下脱气6 h. 催化剂的比表面积采用BET公式计算, 孔容和孔径采用BJH公式计算. XPS表征: 以表面污染碳C1s峰(284.8 eV)作荷电效应矫正. SEM测试的加速电压为20 kV. TEM测试前样品需要在乙醇中分散进行制样, 加速电压为200 kV.
2 结果和讨论
2.1 XRD表征
图1为R-T系列催化剂的XRD谱图. 其中R-N为未经预还原的催化剂. R-N呈红棕色, 具有磁性, 由图1可见, R-N中Cu和Fe物种主要以CuFe2O4(JCPDS No.77-0010)的物相存在, 这可能是因为催化剂中Cu和Fe组分均匀分散、 相互作用所致. 随着还原温度的升高, 催化剂中的主要物相逐渐向Fe3O4(JCPDS No.89-4319)和Fe(JCPDS No.87-0722)转变, 并且Fe的特征衍射峰逐渐变得尖锐, 而Fe3O4的特征衍射峰则相反. 这表明随着还原温度的升高, 催化剂中单质Fe的结晶度提高, 晶粒尺寸增大, 在催化剂中的含量逐渐增大, 而Fe3O4含量逐渐减少. 当还原温度达到250和350 ℃时, 催化剂中Fe主要以Fe3O4和Fe物相存在, 当还原温度达到450 ℃时, 催化剂中Fe3O4的特征衍射峰接近于消失, 并伴随出现了Fe3C(JCPDS No.72-1110)的衍射峰, 此时催化剂中Fe主要以Fe3C和单质Fe形式存在, 并且还有微量的Fe3O4.
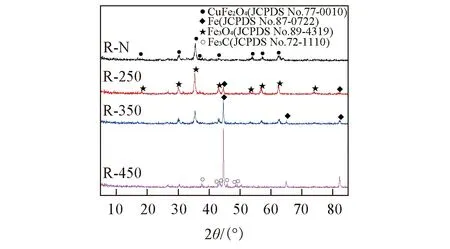
Fig.1 XRD patterns of the R-N and R-Tseries of catalysts
2.2 SEM和TEM表征
为了探究催化剂的形态和微观结构, 对催化剂R-N和R-350进行了SEM和TEM表征, 如图S1(见本文支持信息)所示, 图S1(A)和(D)分别为催化剂R-N和R-350的TEM照片, 由图S1可知, 催化剂R-N和R-350均由直径均匀的球状颗粒组成, 其在R-N中直径约为30 nm, R-350中直径略大, 约为40 nm. 图S1(B)和(C)和图S1(E)和(F)分别为催化剂R-N和R-350的SEM照片, 可见在催化剂R-N和R-350的表面球状纳米颗粒呈现软聚集. 图2(A)和(B)~(D)分别展示了催化剂R-N和R-350的HRTEM照片. 在催化剂R-N中出现的0.25 nm的晶格间距, 可以归属为CuFe2O4的(311)晶面, 在催化剂R-350中出现的0.203, 0.25, 0.21和0.301 nm的晶格间距, 可以分别归属为Fe(110), Fe3O4(311), Cu(111)和Cu2O(110)晶面.

Fig.2 HRTEM images of R-N(A) and R-350(B—D)
图3(A)与(E)分别为催化剂R-N和R-350的STEM照片, 图3(B)~(D)和(F)~(H)分别为R-N和R-350的Cu, Fe, O元素的分布图. 由图3可见, Cu, Fe,O 3种元素在两个催化剂中均呈均匀分散. 活性组分的均匀分散有利于催化剂活性组分之间的充分接触和相互作用, 达到提高二氧化碳加氢催化活性的目的.

Fig.3 STEM images of R-N(A) and R-350(E) and corresponding of elemental mapping images ofCu(B, F), Fe(C, G), O(D, H) of R-N(A—D) and R-350(E—H)
2.3 N2吸附-脱附表征
为了研究催化剂的织构信息, 对R-N及R-T系列催化剂进行了N2物理吸附-脱附表征. 由图4(A)的N2吸附-脱附曲线可知, 所有样品的等温线均呈Ⅳ型并伴有H3型回滞环[17]. 高压区域(p/p0>0.4)出现的回滞环表明催化剂属于介孔材料[18]. 催化剂孔径分布见图4(B), 当催化剂在较低温度(250 ℃)还原时, 孔径分布相对于未经预还原时变得不均匀且更宽. 随着还原温度继续升高时, 孔径分布变窄, 主要集中在4 nm左右, 此时催化剂的孔径分布更均匀. 但是随着还原温度继续升高至450 ℃时, 孔径分布又略微变宽. 表S1(见本文支持信息)列出了催化剂的织构参数, 由表S1可见, 随着还原温度逐渐升高, 催化剂的比表面积和孔容在逐渐减小, 当还原温度为250 ℃时, 孔径达最大, 之后又逐渐减小. 综上所述, 过高的还原温度容易使活性组分团聚, 不利于形成均匀的孔道结构, 同时在一定程度上降低了催化剂的孔径、 孔容和比表面积, 不利于催化反应的进行. 同样, 过低的还原温度也不利于形成均匀的孔道结构.
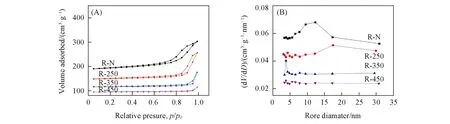
Fig.4 N2 adsorption and desorption isotherms curve(A) and pore sizedistributions(B) of R-N and R-T catalysts
2.4 H2-TPR表征
2.5 XPS表征
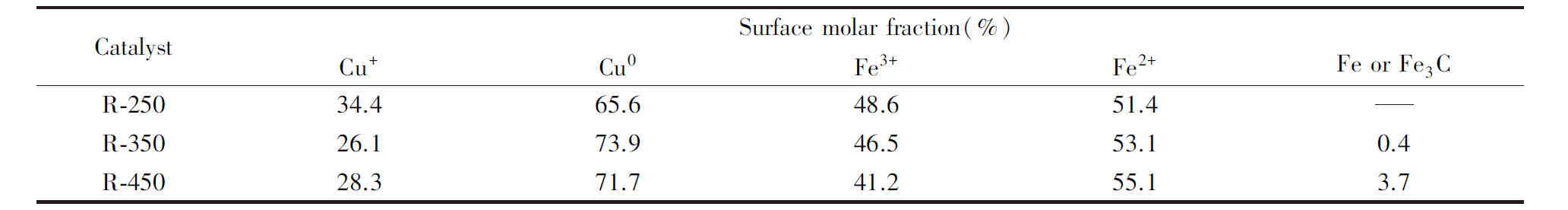
图5(A)展示了R-T系列催化剂的Fe2p的XPS谱图, 可以看出, 当催化剂未经预还原时, Fe2p1/2和Fe2p3/2的结合能分别为723.7 和710.4 eV, 并且在718.2 eV处出现了卫星峰, 这表明在催化剂中存在Fe3+物种[21]. 当催化剂被还原后, Fe2p3/2的特征峰向低结合能方向偏移, 变为709.5 eV, 并且Fe3+的卫星峰消失不见, 这意味着催化剂中Fe物种向低价态过渡, 出现了Fe3O4物种[22]. 当催化剂的还原温度达到350 ℃及更高时, 在705.8 eV处的结合能出现了单质Fe物种的特征峰, 并且还原温度越高, 峰面积越大, 说明了单质Fe含量随还原温度的升高而增大, 与XRD和H2-TPR的表征结果一致. 表1列出了依据XPS分峰数据计算得到的催化剂表面Cu, Fe物种各价态的分布情况. 由表1可见, 催化剂中Fe2+的含量随还原温度的升高而逐渐升高, 分别达到了51.4%, 53.1%和55.1%, 当还原温度为350 和450 ℃时, 催化剂中出现了Fe单质, 其含量分别为0.4%和3.7%. 图5(B)给出了催化剂Cu2p的XPS谱图, 未还原催化剂的Cu2p1/2和Cu2p3/2的结合能分别为952.7 和932.7 eV, 并且在961.2 和941.0 eV处发现了卫星峰, 这表明催化剂中存在Cu2+的物种[23]. 当催化剂被还原后, Cu2p1/2和Cu2p3/2的特征峰向高结合能方向移动了约0.5 eV, 分别变为953.2 和933.1 eV, 并且卫星峰消失. 这表明催化剂中Cu2+物种被还原为低价态物种[24], 并且Cu物种与周围环境的作用形式发生变化, 由于低价态的铜在XPS中结合能差异较小, 采用俄歇谱图(LMM XAES)来加以区分. 如图5(C)和表1所示, 在912.5 eV附近出现的峰归属于Cu+物种, 而在916.0 eV附近的峰归属为Cu0物种[25,26]. 随着还原温度的升高, 催化剂表面Cu+和Cu0物种含量发生了变化, Cu0所占摩尔比先增大后降低, 分别为65.6%, 73.9%和71.7%.

Fig.5 XPS spectra of Fe2p(A) and Cu2p(B), and Cu LMM XAES(C) forR-N and R-T series of catalysts
Table1PercentageofcopperandironspeciesinR-TseriesofcatalystsderivedfrompeakfittingsofCuLMMXAESandFe2pXPS
表S2(见本文支持信息)展示了R-N及R-T系列催化剂反应前及催化剂R-350反应后(A-350)中各元素的表面含量. 由表S2可见, 催化剂表面主要由C, O, Cu和Fe元素组成, 还有微量的N元素存在. 其中, N可能来自于制备MOFs材料时使用的溶剂DMF. 而C元素含量最高, 占50%左右, 这可能来源于催化剂前驱物中的有机物质在热解条件下分解并在表面富集. 随着还原温度的升高, 催化剂表面的Cu元素含量逐渐升高, 但在R-450催化剂中又略有降低, 而Fe元素的表面含量逐渐降低. 对比催化剂R-350反应前后组分含量的变化, 发现反应后催化剂表面的C元素含量升高, 这是因为反应过程中催化剂表面积碳所致.
2.6 催化剂活性分析
图6(A)给出了R-T系列催化剂用于二氧化碳加氢反应中产物的选择性和CO2转化率. 可见, 产物以CO和醇类为主, 两者占产物的80%左右. 随着还原温度的升高, CO2转化率先降低后升高, 且未经预还原的催化剂R-N的CO2转化率最高, 为7.54%, 但是与最低值6.18%相差不大. 产物CO的选择性在逐渐降低, 而烃类物质的选择性在逐渐升高, 这表明高的还原温度有利于反应产物CO向烃类物质的转化. 总醇的选择性随着还原温度的升高, 先升高后降低, 在350 ℃还原时, 总醇选择性达到最高为39.4%, 这与催化剂孔径尺寸分布和Cu0/(Cu++Cu0)摩尔比的变化规律一致, 说明了均匀集中的孔径分布和相对较高的Cu0含量有于醇的生成, 这可能是由于催化剂的择形效应所致, 适当尺寸的孔道能够定量限域反应物, 使反应物定向生成醇.
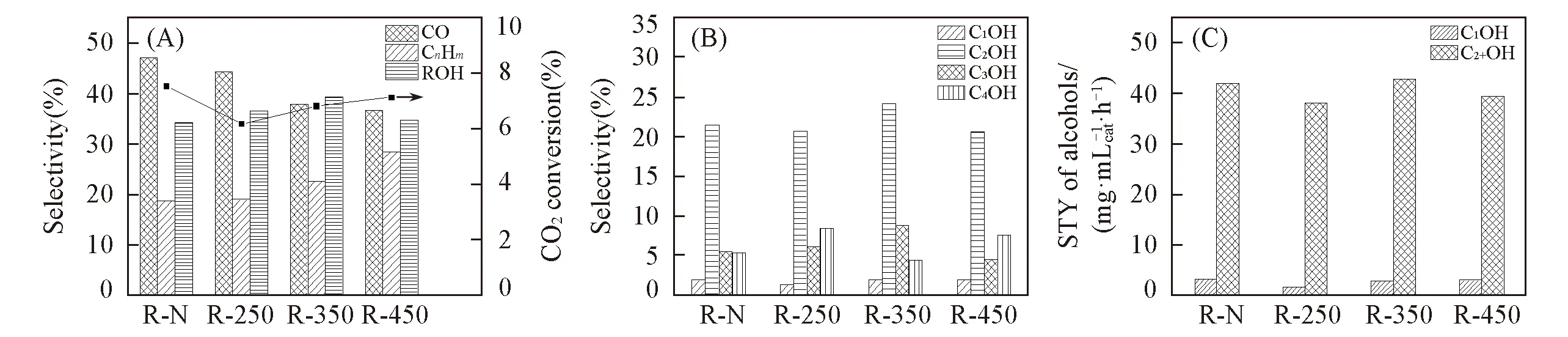
Fig.6 Catalytic performance of R-T series of catalysts(A) Products selectivity; (B) alcohols selectivity; (C) alcohol STY of R-T. (A) ROH means total alcohol, C1OH, C2OH, C3OH, C4OH refer to methanol, ethanol, propanol, butanol, respectively.
图6(B)展示了催化产物中各种醇的选择性. 可见, 相对于未经预还原的催化剂而言, 还原后的催化剂生成的产物中总醇选择性明显升高. 醇产物以C2+醇为主, 甲醇仅占很小的一部分, 并且随着还原温度升高, 甲醇的选择性略有升高, 乙醇和丙醇的选择性均是先升高后降低, 这与催化剂中Cu0/(Cu++Cu0)摩尔比变化趋势保持一致, 表明Cu0含量的升高有利乙醇和丙醇的生成, 而丁醇的选择性则是先降低后升高, 说明Cu0含量的升高不利于丁醇的生成. 这可能是由于催化剂中Cu0半空的s轨道能够接纳来自二氧化碳和氢气的外层电子, 有利于二氧化碳和氢气的活化, 活化后的H·自由基和CO·会为下一步CO和CnHm的生成做好准备. 而由于催化剂孔道的空间限域功能, 使丁醇等较大的醇不易生成和脱附, 导致在醇类产物分布中以乙醇为主, 说明尺寸为4 nm左右的孔道对生成乙醇分子有利.
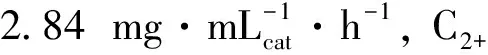
表2列出了产物中醇的分布, 可以看到, 产物中C2+醇的摩尔比都达到了94.0%以上, 其中乙醇占主要部分, 均在60%左右. 综上所述, 低价态的铜和铁有利于F-T反应进行. 而对于产物醇而言, 适当比例的Cu0, Cu+和Fe3O4更加有利于醇类的生成, 当还原温度为350 ℃, Cu0/(Cu++Cu0)摩尔比最大, 约为73.9%, 此时催化效果最佳, CO2转化率为6.82%, 总醇选择性为39.4%, 其中C2+醇的摩尔比达到95.1%.

Table 2 Distribution(%) of C1—C4 alcohols
为了探索产物的碳链增长能力, 绘制了醇类产物和烃类产物的碳数分布图(图S3, 见本文支持信息), 此图展示产物由低碳物种向高碳物种的转变过程, 烃类产物和除甲醇外的醇类产物都能较好地符合ASF(Anderson-Schulz-Flory)分布. 在醇类分布中, C1醇明显偏离了ASF的分布, 这说明大部分的甲醇都已经转化为了C2+醇, 催化剂对醇类的碳链增长效果优越. 醇类产物的碳链增长因子约为0.60, 烃类产物的碳链增长因子约为0.42, 两者比较接近, 表明醇类和烃类产物来源于同一中间产物[27].
此外, R-N和R-T系列催化剂均展示了较好的稳定性. 图S4(见本文支持信息)展示了R-N和R-T系列催化剂连续72 h反应的CO2转化率与总醇选择性的活性数据. 由图S4可知, 催化剂R-250, R-350和R-450的CO2转化率在72 h的连续反应中维持稳定, 变化较小. 而催化剂R-N在反应24 h内CO2转化率逐渐上升, 这是由于催化剂在反应24 h内处于预还原活化阶段, 在24~48 h时CO2转化率达到最高, 48~72 h时略有降低. 对于产物中总醇选择性而言, R-N和R-T系列催化剂在反应的24 h内均缓慢上升, 24~72 h时维持稳定.
为了明确所制催化剂的催化剂性能, 表S3(见本文支持信息)对比了文献[28~32]报道的各类催化剂在CO2加氢合成低碳醇中的性能数据. 由表S3可知, 相对于6%Fe-CuZnZrO2和Cu/Mo2C催化剂, R-350催化剂上生成的产物中C2+醇的选择性以及其在总醇中的占比都更具优势. 相对于R-350催化剂, LaCo0.7Ga0.3O3和CuCo催化剂具有反应条件温和(温度、 压力较低)、 C2+醇的选择性高的特点, 但是其C2+醇在总醇中的占比仍然比R-350低. 催化剂CuZnFeK催化反应条件较为苛刻(压力高), C2+醇的选择性与R-350接近, 但C2+醇在总醇中的摩尔比相对较低. 由此可见, 通过Fe基MOFs材料制得的CuFe催化剂总体上稳定性较好, C2+醇的摩尔比高达95%以上, 有利于产物进一步分离.
2.7 反应机理
图7为反应后催化剂的XRD谱图, A-N, A-250, A-350和A-450分别表示R-N和R-T系列催化剂反应后的催化剂. 图7(A)显示反应后的催化剂中主要出现了Cu0(JCPDS No.70-3038)和Fe3O4(JCPDS No.89-4319)的物相, 在XRD的局部放大图[图7(B)]中出现了Fe5C2(JCPDS No.89-7272)物相. 碳化铁通常被认为是碳链增长的活性位点, 这一物相的生成可能是催化剂碳链增长能力优越的原因之一[33]. 在CO2加氢反应过程中, CO2首先吸附在Cu和Fe3O4等活性物种表面, 发生逆水煤气反应生成CO, CO解离吸附在Cu-FeCx位点上, 直接加氢生成甲醇, 或者在FeCx位点上解离生成C·和O·. 解离生成的C·加氢形成烷基物质CHx, 并且通过CHx的不断插入进行碳链增长生成烃类物质CnHm. 在Fe活性位点生成的CHx迁移到Cu活性位点附近, 被Cu吸附的CO插入到金属烷基键中形成了酰基物质, 最后进一步加氢得到低碳醇[34~36]. 在这个过程中Cu-FeCx作为合成低碳醇的活性位点, 其中FeCx起到CO的解离吸附以及碳链增长的作用, 而铜起到了CO的活化作用, 并为CO的插入提供环境, 两者的协同作用是生成低碳醇的关键[26].
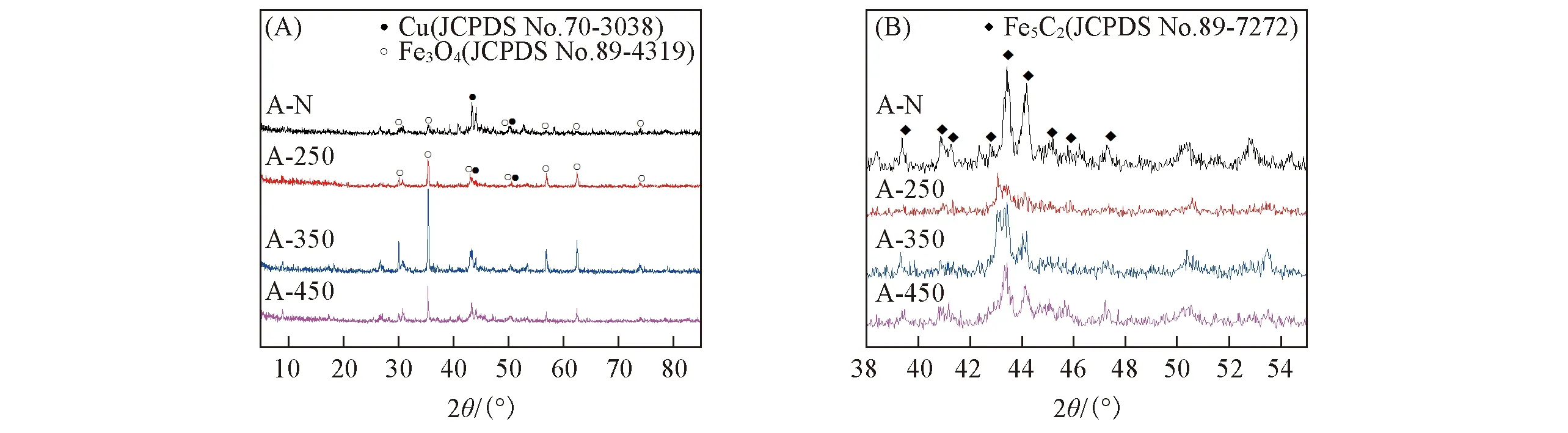
Fig.7 XRD patterns of A-N and A-T series of catalysts
3 结 论
通过空气中焙烧Cu@Fe-MIL-88B MOFs材料制备了活性组分均匀分散的CuFe基催化剂前驱物. 经过不同温度下预还原后所得的催化剂表面具有不同的CuFe价态分布, 这对CO2加氢反应合成C2+醇产生了较大影响. 当催化剂中Cu0在(Cu++Cu0)中的摩尔比为73.9%, 并且铁物相中存在0.40%的单质Fe时, 对于C2+醇的生成最有利. 铜铁的协同作用是合成醇的关键, 催化剂中碳化铁的生成对反应产物的碳链增长起到重要作用.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20200061.
