脂质修饰DNA复合结构的可控制备及膜生物学研究
2020-07-05张露灏曹书婷刘江波左小磊王丽华樊春海1
张露灏, 曹书婷, 刘江波, 左小磊, 王丽华,樊春海1,, 李 江
(1. 中国科学院上海应用物理研究所, 中国科学院微观界面物理与探测重点实验室, 上海 201800;2. 中国科学院大学, 北京 100049;3. 上海交通大学医学院分子医学研究院, 附属仁济医院, 上海 200240;4. 中国科学院上海高等研究院, 张江实验室, 同步辐射光源, 上海 201204)
生物体内环境被脂质膜结构高度区隔化成细胞、 细胞器与囊泡等限域空间. 这些空间内往往具有多种生物分子形成的拥挤效应, 与外部环境存在较大差异, 依靠膜上通道进行有选择性的物质交换[1]. 同时, 细胞内的物质转运、 信号传递等功能, 也依赖于膜结构(如囊泡)的运输[2,3]. 因此, 细胞内的生化反应通常受到膜结构的精确时空调控, 可以远离热力学平衡态, 与试管中均相稀溶液条件下热力学控制的化学反应存在很大不同[4]. 在试管反应中已被验证有效的诊断探针、 治疗药物等通常无法在活细胞中发挥理想的功能. 近年来, 对于膜结构的化学与生物学研究成为热点方向, 对细胞成像、 诊断、 治疗以及构建纳米机器人与人工细胞等应用领域具有重要意义. 然而, 如何在纳米尺度对细胞膜结构进行精确的控制与测量分析, 仍然是膜生物学研究的一大挑战.
脂质和脱氧核糖核酸(DNA)是2类重要的生物大分子, 多种生物结构均基于脂质或者DNA构成. 真核细胞在产生数千种不同的脂质方面投入了大量资源, 要用到5%的基因来合成所有这些脂质[5]. 大部分天然脂质含有疏水的尾部和亲水的头部. 疏水相互作用驱动脂质自组装形成超分子结构, 如脂质双分子层、 脂质体及胶束[6]. 脂质体可以模拟细胞, 研究蛋白质在生理环境中构象和活性的变化[7]. 另外, DNA自组装具有完全不同的化学基础, 氢键在DNA形成双链的过程中起重要作用. 高度精确的碱基配对原则使DNA能自组装形成特定的二级和三级结构[8~10]. 如特定DNA双链的形成, 保证遗传信息在跨代传递过程中具有高保守性. 值得一提的是, 在不同氢键疏水和静电相互作用的介导下, 一类被称为适配体(Aptamer)的单链DNA也能选择性地与离子、 小分子或蛋白质靶标结合[11]. 然而, 单独的脂质或单独的DNA结构功能仍然非常有限. 对于脂质而言, 疏水性的脂质在水相中的聚集在尺寸、 形貌和单分散性等方面难以得到精确控制, 无法用于量化的细胞研究[12]. 此外, 脂质分子中存在的官能团相当有限, 进一步限制了其在生物分析和生物医学领域的应用[13]. 而对于DNA来说, 负电性的DNA分子难以锚定于或者跨越同样带负电的质膜[14].
脂质和DNA在自然界中发挥着相互独立的作用. 然而, 通过共价连接的方法, 研究者能将疏水分子和DNA连接起来[15,16]. 研究[17]表明, 疏水化合物(如卟啉和烷烃)与DNA链连接后, 可将DNA链锚定在细胞膜上. 同时, 脂质分子(如生育酚、 胆固醇及磷脂等)呈现出更优越的膜锚定能力. 这种现象可能是由于这些分子与细胞膜脂双分子层的亲和力更高, 具有更强的相互作用所致[18]. 脂质和脂质-DNA还可以构建二维的扩散反应平台, 在二维平面上研究并控制分子间的相互作用, 如酶的级联反应[19]. 脂质-DNA复合结构所呈现的新颖特征包括: 高度可控和可编程的DNA自组装, 可用于微调脂质的结构和结合模式; DNA易修饰上各种功能基序, 如荧光基团、 猝灭基团、 小分子药物、 交联剂和光活化基团, 能进一步功能化调控脂质-DNA复合结构, 可用于生物分析和生物调节; 脂质修饰有利于脂膜募集DNA, 可使DNA跨越细胞膜或简单地锚定在质膜表面. 因此, 脂质修饰的DNA器件均能有效应用于细胞膜生物学方面的研究.
本文将讨论脂质-DNA复合结构的设计、 结构和生物应用, 并聚焦其在活细胞膜上的功能; 综述了近年来脂质-DNA复合结构在细胞膜纳米孔形成、 细胞膜信号转导分析以及细胞间相互作用调控和物质转运等方面的应用; 还探讨了脂质-DNA复合结构目前面临的一些挑战和未来的应用.
1 脂质-DNA复合结构用于构建膜孔结构
纳米孔是指含有纳米尺寸空心孔道的结构. 天然纳米孔通常由1组蛋白质构成, 用于细胞膜上的分子运输. 这种基于蛋白质或肽的纳米孔也被广泛用于体外DNA测序和单分子研究[20~22]. 与合成的固态纳米孔相比, 这些天然纳米孔具有结构可再生、 骨架稳定和生物相容性好的优势[21]. 但蛋白质纳米孔的从头设计存在巨大的挑战. 此外, 蛋白质纳米孔的直径(通常小于5 nm)和形状通常很难任意定制或改变. 因此, 大多数蛋白质纳米孔的目标选择性和功能性均不易被调节.
为了更好地控制纳米孔的大小和形状, 最近研究者们构建了一系列基于DNA结构的新型纳米孔. 如前文所述, DNA可以通过Watson-Crick碱基配对原则精确且可预测性地自组装. 利用DNA构建不同大小和形状的纳米结构(包括纳米孔)是一个相对简单的过程[23,24]. 然而, 如何让这些由亲水材料合成的纳米孔在生物膜上发挥作用仍然存在挑战. 促进这些合成DNA纳米孔插入膜的一种方法是将纳米孔与疏水基序结合, 如胆固醇[23]、 卟啉[25]和其它疏水连接物[26], 形成脂质-DNA复合结构.
脂质-DNA复合结构的制备可以在固相DNA合成之前(预合成)或之后(后合成)进行. 预合成策略包括合成脂质磷酰胺以及在DNA合成过程中将其插入到所需的寡核苷酸序列[27]. 在后合成策略中, 首先需要在DNA链中插入可以进一步用于脂质结合的反应性官能团[28,29]. 这2种方法均被广泛应用于合成脂质-DNA复合结构. 其中, 预合成策略用到的磷酰胺可有效结合DNA, 并能很好地控制脂质修饰的数量和位置, 得到了广泛应用. 几种常用的脂质磷酰胺类化合物现已上市, 这也说明可以根据设计的DNA序列定制目标脂质-DNA复合结构. 已有如人工细胞膜纳米孔的制备等成熟的化学策略被应用于脂质-DNA复合结构在生物领域[30]. 这些新型膜锚定于DNA纳米孔, 被应用于促进跨膜分子流动[31]、 药物递送[32]或生物传感[33~35]等领域.
Simmel等[36]和Gothelf等[37]受天然通道蛋白α-溶血素[38]的启发, 构建了第一个完全由DNA构成的纳米孔, 并通过胆固醇侧链将其锚定到合成脂膜上, 使其可以在脂膜上发挥作用[图1(A)]. 该纳米孔通道通过DNA折纸术自组装而成, 其结构由穿透并跨越脂质膜的茎和黏附在膜顺式面的筒状结构的盖2个模块组成. 桶状结构通过其顺式面的26个胆固醇基序黏附在膜上. 茎从筒的中心突出, 是由6个DNA双螺旋结构域组成的中空管状结构. 中间的管状结构作为跨膜通道, 内径为2 nm, 长度为42 nm, 贯穿整个茎和桶. 通过改变通道的构型, 能实现不同的门控行为. 通过测量单个纳米孔的电流扰动, 该人工膜通道可用于检测单个DNA分子的转移. 考虑到由天然带负电的磷酸二酯键骨架构成的纳米筒会破坏原位脂双层的结构, Howorka等[26]模拟具有疏水表面的膜蛋白, 在六螺旋DNA纳米筒结构上设计了长度为2.2 nm的由硫代磷酸脂(PPT)构成的疏水带[图1(B)]. 这种DNA纳米桶高约15 nm, 外直径5.5 nm, 内直径2 nm. 该疏水带能消除磷酸盐阴离子的负电荷, 减少对质膜的扰动. 通过使用更大和更疏水的基序取代烷基, 科研人员进一步优化了这些DNA纳米孔的锚定效率, 并减少疏水基序的使用数量[39]. 如Howorka等[40]通过2个卟啉标记, 构建了双功能化学标记的纳米通道[图1(C)], 实现对纳米孔插入脂膜行为的观测. 他们[41]进一步优化疏水标记通过胆固醇标记的纳米孔[图1(D)]开发出能够智能调节小分子跨膜运输的结构. 这种基于配体, 能被选择性打开或关闭的纳米孔结构, 可应用于生物传感或基于逻辑的药物递送. 该研究组[25]还发现, 将纳米孔修饰到肿瘤细胞膜上, 可以通过改变细胞运输系统而对细胞产生毒性, 从而杀死肿瘤细胞. 这为实现精准治疗提供了新思路.
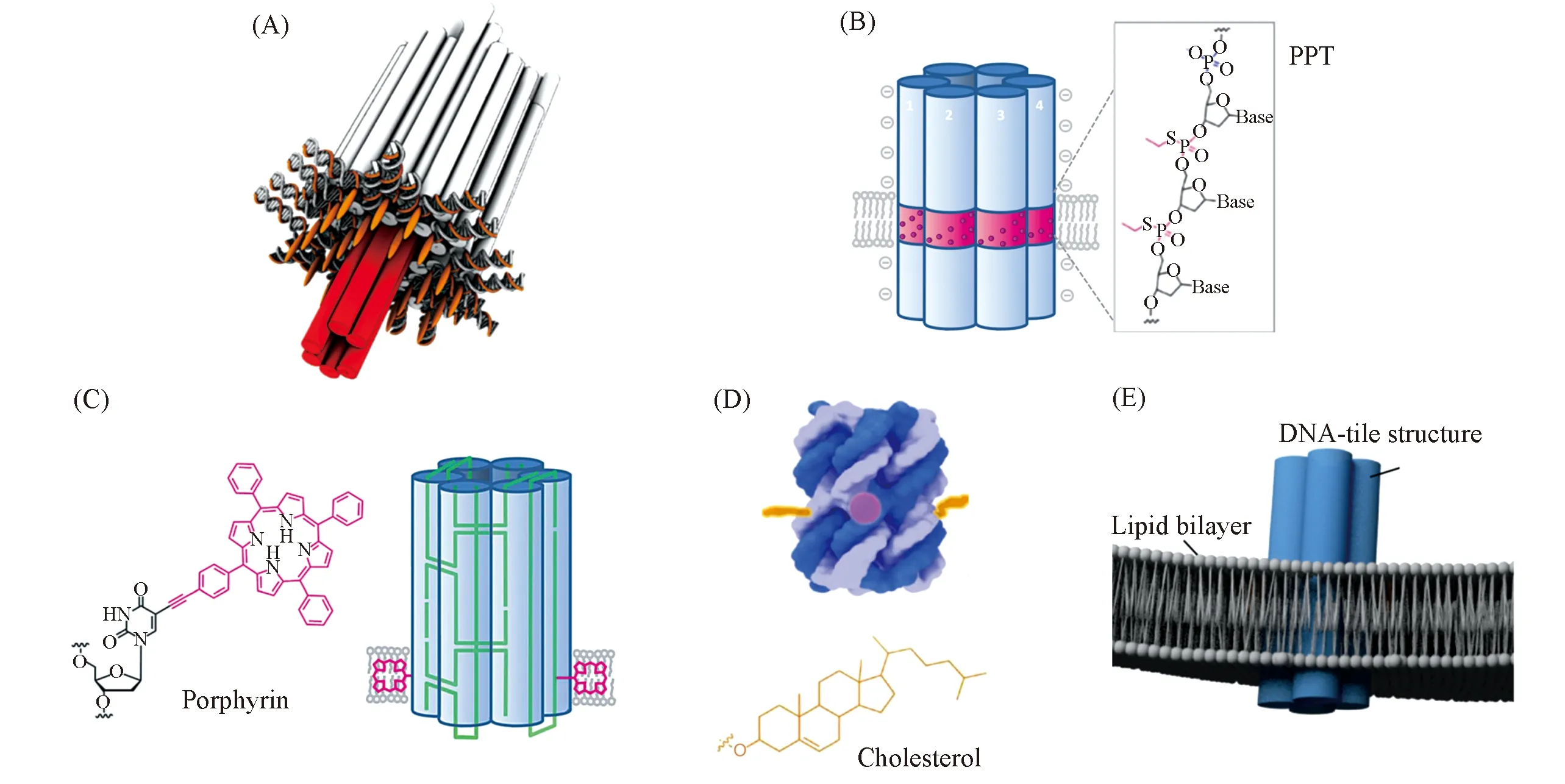
Fig.1 Nanopores constructed by lipid-DNA conjugates(A) Self-assembled cholesterol-modified DNA nanopores[37], copyright 2019, American Chemical Society; (B) hydrophobic belts used to construct nanopores[26], copyright 2013, American Chemical Society; (C) porphyrin-modified DNA nanopores[40], copyright 2013, Wiley-VCH; (D) three-cholesterol-modified DNA nanopores[41], copyright 2018, Springer Nature; (E) DNA nanopores constructed from DNA tile structures[42], copyright 2015, American Chemical Society.
Göpfrich等[42]使用DNA瓦片(DNA tile)的方法, 构建了由4条11 nm长的DNA双链组成的相对简单的纳米孔[图1(E)]. 该结构产率高, 其通道宽度从2 nm减小到0.8 nm, 达到离子通道的典型内径. 该研究组[43]进一步研制了更为简化的跨膜结构. 该结构为修饰有疏水分子的DNA双链, 其能在缺乏内部物理通道的情况下提供可直接穿过脂质膜的离子通道. 这种简单设计呈现了新的以DNA为基础的膜孔的设计途径, 为生物技术和生物医学应用的发展开辟了广阔前景.
总之, 基于DNA的纳米孔相比于更早出现的基于天然蛋白的纳米孔在性能上各有优劣. 用于构造蛋白纳米孔的蛋白是经过千万年自然进化筛选出来的, 并且都经过了合理优化, 在DNA测序等方面有不可替代的优势[4]. 然而, 蛋白质具有免疫原性, 从而限制了其在治疗方面的应用. 同时, 利用非天然氨基酸构建蛋白纳米孔具有很大难度[44]. 最重要的是, 很少有蛋白纳米孔的尺寸超过5 nm, 且蛋白孔很难进行可编程的大幅度变构[45], 这些弊端均极大地限制了蛋白纳米孔的应用范围. 基于DNA的可编程性和可寻址性, DNA构建的纳米孔可以很好地避免蛋白孔的上述弊端, 表现出更大的自由度. 如, 相比于氨基酸, 核苷酸的尺寸更大, 并且可以通过沃森-克里克碱基互补配对原则组装成更复杂的结构、 实现更长的链长, 这使得DNA纳米孔的尺寸可以达到几十纳米[46,47], 克服了蛋白和多肽的限制. 同时, DNA纳米孔的编程是精确可控的. 已有特定的软件可以通过序列设计对DNA纳米孔的形貌与尺寸进行精确的控制[24], 使DNA双链形成的柱体自由扩展, 并且通过交联方式实现双链间的平行排列, 从而形成筒状纳米孔. 除了平行双链之外, 还有曲率的双链[22,48]及链之间形成特定角度的多面线框结构[49,50]可用于构建更丰富的几何图形, 这使得DNA纳米孔有了更多可能的形状. 脂质或其它疏水基团修饰的DNA纳米膜孔通过进一步优化, 可以应用于开发生物传感器、 调节膜渗透性和运输特定药物等方面. 这些纳米膜孔甚至可以用于单分子测序以及原位活细胞膜检测等领域.
尽管如此, DNA纳米孔的发展仍然面临一些亟待解决的问题. 未来DNA纳米孔的设计应该考虑到DNA孔比蛋白孔更加疏松, DNA壁有离子泄露的可能[51,52], 这个问题可以通过构建更厚的孔壁来解决. 另外, DNA纳米孔的带电密度可以达到每平方纳米1个负电荷, 这不利于纳米孔插入同样带负电的磷脂膜, 此问题可以通过化学修饰磷酸骨架[26]或者用中性肽核酸代替[53]来解决. 同时, 通过合成化学可以扩展DNA纳米孔的化学多样性[54], 但因为要形成双链, 所以对DNA的化学修饰受到很多限制. 未来优化DNA纳米孔的结构和功能均需要考虑上述问题.
2 脂质-DNA复合结构用于调控细胞团聚
组织和器官通常由一群功能不同但互补的细胞组成. 这些在组织空间中高度有序、 相互作用的细胞, 是控制细胞簇在体内功能的重要影响因素[55]. 通常认为, 三维组织中的细胞行为与二维培养环境中的细胞行为有很大差异[56]. 考虑到获取真实组织样本具有难度, 为了更好地理解和预测体内细胞行为, 在体外构建结构合适的三维细胞聚集体具有重要意义[57]. 虽然科研人员在控制细胞团聚方面取得了一定进展, 但在形成预定义的三维细胞团簇方面仍然面临着挑战, 特别是针对不同类型的细胞所形成的细胞团簇[58]. 而脂质-DNA复合结构可用于调控细胞团聚, 在构建三维细胞团簇方面具有良好的应用前景.
脂质-DNA复合结构能够精确调控不同细胞的接触和排列方式. 基于DNA序列的互补性, 利用细胞膜锚定DNA, 能将细胞固定在玻璃表面上的特定位置[59]或特定类型的细胞旁边. Teramura等[60]将聚乙二醇(PEG)-磷脂修饰的DNA锚定到细胞膜表面, 通过调节互补DNA链, 进一步将细胞附着至其它细胞或基质表面[图2(A)]. 因此, 脂质-DNA复合结构可简单有效地实现2种特定类型细胞的黏附. 该研究组[61]进一步通过脂质-DNA复合结构实现细胞连接的方法研究了细胞侵入过程, 发现在人急性白血病细胞(CCRF-CEM)、 人正常乳腺上皮细胞(MCF-10A)、 人乳腺癌细胞(MCF-7)和人胚肾细胞(HEK293)细胞系中, DNA杂交能介导细胞间的相互作用. 有趣的是, 形成细胞-细胞结合物后, 正常的MCF-10A细胞可以被肿瘤细胞MCF-7内化. 他们还发现, DNA介导的细胞连接并未导致这些细胞的入侵, 相反, 入侵主要是由E-钙黏蛋白介导的相互作用引起的. 因此, 脂质-DNA复合结构对研究细胞间的相互作用具有重要意义.
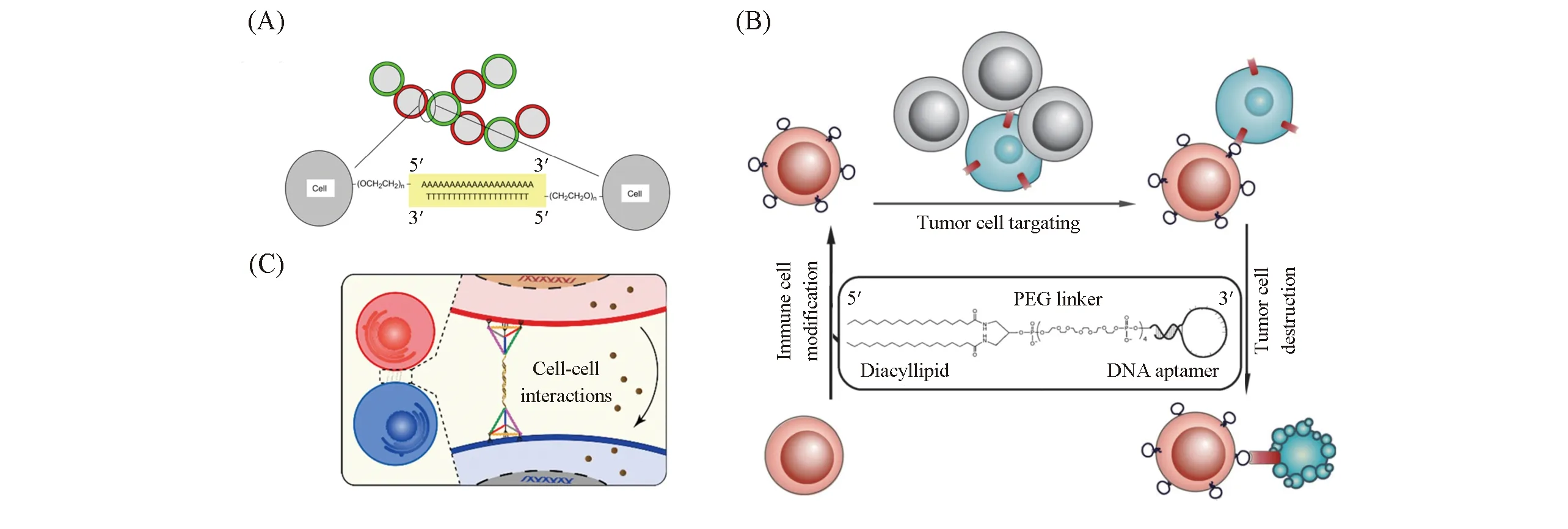
Fig.2 Lipid-DNA conjugates regulate cell aggregation(A) Control of cell attachment through lipid-DNA conjugates[60], copyright 2010, Elsevier; (B) lipid modified DNA aptamer mediated cell targeting[63], copyright 2013, Wiley-VCH; (C) programming cellular Interactions by three cholesterol modified DNA nanoplatform[64], copyright 2019, American Chemical Society.
Todhunter等[55,62]利用类似的细胞连接策略构建了三维微型组织. 首先, 将脂质-DNA复合结构修饰在细胞上; 随后, 使这些细胞流过一个修饰有互补DNA链的基底, 导致细胞被基底捕获. 经过多次捕获和洗涤循环, 可以形成三维微组织. 通过加入DNA酶, 能有效降解这些微组织, 得到分散的单个细胞. 并且微组织的大小、 形状、 组成和异质性可以通过改变DNA的序列和加入细胞的顺序、 种类进行控制. 利用这种方法, 甚至可以构建厘米尺度的三维组织.
除了互补DNA介导的细胞相互作用外, 适配体也可用于调控细胞间的相互作用. 适配体是一类有特定二级结构的单链DNA或核糖核酸(RNA), 能够特异性地识别包括细胞膜蛋白在内的多种靶点. Tan等[63]通过适配体调控肿瘤细胞与免疫细胞的相互作用, 实现了免疫治疗[图2(B)]; 并通过脂质将能够靶向白血病细胞膜蛋白的适配体修饰在免疫效应细胞膜上, 经适配体修饰的免疫效应细胞可以选择性地识别目标白血病细胞. 通过这种方法, 分化抗原8阳性(CD8+)细胞毒T淋巴细胞经修饰后可以在不同细胞的混合体系中特异性地识别并杀死目标淋巴细胞瘤. 随着新核酸适配体的开发, 这些脂质-适配体复合结构在细胞治疗中可能得到更广泛的应用.
目前, 大部分脂质-线性DNA复合结构面临着在细胞膜表面稳定性较差、 易被细胞内化的问题. Tan等[64]设计了胆固醇-DNA四面体复合探针, 显著提高了探针在膜表面的稳定性[图2(C)]. 通过在四面体DNA的3个端点修饰胆固醇来锚定细胞膜, 而另1个端点伸出一段DNA单链用来介导细胞间的相互作用. 与单个胆固醇直接锚定的线性DNA相比, 这种四面体探针有多个脂锚定位点, 显示出更高的膜锚定稳定性(约100倍)和更高的目标可达性(约2.5倍), 可以更有效地研究细胞间相互作用.
虽然脂质-DNA复合结构所构建的细胞团簇与真实的组织或器官仍然有很大差别, 但脂质-DNA复合结构在精确调控某种细胞或几种不同类型细胞的组装方面具有巨大潜力, 为调控和研究细胞间相互作用奠定了基础.
3 脂质-DNA复合结构用于分析细胞膜动态
脂质-DNA复合结构可用来测量细胞膜表面某种物质的信号事件. Tan等[65]开发了基于脂质DNA核酸酶的荧光传感器, 用于实时监测细胞外微环境中的金属离子水平. DNA核酸酶是一类能催化某些化学反应的DNA链, 大多数DNA核酸酶的功能可以被不同的金属离子选择性地调节. 脂质修饰的DNA核酸酶探针能够锚定在细胞膜外侧. 当环境中缺乏目标金属离子时, 由于DNA探针是完整的, 荧光基团和猝灭基团接近, 导致荧光保持猝灭的状态. 当加入目标金属离子后, DNA核酸酶迅速将底物寡核苷酸链切割成2个片段, 导致荧光基团与猝灭基团分离, 从而激活荧光信号. 因此, 通过细胞膜表面的荧光信号, 可以检测该区域的金属离子. 考虑到适配体和DNA核酸酶的种类繁多, 可通过类似的脂质-DNA复合结构研究多种分子在细胞微环境中的分布以及细胞转运.
Feng等[66]设计了脂质修饰的DNA鸟嘌呤(G)四联体传感器, 用作测量细胞膜中信号分子的比率型探针[图3(A)]. 根据设计, 能与目标特异性结合的有机辅因子可以通过疏水相互作用嵌入到G四联体层中. 辅因子与DNA末端荧光基团之间的共振能量转移(FRET)信号可用于检测特定目标. 特定目标与其辅因子之间的化学反应将导致FRET信号的变化. 基于上述原理, 构建了用于二氧化硫衍生物和一氧化氮的传感器, 可精准和快速检测细胞膜微环境中的这些信号分子.
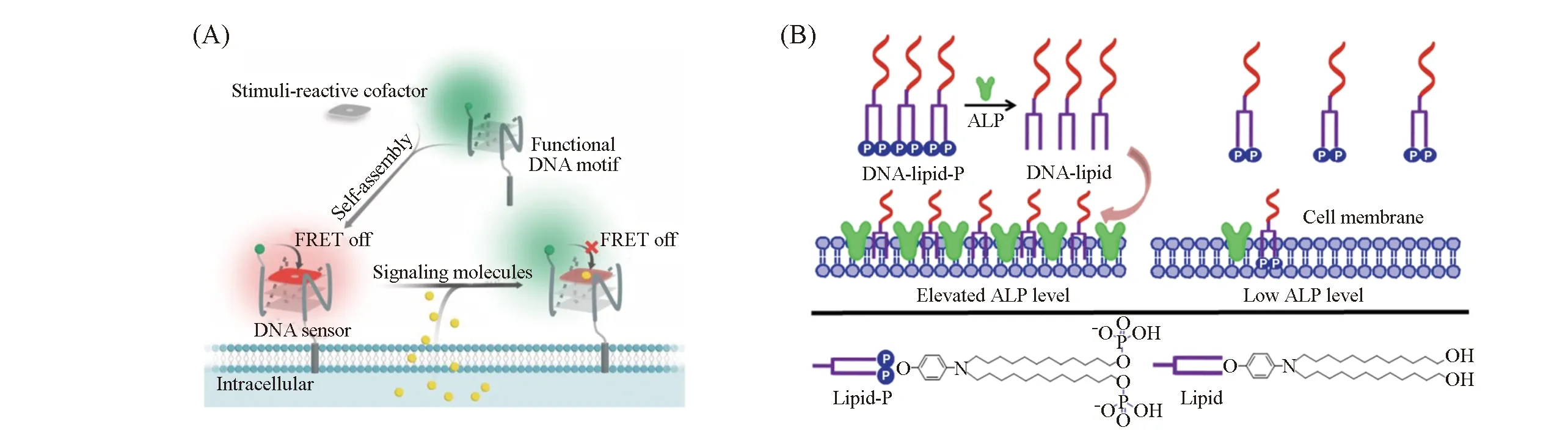
Fig.3 Lipid-DNA conjugates for cell membrane analysis(A) Probing signaling molecules in the cellular membrane microenvironment[66], copyright 2019, Wiley-VCH; (B) phosphorylated lipid-DNA selectively anchors on cell membranes with high alkaline phosphatase expression[67], copyright 2019, Springer Nature.
脂质-DNA复合结构已成为构建锚定细胞膜的核酸探针的强有力手段. 然而, 在实践中传统的脂质-DNA复合体不能区分不同组分的细胞膜. Tan等[67]报道了磷酸化的脂质-DNA复合体用于碱性磷酸酶(ALP)依赖性细胞膜黏附[图3(B)]. 在缺乏ALP的情况下, 复合体与细胞膜的相互作用较弱; 而在ALP高表达时, 磷酸化的脂质通过去磷酸化作用使疏水性增强, 从而能够与细胞相互作用. 该设计增强了脂质锚定对细胞膜的选择性, 对优化脂质-DNA复合型探针有重要的指导作用.
脂质-DNA复合结构还可以用于研究细胞膜组分, 包括脂质和蛋白质之间的生物物理相互作用. 细胞膜上发生的信号转导, 是通过蛋白质和脂质之间的相互作用介导的. 脂质介导的膜信号在炎症、 癌症、 代谢、 心血管和退行性疾病中均发挥着重要作用[68]. Aksimentiev等[69]设计了基于DNA的合成酶, 该结构插入生物膜后导致生物膜的脂分子以107个/秒的速度翻转, 比生物酶催化的脂质转运速率高出3个数量级. 此外, 该研究还证明了DNA合成酶可以控制人类细胞膜的组成, 这为调控膜相互作用的DNA系统在医学上的应用开辟了新途径.
然而, 细胞膜上脂质或者脂蛋白之间相互作用的时间尺度通常在微秒或者毫秒级范围内. 因此, 如何直接对这些短暂的膜脂蛋白或脂质间的相互作用进行成像面临着巨大挑战[70,71]. FRET成像被广泛用于直接测定膜-蛋白质相互作用的研究中. 然而, 在细胞膜脂质-脂质或者脂质-蛋白质相互作用的研究过程中, 无法检测到足够的FRET信号. 超分辨显微镜和单分子追踪技术也被用于研究单个脂质或蛋白质分子间的相互作用. 然而, 这些方法能提供的关于膜组分动态相互作用的信息相当有限[4].
利用脂质-DNA复合结构, Bian等[72]严格控制2层磷脂分子层之间的距离, 研究了脂质在磷脂膜间穿梭的最小距离. 此外, Tan等[73]开发了一种能监测活细胞膜上脂质瞬时相互作用的方法. 利用立足点(Toehold)介导的DNA链置换反应, 诱导DNA探针(W)从锚定DNA链S2转移到锚定DNA链S1. 链置换反应的速率与2条锚定链在膜上相互作用的速率成正比. 将锚定DNA链S1和S2与目标脂质相结合, 就能通过DNA探针监测细胞膜链置换反应的方法, 来量化膜脂质相互作用的速率. 为了监测膜上DNA链置换反应, 作者用荧光基团标记了DNA探针(W), 用猝灭基团标记了锚定链S1. 根据时间依赖性的细胞膜荧光信号的变化, 可以推算出膜脂质相互作用的速率. 利用荧光显微镜或流式细胞仪, 通过这些DNA探针检测不同的信号事件, 可以研究各种膜成分相互作用的关系.
总之, DNA链与天然细胞膜脂质结合所形成的脂质-DNA复合结构可以极大地促进人们对健康或疾病模型中细胞膜结构和功能的认知. 细胞膜组分的相互作用与细胞的许多功能相关, 包括T细胞和B细胞信号通路的激活[74]. 事实上, 通过这些脂质-DNA探针, 借助DNA间的相互作用, 可以进一步研究一些重要细胞膜组分间的相互作用, 这是通过其它方法很难完成的. 此外, 对细胞膜表面物质的监控, 对于研究疾病或者肿瘤的发生、 发展等也具有重大意义.
4 脂质-DNA复合结构用于研究细胞膜机械生物学
脂质-DNA复合结构可用于研究细胞膜的形变. 细胞膜的形变对于细胞的内化、 增殖、 分化及迁移等均具有重大意义[75]. 如, 在网格蛋白介导的内吞途径中, 三脚架型的网格蛋白交联导致膜的内陷可引发内吞过程. Schwille等[76]构建了能够重塑脂膜形状的DNA支架[图4(A)]. 这种支架结构基于具有不同平面的2种三维DNA折纸结构, 均能够附着在膜上. 同时添加这2种结构时, 会发生平面多聚现象. DNA折纸单体能横向结合相邻单体, 在脂质体上呈现共定位、 共扩散的性质. 在高表面折纸密度的状态下, 这些结构聚集形成支架, 从而促进了广泛的平面变形. 类似亚基自组装机制, 被认为是引发Bin-Amphiphysin-Rvs(BAR)样区域, 或者其它支架蛋白, 甚至病毒蛋白相关的膜变形的原因. 作者的工作主要集中在模拟生物膜支架蛋白寡聚化驱动膜变形的步骤, 这对支架蛋白的理化性质具有重要意义. 此外, Zhang等[77]通过构建不同形貌的DNA支架, 将脂质膜折叠成任意形状. 通过改变DNA结构, 设计分子形状和尺寸与支架蛋白类似的脂质-DNA复合结构, 将有利于更深入地理解这些重要的细胞膜过程[78].

Fig.4 Lipid-DNA conjugates for studying mechanobiology(A) Lipid modified DNA origami nanoparticles to scaffold and deform lipid membrane [76], copyright 2015, Wiley-VCH; (B) lipid modified DNA-based membrane molecular probes for intercellular tensile forces visualization[95], copyright 2017, American Chemical Society.
脂质-DNA复合结构也可用于研究细胞连接处的生物物理信号转导. 细胞通过各种化学、 电和机械信号, 与其它细胞或者周围环境进行交流. 细胞连接处产生的机械力对许多细胞集体行为有着深远影响, 包括组织扩张、 拉伸、 迁移、 增殖和分化[79~83]. 目前, 在测量细胞和基质之间张力方面已经取得了重大突破, 研究者已经开发出多种测量方法, 包括胶原晶格凝胶[84]、 组织柱[85]、 微柱[86]、 牵引力显微镜[87]和分子力传感器[88~90]. 然而, 对于细胞间张力的研究仍然面临着挑战. 目前, 细胞间张力只能基于细胞基质张力数据[91,92]或使用基于FRET的分子张力探针[93,94]通过数学推导来测量. 从细胞基质张力推导细胞间作用力的方法, 过程复杂且只适用于单层细胞, 并且缺乏连接处配体-受体相互作用的信息. 基于荧光蛋白的FRET传感器通常不敏感, 张力检测范围有限, 与宿主细胞的生物相容性不佳.
基于脂质-DNA复合结构, You等[95]开发了DNA膜张力探针, 用于监测细胞连接处的张力[图4(B)]. 该探针由3条DNA链构建而成: 发夹结构的胆固醇修饰的锚定链、 胆固醇和猝灭基团双修饰的锚定链、 配体和荧光基团双修饰的互补链. 正常情况下, 具有发夹结构的链将荧光基团和猝灭基团拉近, 导致荧光猝灭. 一旦受体-配体结合, 且链上的张力超过DNA发夹的阈值, 发夹结构会被拉开, 荧光基团与猝灭基团分离, 导致荧光信号增强. 这些DNA张力探针被用来研究2种机械力敏感的跨膜蛋白: 整合素蛋白和E-钙黏蛋白. 通过简单地改变探针修饰的配体, 同一个DNA探针可以对由不同配体-受体对介导的细胞间张力进行成像. 当然, 整合素蛋白和E-钙黏蛋白诱导的张力在细胞连接处均可被观察到. 结果表明, 3种整合素介导的边界, 即大表面、 小表面和丝状伪足黏连间的细胞间张力模式有很大不同. 这说明脂质-DNA探针可能有助于研究群体细胞系统中细胞间张力的异质性. 脂质-DNA探针用于细胞间张力研究的优势, 首先体现在DNA探针作用力的阈值可以通过序列和双链的长度进行精确调控[96,97]; 此外, 这些探针功能的实现只需与细胞孵育, 不需要克隆或转染. 并且, 与基因编码的FRET传感器相比, 使用化学荧光基团和猝灭基团显著提高了探针的灵敏度. 通过这些DNA探针, 能可视化和量化二维、 三维细胞间的张力或收缩力. 这些脂质-DNA探针有潜力广泛应用于细胞间机械力的研究.
5 脂质-DNA复合结构用于研究药物递送
两亲性纳米组装体, 如胶束和脂质体, 在实现药物分子的细胞传递中受到了广泛关注. 这些纳米组装体[98]具有体积小、 装载量大、 生物相容性好、 体外和体内稳定性好的特点[99,100]. 近年来, 研究者制备了由单链DNA亲水冠与脂质或聚合物疏水核[101]组成的新型功能性胶束. 根据亲水基团与疏水基团的比例, 这些两亲性分子可以自组装成不同的结构, 如球形或纳米棒状的胶束结构[102]. 这些新型的脂质-DNA复合结构可用于研究药物递送和物质的跨膜运输.
Liu等[27]利用脂质-DNA复合结构, 制备了尺寸分布窄、 结构稳定的球形胶束. 这种胶束结构的临界胶束浓度小于10 nmol/L, 这保证了该胶束结构能够顺利形成. 此外, 该胶束结构还具有良好的细胞穿透性. 该研究组[103]进一步将脂质与胞嘧啶-p-鸟嘌呤(CpG)DNA结合, 证实这种脂质-DNA复合结构能有效锚定在体内细胞的细胞膜上, 从而实现治疗性DNA在肿瘤部位的富集[图5(A)]. 类似的肿瘤治疗策略还可以扩展到其它功能性治疗核酸, 如免疫刺激性RNA、 小干扰RNA(siRNA)或适配体. 该研究组的后续研究[104]表明, 脂质-DNA复合结构可以与小鼠体内的内源性白蛋白紧密结合. 因此, 脂质-DNA复合结构可以作为分子疫苗, 有效地在淋巴细胞附近富集, 使其在增强T细胞启动和肿瘤杀伤性能方面提升30倍.

Fig.5 Lipid-DNA conjugates for cargo deliveries(A) Lipid modified DNA for in vivo cell modification and localized immunotherapy[103], copyright 2011, Wiley-VCH; (B) membrane encapsulation of DNA nanostructures to achieve in vivo stability[37], copyright 2019, American Chemical Society.
Gothelf等[37]和Shih等[105]受病毒的启发构建了膜包被DNA纳米结构, 实现了体内的核酸运输[图5(B)]. 这种纳米结构包含1个DNA纳米八面体内层和1个脂质DNA外层. 这种直接在DNA外组装脂质双层的纳米结构, 可以保护核酸免受体内核酸酶的降解. 此外, 这种由脂质和DNA组成的纳米组装体, 其免疫反应活性降低了2个数量级, 药代动力学稳定性提高了17倍. 上述研究结果表明, 这些体内稳定的脂质-DNA复合结构有可能成为强大的物质递送平台. 同样, 模拟天然的物质递送体系, Sun等[106]构建了表面修饰DNA的脂质体. 利用DNA编码的膜融合策略, 实现了活细胞的胞内蛋白递送. 该方法能规避内吞途径, 使蛋白在细胞质中仍能保持活性.
总之, 脂质-DNA复合结构在作为药物递送和生物成像的平台方面展现出巨大潜力. 这些纳米组装体具有结构可调、 生物稳定性和生物相容性好的特点. 脂质-DNA复合结构的大小和形状可以精确控制, 这是优化药物传递效率的关键特征. 这些脂质DNA纳米组装体可被用作小分子、 蛋白质和核酸在细胞内和体内传递的载体. 脂质-DNA复合结构在血液循环中具有稳定性高、 副作用或免疫反应小的特征. 因此, 该结构作为功能强大的递送载体, 不仅适用于核酸药物, 也可能用于2种或2种以上药物(包括疏水性和亲水性药物)的联合递送.
6 总结与展望
细胞膜不仅具有屏障功能, 还在调节物质转运和信号传导中起到关键作用. 本文综述了脂质-脱氧核糖核酸(DNA)复合结构在膜生理和细胞功能调控方面的研究进展. 受细胞膜中各类脂蛋白的启发, 研究人员构建了具有两亲性的脂质-DNA复合结构. 这种脂质-DNA复合结构在与细胞简单地孵育后, 便展现出独特的细胞膜锚定的特性. 因此, 脂质-DNA复合结构可广泛应用于人工膜通道的构建、 细胞膜上物质变化的检测、 膜组分相互作用的动态分析、 细胞间作用力的研究、 细胞膜形状调控和药物递送等领域. 然而, 对这些脂质-DNA复合结构与细胞膜相互作用的机制仍缺乏系统性的认知. 不同的脂质结构、 疏水性和不饱和程度如何影响结构与细胞膜的相互作用目前尚不明确. 同时, 哪些因素决定这些脂质-DNA复合结构的膜锚定动力学、 效率和持续时间有待进一步研究.
提高脂质-DNA复合物膜锚定的持续性是目前该结构应用于细胞膜研究面临的另一个挑战. 锚定在细胞膜上的脂质-DNA复合物, 大多数会在2~4 h内失效[107]. 这些膜锚定的结构最终会被细胞摄取, 从而失去作为膜探针的功能. 因此, 明确这些摄取过程的机制非常重要. 通过抑制摄取过程, 便能延长这些膜锚定结构在细胞膜上的停留时间. You等[107]研究了一组脂质-DNA探针锚定细胞膜的动态过程. 结果表明, 脂质-DNA探针的膜插入率和脱离率与其疏水性密切相关, 大多数插入细胞膜的探针为单体形式, 而不是聚集物. 该研究还表明, 脂质-DNA探针与膜的脱离有2种形式, 即通过内吞作用进入细胞或直接流出细胞膜进入溶液中. 因此, 当溶液中存在过量的探针或存在胞吞抑制剂时, 探针可以实现对细胞膜的长期修饰, 基于此, 他们首次将脂质DNA探针的膜保留时间提高到24 h以上. 脂质-DNA复合结构在细胞膜表面停留时间的延长, 将对细胞迁移或伤口愈合等生物学现象的研究非常有益.
总之, 脂质-DNA复合结构自首次构建以来, 在较短的时间内便展现出显著的细胞膜研究方面的潜力. 由脂质-DNA复合结构构建的纳米膜孔可以用于研究物质的跨膜转运、 单颗粒追踪等. 锚定在细胞膜表面的脂质-DNA复合结构不仅可以检测某种物质在细胞膜表面的动态变化, 还可以用于研究细胞膜上各种组分的相互作用. 此外, 这些结构在细胞膜的重塑、 药物递送、 细胞团簇的构建方面均有很好应用. 未来几年, 随着DNA纳米技术的不断进步和人类对细胞膜研究的不断深入, 脂质-DNA复合结构在膜生物学研究中将会有更为重要的进展.
