蝴蝶花中2种异黄酮的含量测定及其抗肿瘤活性
2020-07-04杨倩,郑茜,魏静,张春*
杨 倩,郑 茜,魏 静,张 春*
(1.西南医科大学药学院,四川泸州646000; 2.四川卫生康复职业学院药学系,四川自贡643000)
蝴蝶花Iris japonica Thunb.为鸢尾科鸢尾属多年生草本植物.其性味苦、寒,有小毒,具有消肿止痛、清热解毒的功效[1-2],蝴蝶花在民间应用广泛,主治肝炎、肝肿大和胃痛等[3].但对其生药学、质量标准及药效有效成分等研究较少.近年来,研究发现,蝴蝶花主要含异黄酮类化合物[4-5]和三萜类化合物.其中从乙酸乙酯部位分离得到鸢尾黄素与次野鸢尾黄素为其重要成分[6],但对蝴蝶花中鸢尾黄素和次野鸢尾黄素含量的研究未见报道.鸢尾黄素与次野鸢尾黄素具有多种生物活性,目前,对其抗肿瘤活性鲜有研究[7-8].因此,本研究试图建立不同产地蝴蝶花中鸢尾黄素与次野鸢尾黄素HPLC含量测定方法,并对蝴蝶花的不同产地和不同部位进行两种成分的含量测定.同时,采用几种肿瘤细胞株,对其进行活性检测.该结果为蝴蝶花质量标准的建立,及其资源的进一步开发利用奠定基础.
1 材料
Agilent 1260色谱工作仪(安捷伦科技有限公司),MS105DU半微量天平(瑞士梅特勒-托利多集团),Spectra Max M3多功能酶标分析仪(美国Molecular Devices),HERACELL-150i CO2培养箱(Thermo Fisher Scientific),CKX53-SLP 倒置显微镜(日本Olympus公司),TG-17多功能高速离心机(德国 Eppendorf公司),Scientific-80℃冰箱(Thermo Fisher Scientific),Milli-Q 纯水仪(美国Millipore公司),JOYN-10A型超声波清洗仪(上海乔跃电子科技有限公司).
标准品鸢尾黄素(批号:PS161122-01)与次野鸢尾黄素(批号:PS0681-0020)均购自成都普思生物科技股份有限公司,质量分数均>98.0%.蝴蝶花药材均采自四川省不同产地,经西南医科大学税丕先教授鉴定为鸢尾科鸢尾属蝴蝶花的全草.流动相甲醇、乙酸均为色谱纯,其他试剂均为分析纯.DMEM高糖培养基、1640培养基(Hyclone),PAN胎牛血清(德国PAN-Biotech公司),CCK-8试剂盒(日本同仁化学研究所),Hela细胞、Hccc-9810细胞和H460细胞均购自中国科学院细胞库(上海).
2 方法与结果
2.1 蝴蝶花中鸢尾黄素与次野鸢尾黄素的含量测定
2.1.1 色谱条件 色谱柱Diamonsil C18(2)(250 mm × 4.6 mm,5 μm);流速:0.8 mL/min;温度:30 ℃;检测波长:267 nm;进样量:10 μL;流动相 A为甲醇,B为体积分数0.05%乙酸水溶液,梯度洗脱条件为:0~10 min:体积分数 55%A;10~20 min:体积分数55% ~57%A;20 ~30 min:体积分数57%~60%A.
2.1.2 对照品溶液的配制 精密称取减压干燥至恒重的鸢尾黄素和次野鸢尾黄素对照品适量,置于棕色量瓶中,甲醇溶解,配制成质量浓度0.20 g/L的鸢尾黄素溶液与质量浓度0.25 g/L的次野鸢尾黄素溶液.
2.1.3 供试品溶液的配制 蝴蝶花根茎及叶部位放于减压干燥箱中,60℃减压干燥2 h.精密称取1.0 g蝴蝶花根茎、叶粉末(过100目筛),置于具塞磨口瓶内,加入甲醇50 mL,超声60 min;趁热过滤收集滤液,用甲醇定容至50 mL容量瓶中,即得供试品溶液.
2.1.4 系统适应性实验 分别精密吸取“2.1.2”和“2.1.3”项下制备的对照品和供试品溶液各10 μL,按“2.1.1”项下色谱条件进行测定,色谱图见图1.对照品鸢尾黄素色谱峰的保留时间为15.167 min,次野鸢尾黄素色谱峰的保留时间为27.395 min.确认根茎样品和叶样品中鸢尾黄素和次野鸢尾黄素的保留时间与对照品溶液一致,分离度均大于1.5,理论塔板数均不低于10 000,溶剂空白无干扰.
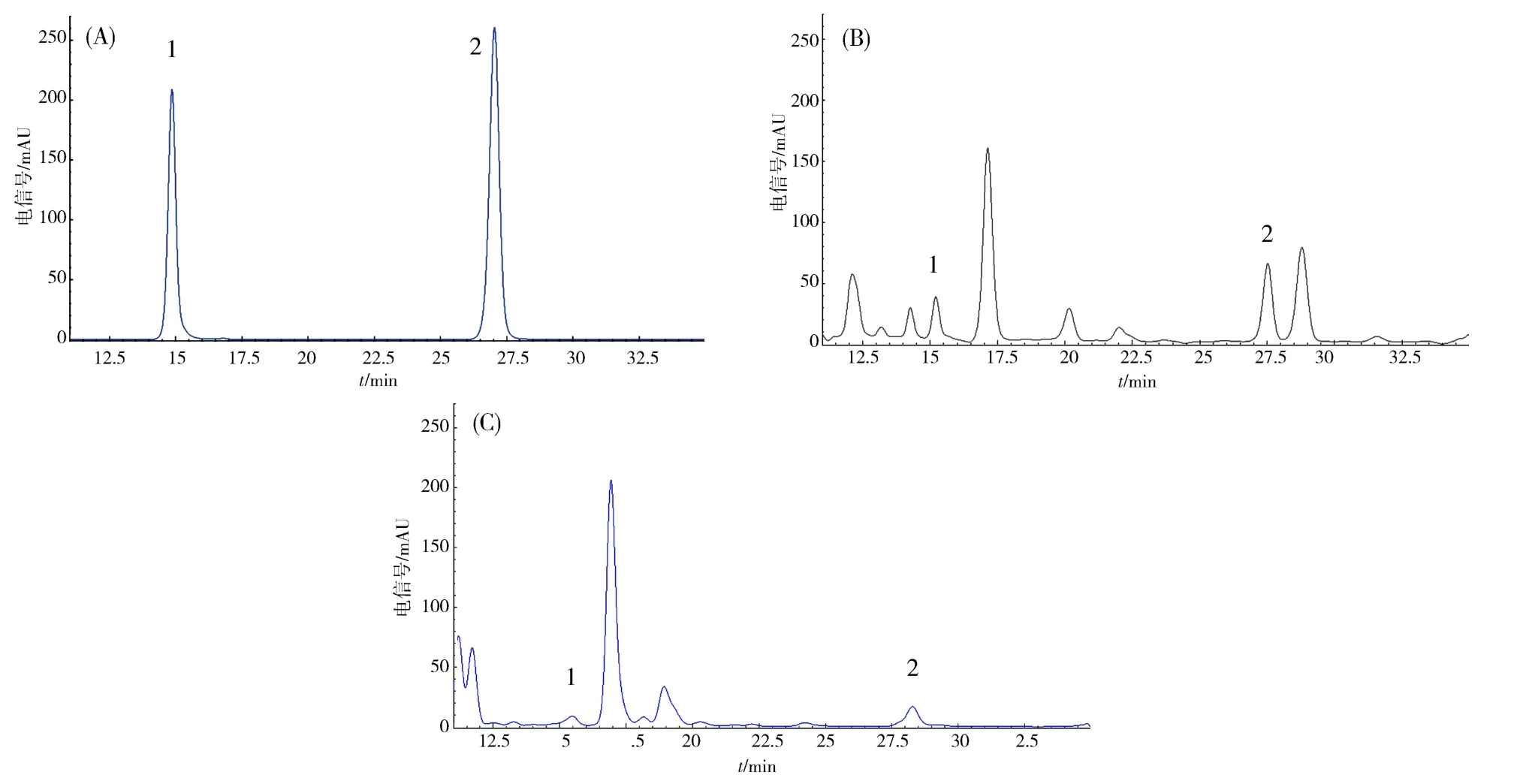
图1 对照品(A)与根茎样品(B)、叶样品(C)的HPLC图Fig.1 HPLC chromatograms of authentic standards sample(A),sample of rhizoma(B)and sample of leaf(C)
2.1.5 线性关系 分别精准量取鸢尾黄素溶液0.025、0.125、0.25、2.50、5.00 mL,次野鸢尾黄素溶液0.10、0.20、2.00、4.00 mL 置于10 mL 的量瓶中,用甲醇稀释至刻度线,按上述色谱条件进行测定.以对照品质量浓度为横坐标(mg/mL),峰面积为纵坐标绘制标准曲线,其回归方程分别为:鸢尾黄素:y=43 592x+16.611(r=0.999 6),线性范围为0.5~100 mg/L;次野鸢尾黄素:y=47 574x+40.349(r=0.999 9),线性范围为2.5~250 mg/L.
2.1.6 重复性实验 取泸州蝴蝶花根茎粉末6份按“2.1.3”项的条件制备供试品,按以上色谱条件进样,测定峰面积,计算鸢尾黄素、次野鸢尾黄素的RSD%分别为1.15%、0.94%.
2.1.7 稳定性实验 精密吸取供试液,分别在0、2、4、6、8、10、12 h 按以上色谱条件进样检测.鸢尾黄素、次野鸢尾黄素峰面积的 RSD%分别为0.96%、0.52%.
2.1.8 精密度实验 取鸢尾黄素与次野鸢尾黄素混合对照品溶液按以上色谱条件连续进样6次,鸢尾黄素、次野鸢尾黄素峰面积的RSD%分别为1.47%、0.75%.
2.1.9 加样回收实验 精密吸取已知鸢尾黄素与次野鸢尾黄素含量的蝴蝶花供试品9份,分别按已知质量分数的50%、100%、150%共3个水平加入对照品鸢尾黄素与次野鸢尾黄素,按“2.1.3”项方法制备,按以上条件进样10 μL测定,计算平均回收率,结果如表1,鸢尾黄素与次野鸢尾黄素的平均回收率分别为99.96%、100.24%;RSD%分别为2.01%、1.49%.
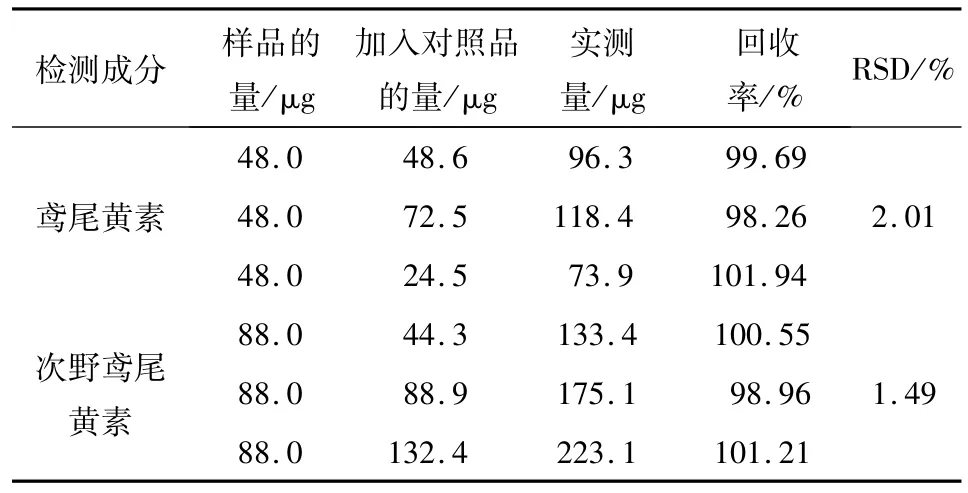
表1 加样回收实验Tab.1 Results of the recovery tests
2.1.10 样品含量测定 精密称取不同产地蝴蝶花药材根茎与叶部位粉末,按“2.1.3”项方法制备供试品溶液,测定样品含量,结果见表2.
2.2 体外抗肿瘤活性研究
2.2.1 细胞培养 人宫颈癌细胞Hela、人大细胞肺癌细胞H460分别培养于含有质量分数10%胎牛血清的RPMI培养液中,人肝内胆管癌细胞Hccc-9810培养于含有10%胎牛血清的高糖DMEM培养液中.3种细胞均放于37℃体积分数5%的CO2培养箱中常规培养.
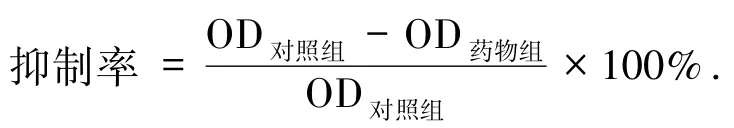
2.2.2 CCK-8实验 精密称取一定量的鸢尾黄素与次野鸢尾黄素,加入少量二甲基亚砜充分溶解后,再加入适量培养基制备成浓度10 mol/L的母液.取对数生长期细胞并调整细胞悬液密度为5×104个/mL,以每孔100 μL细胞悬液接种于96孔板,于37℃体积分数5%的CO2中常规培养24 h[7].待细胞贴壁后加入一定浓度的待测药物(阳性对照组加入一定浓度的五氟尿嘧啶,阴性对照组加入质量分数0.1%的DMSO的培养基)与细胞共孵育48 h后,吸出培养基,每孔加入质量分数10%的CCK-8 100 μL置于培养箱中继续孵育30 min,酶标仪450 nm处测定各孔光密度OD值.按下述公式计算各组抑制率为:
2.2.3 统计分析 所有数据资料均用SPSS 20.0统计软件分析,用one-way ANOVA进行处理,各组数据资料用š±s表示,以P<0.05表示差异有统计学意义.
2.2.4 结果 不同浓度的鸢尾黄素和次野鸢尾黄素对Hela细胞、Hccc-9810细胞和H460细胞的生长均能产生不同程度抑制作用,其抑制作用随药物浓度的增加而增加,其中鸢尾黄素对Hela细胞的抑制率最大,如图2和3所示.鸢尾黄素对Hela细胞的生长抑制的IC50值为(49.24±1.11)μmol/L,与阳性对照五氟尿嘧啶的IC50值(23.72±1.24)比较接近,表明鸢尾黄素对Hela细胞具有很好的抗增值抑制作用.鸢尾黄素对H460细胞的IC50值为(308.4 ±1.29)μmol/L、对 Hccc-9810 细胞的IC50>360 μmol/L,其 IC50值均远大于阳性对照的结果.次野鸢尾黄对Hela细胞生长抑制的IC50为(146.9 ±1.23)μmol/L,对其他细胞的 IC50>360 μmol/L,见表 3.
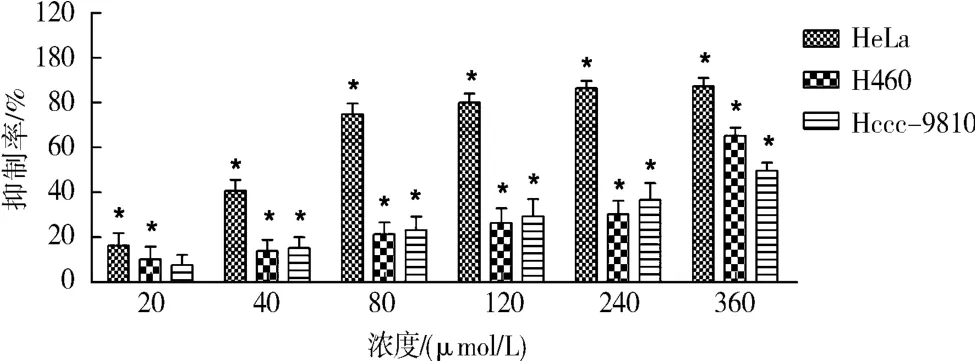
图2 不同浓度的鸢尾黄素对Hela、Hccc-9810、H460细胞的抑制率Fig.2 Inhibition rate of different concentrations of tectorigenin on Hela,Hccc-9810 and H460 cells
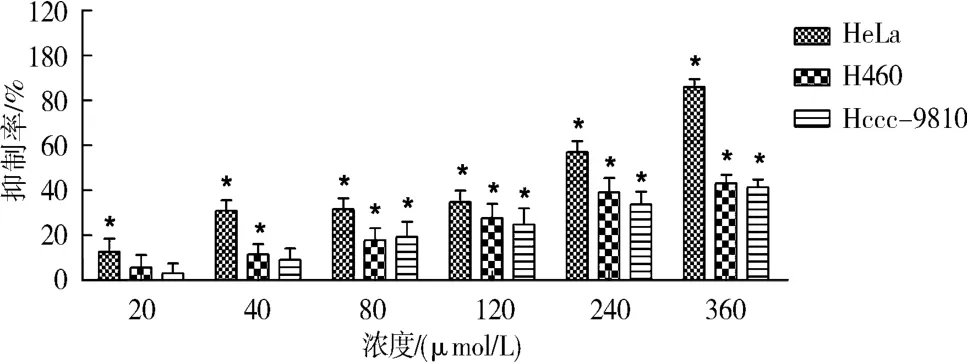
图3 不同浓度的次野鸢尾黄素对Hela、Hccc-9810、H460细胞的抑制率Fig.3 Inhibition rate of different concentrations of irisflorentin on Hela,Hccc-9810 and H460 cells
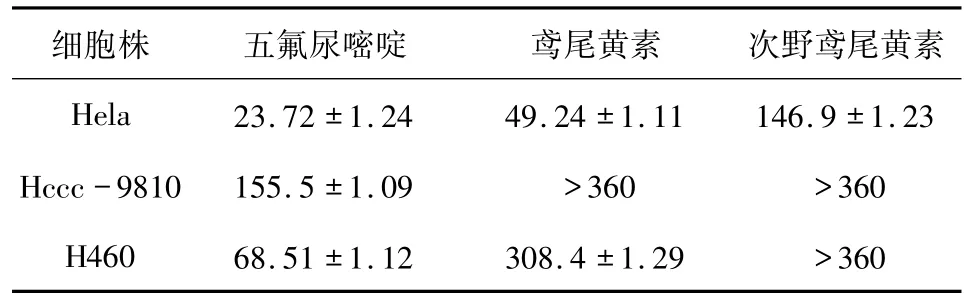
表3 不同浓度的五氟尿嘧啶、鸢尾黄素和次野鸢尾黄素对3种细胞的IC50Tab.3 IC50values of different concentrations of pentafluorouracil,tectorigenin and irisflorentin on three kinds of cells μmol/L
3 讨论
前人采用HPLC法,以乙腈-磷酸水作为流动相,对射干及川射干中鸢尾黄素与次野鸢尾黄素进行含量测定[9-10],但未见对蝴蝶花中该成分含量测定的报道.张金专等[11]采用乙腈-磷酸水作为流动相,建立了中药蝴蝶花高效液相指纹图谱,但该法仅分离出3个峰型较好的峰.本文首次采用HPLC法对蝴蝶花进行鸢尾黄素与次野鸢尾黄素含量测定,采用甲醇-水作为流动相,能分离出6个峰型较好的峰,分离度远好于采用乙腈-磷酸水作为流动相的结果,且从环境与经济而言,甲醇优于乙腈.从方法学考察各项指标可看出,本文此方法专属性强、准确度高、重复性好,可用于蝴蝶花中这两种异黄酮成分的含量测定,为蝴蝶花质量标准的制定,奠定了实验基础.由表2可看出,不同产地蝴蝶花中鸢尾黄素和次野鸢尾黄素含量差异较大,次野鸢尾黄素在广元和达州分布的材料根中含量甚少(<2.5 μg).鸢尾黄素在达州市蝴蝶花的叶中含量最高,次野鸢尾黄素在泸州蝴蝶花的叶中含量最高.该结果说明,鸢尾黄素和次野鸢尾黄素在蝴蝶花中含量多少,受其产地、环境因素影响较大.此外,在同一植株不同部位,二者含量也有较大差异,表明这两种异黄酮成分存在明显的组织特异性.
前人已报道鸢尾黄素对HepG2、Caski肿瘤细胞的抗增殖活性[8],其能上调人宫颈癌Caski细胞Bax蛋白、下调bcl-2蛋白的表达进而诱导Caski细胞凋亡;次野鸢尾黄素能明显抑制MDA-MB-231肿瘤细胞的生长[7].本实验考察鸢尾黄素与次野鸢尾黄素对Hela、H460、Hccc-9810细胞株的抗增殖活性.结果显示,鸢尾黄素对Hela细胞的抗增值效果最好,其 IC50值为49 μmol/L,但对于 Hccc-9810和H460细胞株则没有明显的抑制作用.次野鸢尾黄素对3种肿瘤细胞株的抑制效果均不理想.因此,结合前人研究结果可知,鸢尾黄素和次野鸢尾黄素对肿瘤细胞的抑制作用,仅限于少数几种肿瘤细胞,其确切的抑制作用机理有待于进一步深入研究.
