去甲肾上腺素对SNI 大鼠背根神经节神经元及其传入纤维兴奋性的影响*
2020-07-04徐江涛
纪 运 徐江涛 靳 天 杨 杰 马 柯
(1 上海交通大学医学院附属新华医院疼痛科,上海 200082;2 暨南大学医学院生理学系,广州 510632)
神经病理性疼痛(neuropathic pain, NP)是一种发病机制复杂的常见神经系统顽疾[1]。此前的动物实验和临床试验研究均表明交感神经系统参与了神经病理性疼痛的调控,经交感神经干预后能够缓解其他诸多治疗手段效果不佳的NP,然而,交感神经如何影响NP 的发展其机制目前尚不清楚[2]。神经生理学证据表明,背根神经节(dorsal root ganglion, DRG)内的交感神经纤维仅与DRG 血管存在联系,而并不会与感觉神经元之间形成结构和功能上的关联[3]。McLachlan 等[4]首次于坐骨神经横断模型中发现DRG 内的交感神经轴突末梢出芽增生,并包绕感觉神经元(尤其是大、中直径神经元),形成所谓“篮状结构(basket structure)”。此后,这种交感末梢形态的改变被发现于多种神经病理性疼痛相关的动物模型[5,6],而“交感-感觉偶联” 功能方面的电生理研究仍有局限,NE 对DRG 神经元的作用目前尚存很大争议[7]。尤其是疼痛发生后,关于交感神经递质去甲肾上腺素(norepinephrine, NE)对于感觉传入系统的调控作用研究依然仅局限于离体条件,尚无采用在体电生理技术进行实验探究的研究报道[8,9],基于以上,本研究拟采用大鼠保留性坐骨神经损伤(spared nerve injury, SNI)模型,应用在体脊髓场电位记录技术研究NE 对SNI 模型 (sprague-dawley, SD)大鼠疼痛相关A 纤维和C 纤维传入信号的调控;并采用离体神经元全细胞膜片钳记录技术,研究NE 对离体急性分离的DRG 大、中、小直径神经元兴奋性的影响,为解决NP 这一临床难题探寻治疗依据,同时为相关基础研究提供崭新的研究技术。
方 法
1. SNI 模型动物的制备和疼痛行为学监测
本研究在体实验所使用的实验动物为清洁级雄性SD 大鼠,体重150~180 g;离体实验所使用的实验动物为SPF 级雄性SD 大鼠,体重60~80 g。以上动物由中山大学医学院动物中心提供,使用许可证号为SCXK(粤)2016-0029,本研究所有动物实验研究方案均经伦理委员会审核通过,符合动物实验伦理规范和实验动物福利要求。将40 只雄性大鼠随机平均分为8 组,每组5 只。 NE 干预(SNI + NE)组、手术对照(SNI + Vehicle)组、去甲肾上腺素干预假手术(Sham + NE) 组、假手术对照(Sham + Vehicle)组,每组再随机均分为C 纤维记录组与A 纤维记录组。按前述将30 只雄性大鼠随机平均分组。采用全细胞膜片钳技术研究100 μM NE灌流对离体打散的手术侧L4、L5DRG 大、中、小直径神经元诱发动作电位基强度(current threshold, CT)和两倍基强度诱发动作电位次数(No. of APS at 2×rheobase)的作用。
SNI 术前,使用10%水合氯醛0.4 ml/100 g 体重行腹腔注射麻醉,剃除大鼠左膝至左臀部的手术区被毛,使用胶带将左后肢固定在平台面,于大鼠左侧后肢上缘切开大约1 cm 的纵向切口并钝性分离肌肉暴露坐骨神经主干,使用镊子与玻璃分针钝性分离坐骨神经三个分支:胫神经、腓总神经和腓肠神经。SNI 手术组动物,采用5-0 丝线结扎并剪断胫神经和腓总神经,剪断移除结扎远端2~4 mm。依次缝合肌肉、皮肤,消毒。Sham 组仅暴露术侧坐骨神经及其分支,不予结扎及切断,其余同SNI 组。术后7 天内von Frey 探针采用up-down 法测定大鼠术侧下肢的50%缩足阈值, 此机械痛阈明显降低并维持稳定即视为SNI 造模成功[10]。
2.在体脊髓背角场电位记录
各组实验SD 大鼠,于造模术后第14 天,采用20%乌拉坦按照0.6~0.8 ml/100 g 大鼠体重行腹腔注射麻醉。麻醉完全后,切开皮肤、暴露气管、插管固定。暴露手术侧L4、L5DRG 后,沿脊柱两侧分离肌肉并钳除脊柱正背面的节段椎骨以暴露脊髓。用尖镊小心去除脊膜,暴露大鼠左侧下肢坐骨神经干,大鼠整体固定于专用在体电生理记录装置(见图1)。用36~37℃的液体石蜡覆盖暴露的坐骨神经组织。用2%~3% 的温热琼脂覆盖暴露的脊髓及DRG 表面,待其凝固后构筑给药微池。使用PP-830 电极拉制仪将BJ-40 玻璃管拉制为玻璃电极,内充0.5 M/L 乙酸钠,将铂金丝记录电极插入其内,并在立体定位下固定于对应部位脊髓背角表面。刺激电极后接神经电刺激仪,并钩挂坐骨神经干。通过微池给予L4、L5DRG 100 μM NE[11]或Vehicle(生理盐水)后,按照C 纤维与A 纤维的不同刺激指标(A 纤维:持续时间0.5 ms;C 纤维:持续时间0.1 ms),给予坐骨神经干方波电刺激,刺激间隔均为1 min。同时使用SEFP 记录系统自动采集脊髓背角A 纤维与C 纤维诱发的SEFP[12]。
3. DRG 神经元急性打散、离体培养与全细胞膜片钳记录
SNI 手术后第14 天手术取DRG。CO2麻醉后,处死大鼠,迅速取出胸腰段脊椎,并移至无菌操作台中取出左侧L4、L5段DRG,剪碎DRG 后转入含0.4 mg/ml 胰蛋白酶和0.6 mg/ml 胶原酶的DMEM/F12 (GIBCO, USA)培养液中,于37℃恒温摇床振荡消化30 min。消化结束后加入含血清的完全培养基5 ml,离心5 min。随后使用巴斯德吸管急性打散DRG 神经元,并种植于多聚赖氨酸包被的盖玻片,CO2培养箱培养4 h 后,进行全细胞膜片钳记录[13]。
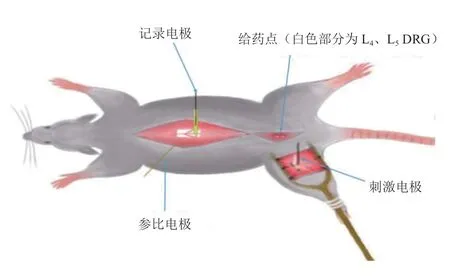
图1 在体电生理记录与给药示意图Fig. 1 Schematic diagram of electrophysiological recording and administration
记录电极由P-87 电极拉制仪(sutter instruments, novato, CA)二步拉制,阻抗为 1~3 MΩ。在全细胞电压钳模式下封接细胞,封接电阻大于1 GΩ。记录用细胞外液配方为(mM):150 NaCl, 5 KCl, 2.5 CaCl2, 1 MgCl2, 10 HEPES-NaOH, 10 D-glucose,渗透压为330~340 mOsm,用NaOH 将pH 值调至7.4。细胞内液配方为(mM):137 K-gluconate,11 EGTA, 10 HEPES-KOH, 2 Mg-ATP, 0.3 Na-GTP,内液渗透压为310~320 mOsm,用 KOH 调节pH值至7.2[8]。
采用 EPC-10 膜片钳放大器(德国HEKA 公司)和Pluse 8.0 软件(德国HEKA 公司)进行刺激以及电生理数据采集。以电压钳模式完成封接, 后转用电流钳模式进行记录。选择35 μm~75 μm 直径大小的神经元进行全细胞膜片钳记录。给神经元一段时程为200 ms 的去极化递增电流(0 pA~400 pA,每次增加50 pA)测量诱发动作电位的电流阈值(CT),之后给予500 ms 两倍CT 的刺激电流,诱发动作电位,并记录诱发动作电位的次数。其中,封接电阻低于1 GΩ 的神经元、静息电位高于-40 mV 的神经元以及电生理记录时电位衰减明显的神经元直接舍弃。
按照预先分组,使用细胞外液稀释NE 至100 μM浓度[8],或细胞外液稀释等量生理盐水Vehicle,通过灌流系统持续给予3 min。再次记录神经元的CT与两倍CT 诱发动作电位。
4.统计学分析
采用GraphPad Prism 7.0 统计软件进行统计学分析,实验结果以均数±标准误(x±SEM)来表示, 组间数据采用单因素方差分析, 组内数据采用配对t 检验。P < 0.05 为差异有统计学意义,统计作图由 Origin 6.0 及GraphPad Prism 7.0 软件完成。
结 果
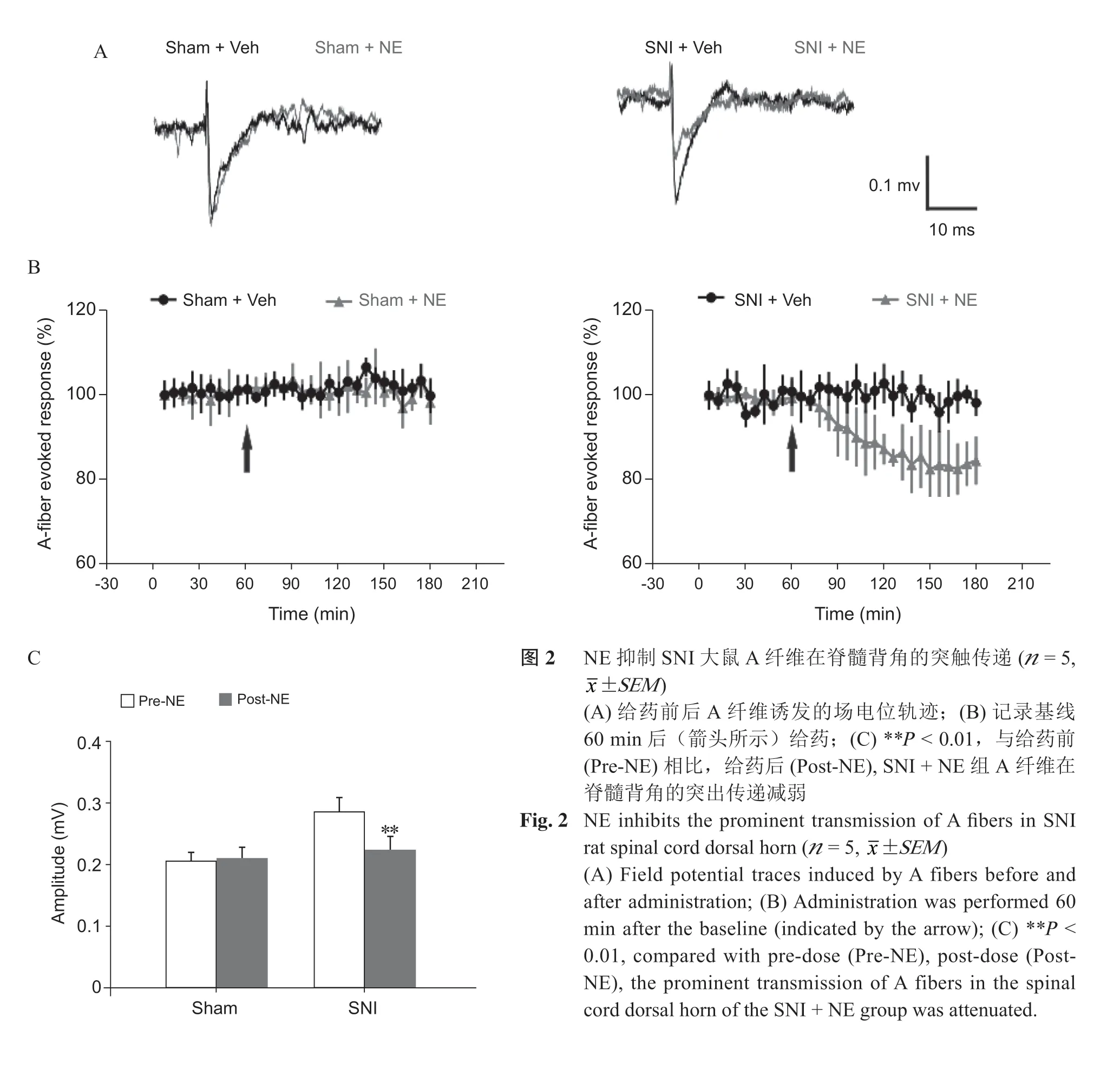
1. NE 抑制SNI 大鼠A 纤维在脊髓背角的突触传递
电刺激(0.6~0.8 V)坐骨神经诱发A 纤维活动,基线稳定记录1 h 后,在已暴露的DRG 表面给予100 μM NE 干预,记录方法及给药方式见图1,SNI + NE 组与SNI + Vehicle 组相比,NE 能显著抑制受损A 纤维在脊髓背角诱发的场电位,给药前后抑制效应有统计学差异(P < 0.01,见图2)。Sham + NE 组,给药前后A 纤维诱发的场电位变化无统计学差异(P > 0.05,见图3)。
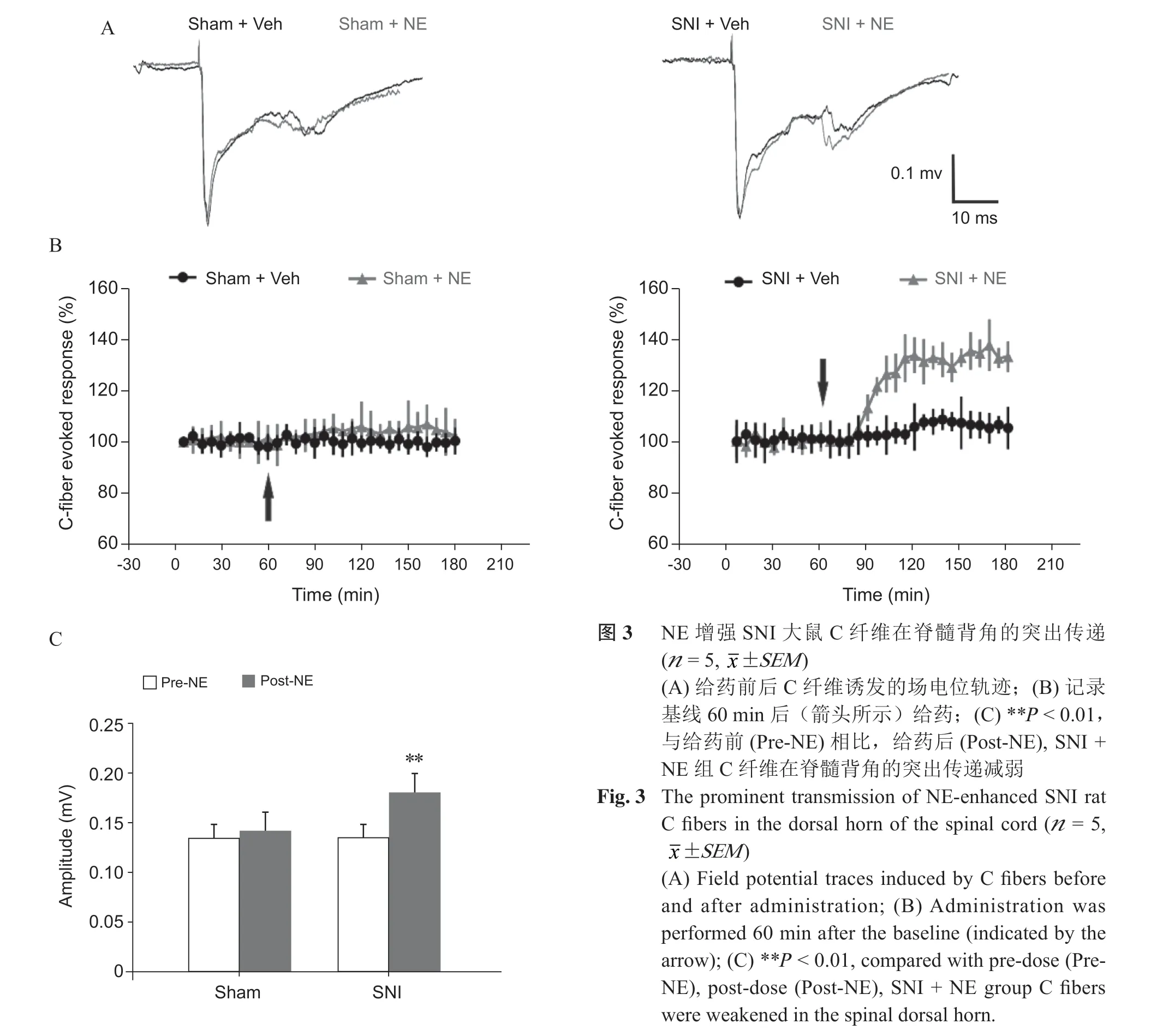
2. NE 增强SNI 大鼠C 纤维在脊髓背角的突触传递
电刺激(10~15 V)坐骨神经诱发C 纤维活动,基线稳定记录1 h 后,在已暴露的DRG 表面给予100 μM NE 干预,SNI + NE 组与SNI + Vehicle 组相比,给药10 min 后,NE 干预可增强受损C 纤维在脊髓背角诱发的场电位,差异有统计学差异(P < 0.01,见图3),Sham + NE 组,给药前后C 纤维诱发的场电位变化无统计学差异(P > 0.05,见图3)。
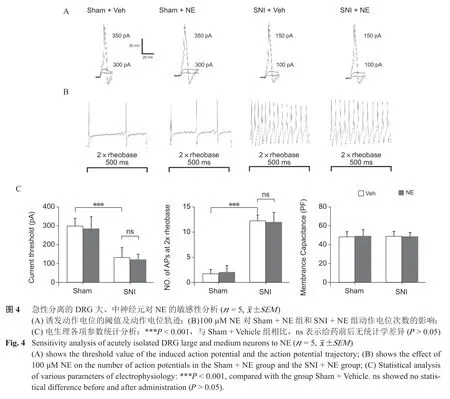
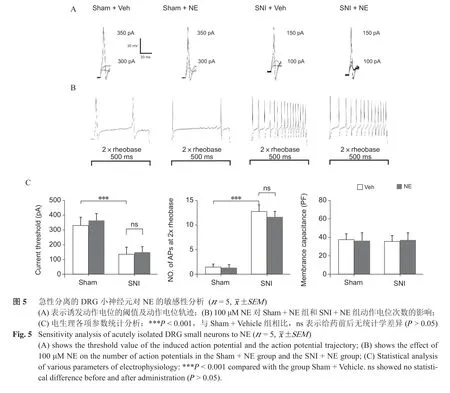
3. 急性分离的DRG 神经元对NE 的敏感性分析
(1)检测术后第14 天,Sham + Vehicle 组DRG大、中、小神经元(n = 15,神经元数)、SNI + Vehicle 组DRG 神经元(n = 15)诱发动作电位的CT 和两倍基强度诱发动作电位次数(No. of APS at 2×rheobase),SNI + Vehicle 组DRG 神经元的CT较Sham + Vehicle 组低(P < 0.001,见图4、5)、诱发的动作电位次数多于Sham + Vehicle 组(P < 0.001,见图4)。
(2)给予100 μM NE 后,Sham + NE 组DRG神经元(n = 15)、SNI + NE 组(n = 15))DRG 神经元在两倍基强度刺激下产生的动作电位次数与给药前相比无统计学差异(P < 0.001,见图4、5)。
讨 论
尽管NE 在神经病理性疼痛模型大鼠中的电生理作用已有文献报道,但研究方法仅局限于离体状态下的单细胞或单纤维电生理记录[9,14],并未进行在体研究观察NE 对DRG 神经元电生理活动的影响,不能全面的研究NE 对神经病理性模型SD 大鼠DRG 神经元及其传入纤维兴奋性的作用,导致NE 在疼痛传导中的“功能”研究目前尚存很大争议。基于此,我们设计了本实验方案以明确NE 对DRG神经元生物电活动的影响。
本研究通过在体研究发现NE 干预DRG 可以改变SNI 术后A 纤维和C 纤维兴奋在脊髓背角诱发的场电位变化。DRG 给予100 μM NE 后,SNI大鼠A 纤维在脊髓背角诱发的场电位明显降低,SNI 大鼠C 纤维在脊髓背角,诱发的场电位幅度增大。这表明,在大鼠发生外周神经损伤后,损伤相应部位传入神经所对应的DRG 内的NE 可以参与痛觉传入信号的调控。为了进一步验证NE 是否直接影响DRG 内的大、中、小直径神经元兴奋性改变信号传入,我们进行了离体膜片钳实验。研究发现, SNI 术后大鼠的DRG 大、中、小直径神经元与Sham 手术组大鼠相比更易诱发动作电位。但给予NE 灌流后,SNI 大鼠和行Sham 手术大鼠的大、中、小直径神经元的兴奋性与给药前相比均未发生明显改变。可见,SNI 术后,NE 不会直接影响急性打散的DRG 大、中、小直径神经元的兴奋性。综合以上在体和离体研究,可得到以下结论:SNI模型大鼠DRG 中的NE 参与痛觉传入信号的调控,但其调控机制不是通过直接影响DRG 大、中、小直径神经元的兴奋性。
NE 是最主要的交感神经突触递质。已有大量研究报道神经病理性疼痛相关的交感神经轴突在DRG 内异常增生以及包绕DRG 内大、中神经元并形成“篮状结构”[15]。这种结构被发现于啮齿类的坐骨神经横断模型、脊神经结扎(spinal nerve ligation, SNL)模型、坐骨神经慢性压迫损伤(chronic constriction injury, CCI)模型以及慢性神经病理性疼痛病人的DRG。Chung 等[16]电镜研究发现,异常增生的交感神经轴突末梢入侵到 DRG 大、中直径神经元与卫星胶质细胞附近,形成类似突触前曲张体的膨大结构,这些曲张体内含大、小致密物质囊泡。以上形态学证据表明,交感神经轴突及其释放的NE 可能参与神经病理性疼痛的病理过程。
NE 在DRG 内的功能方面的研究也有相当的进展。之前Michaelis 等[17]研究报道,神经损伤发生后会产生“交感-感觉偶联”,A 纤维与C 纤维对应的DRG 传入信号对NE 的不同反应模式,可能最终导致在疼痛的不同阶段,交感神经对疼痛的调控作用的改变。Xie[9]等的完整DRG 离体电生理研究表明,电刺激内含交感神经的脊神经背支可以增加大、中直径DRG 神经元的放电频率,该研究的局限在于,不能直接说明DRG 内的交感神经是通过NE的作用增加DRG 神经元的兴奋性,我们的在体研究通过直接应用NE 作用于DRG,并在脊髓进行场电记录,直接验证了NE 的作用。Abdulla[8]通过全细胞膜片钳记录,急性打散神经损伤对应DRG 神经元,NE 通过抑制N 型Ca2+通道的电流,阻断神经元K+外流,从而增加了小直径神经元的兴奋性,对大、中直径神经元兴奋性几乎无影响。Petersen 等[14]的研究表明神经损伤相关的小直径神经元胞体部位细胞膜电生理特性的改变使其对NE 的反应性增加。
与上述电生理研究结果不同,本研究的离体研究表明,100 μM NE 并不会直接影响急性分离的大、中、小神经元的兴奋性。之所以研究结果存在差异,可能是由于本实验主要记录的电生理参数为CT 和两倍基强度诱发的动作电位频率,无法记录DRG神经元的去极化电流,NE 可能会刺激DRG 神经元胞体产生去极化电流,但其去极化程度并未达到产生动作电位所需的阈电位,故给药后未发现动作电位个数有所改变。另外在急性分离的过程中,由于酶和机械力的作用, 使细胞表面的受体遭到破坏,降低了肾上腺素能受体对NE 的结合能力,同时因为消化了DRG 神经元的轴、树突及具有营养支持作用的星形胶质细胞等,而使得细胞失去从周围环境获取信息的能力。研究表明[18],神经损伤激活的星形胶质细胞所产生NGF 能显著增加DRG 神经元对NE 的敏感性。此外,交感纤维末梢及星形胶质细胞释放的ATP 与NE 具有协同作用,而ATP 可通过激活DRG 神经元上的P2Y1 受体下调P2X3 受体的表达进而抑制神经元的兴奋性[19]。因此认为NE对DRG 的作用需要其他神经递质参与调节,进而也解释了为什么本研究中相同浓度的NE 在在体实验与离体实验会出现结果不一致的现象。
本研究发现活体状态下,NE 对DRG 内A、C类纤维具有完全相反的生物效应。有分子生物学研究表明[20],SNI 及SNL 术后,肾上腺素α2 受体在大、中神经元的表达量明显上调,结合在体电生理结果推测,在神经病理性疼痛模型中,NE 可通过作用于DRG 大、中神经元上调的肾上腺素α2 受体抑制其功能,抑制了粗纤维对后角II 层的胶质细胞(SG细胞)的兴奋作用,使该细胞释放抑制性递质减少,从而增强了外周细纤维向T 细胞传导冲动,导致闸门开放 ,进而参与调节SNI 诱导的痛觉过敏[21]。
本研究应用全细胞膜片钳技术和在体电生理技术,能较为全面的研究NE 对 SNI 大鼠DRG 神经元及其传入纤维兴奋性的影响,并对功能机制方面进行了深入探讨,通过DRG 局部给予外源性药物,特异地阐明了NE 及大、中、小神经元在“交感-感觉偶联”中所扮演的角色。但本研究存在以下局限:未对α2 受体的分布和相关信号通路进行进一步研究,以阐释其对各类型神经元的分子生物学作用机制;在体电生理脊髓场电记录的是相应感觉传入纤维在脊髓投射区域的整体电活动,而不能精确到单个神经元的电生理改变,本研究主要记录的电生理参数为基强度和两倍基强度诱发的动作电位频率,无法记录阈下刺激的去极化电流。
综上所述,本研究表明去甲肾上腺素通过抑制SNI 大鼠背根神经节中大、中神经元的兴奋性,同时兴奋小神经元而参与痛觉传入信号的调控。
