牛大力种子萌发过程中的生理生化变化*
2020-07-03陈建桦姚绍嫦李良波黄荣韶
谭 萍,陈建桦,姚绍嫦,李良波,黄荣韶**
(1.广西大学农学院,广西南宁 530004,2.玉林师范学院图书馆 ,广西玉林 537000; 3.广西中医药大学药学院,广西南宁 530200)
0 引言
牛大力是豆科鸡血藤属植物美丽鸡血藤(Calleryaspeciosa)的俗称,分布在我国广西、广东、海南等地。牛大力性甘、平,具有强筋活络的功效,在临床上已被证实对多种慢性疾病如风湿性关节炎、肺结核、慢性支气管炎、腰肌劳损等疾病有治疗作用[1]。民间大量使用牛大力做药膳,其在两广地区得到广泛应用[1]。近几年,学者对牛大力的研究不断,在药理方面取得了很大的进展。近年来,由于大面积的采挖,牛大力野生资源逐渐枯竭,人工栽培成为保护牛大力资源的主要手段。在自然条件下,牛大力种子发芽催苗十分缓慢,根系不发达,发芽不整齐[2],导致牛大力种苗不能满足人工栽培的需求。因此,了解牛大力种子的生命活动规律,促进牛大力种子萌发与生长,是丰产丰收的重要保障。目前关于牛大力种子萌发方面的研究甚少,本文通过研究牛大力种子萌发的各项生理生化指标,并对其进行相关性分析,以揭示牛大力种子萌发的生理适应机制。
1 材料与方法
1.1 材料
牛大力种子购于广西博白县顿谷镇牛大力种植基地,并选取籽粒饱满、质地均匀的供试种子。品种由当地野生优良单株经人工繁育筛选而来。田间管理按常规方法。
1.2 方法
选取50粒大小一致的种子,在大棚进行沙床试验,设3组重复共150粒种子,定期喷洒自来水以保持湿润(使沙床持水量保持在80%左右)。根据种子萌发过程的差异,确定采样时间。在种子萌发初期各项生理指标只有微小的变化,所以前期取样时间间隔长;随着种子萌发,生长速率加快,生理变化明显,所以在后期缩短了取样间隔时间。具体如下:分别在种子萌发后0,10,17,22,26,30,33,36,40 d收集萌发种子的子叶和胚根。
1.3 生理生化指标测定
可溶性糖含量采用的苯酚法[3]测定(mg·g-1)。根据超氧化物歧化酶(SOD)抑制氮蓝四唑(NBT)在光下的还原作用测定SOD活性[4],以抑制NBT光化学反应的50%为一个酶活性单位(U·g-1FW)。根据过氧化物酶(POD)氧化愈创木酚的生成物的量(吸光系数为26.6 mmol·L-1·cm-1)来测定POD活性[5],用紫外分光光度计测定波长470 nm处光密度值的变化,以0.01 △OD470/min为一个酶活单位(U·g-1FW)。过氧化氢酶(CAT)酶活性测定采用紫外分光光度法[6],测定240 nm下的吸光值变化,以0.01 △OD240/min为一个酶活单位(U·g-1FW)。游离氨基酸含量采用茚三酮溶液显色法[7]测定(mg/100 g)。蛋白酶活性的测定采用甲醛滴定法[8],根据样品(氨基氮)所消耗的NaOH量计算酶的活性,酶活性单位为mg·g-1·h-1。利用酚类物质与三氯化铁溶液反应产生蓝色化合物的原理,测定提取液中总酚含量(μg·g-1)。
1.4 数据处理
实验数据均采用Excel和SAS for Windows统计分析软件处理。
2 结果与分析
2.1 牛大力种子萌发过程中可溶性糖含量的变化
在牛大力种子萌发过程中,其可溶性糖含量随着萌发的进行呈先增加后降低的变化趋势,在第22 d时达到峰值0.430 mg·g-1,为0 d的1.79倍,与其他阶段呈现极显著差异(P<0.05)(表1,图1)。22 d后可溶性糖含量快速下降,第40 d达到最低值,只有最初(0 d)的29.3%。
表1 牛大力种子萌发过程中各生理指标的变化
Table 1 Changes of physiological indexes during the germination ofC.speciosaseeds
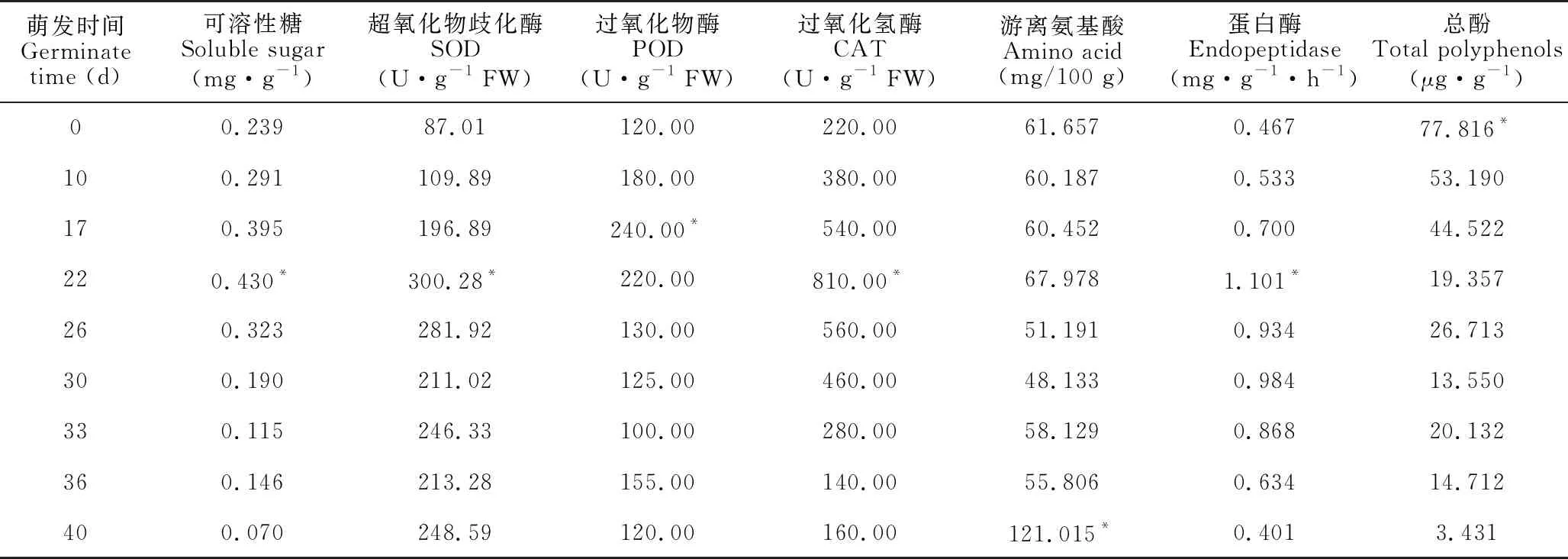
萌发时间Germinate time (d)可溶性糖Soluble sugar(mg·g-1)超氧化物歧化酶SOD(U·g-1 FW)过氧化物酶POD(U·g-1 FW)过氧化氢酶CAT(U·g-1 FW)游离氨基酸Amino acid(mg/100 g)蛋白酶Endopeptidase(mg·g-1·h-1)总酚Total polyphenols(μg·g-1)00.23987.01120.00220.0061.6570.467 77.816*100.291109.89180.00380.0060.1870.53353.190170.395196.89 240.00*540.0060.4520.70044.52222 0.430* 300.28*220.00 810.00*67.978 1.101*19.357260.323281.92130.00560.0051.1910.93426.713300.190211.02125.00460.0048.1330.98413.550330.115246.33100.00280.0058.1290.86820.132360.146213.28155.00140.0055.8060.63414.712400.070248.59120.00160.00121.015*0.4013.431
注:*表示在P<0.05水平相关性具有统计学意义
Note:* indicates that the correlation is statistically significant at the level ofP<0.05
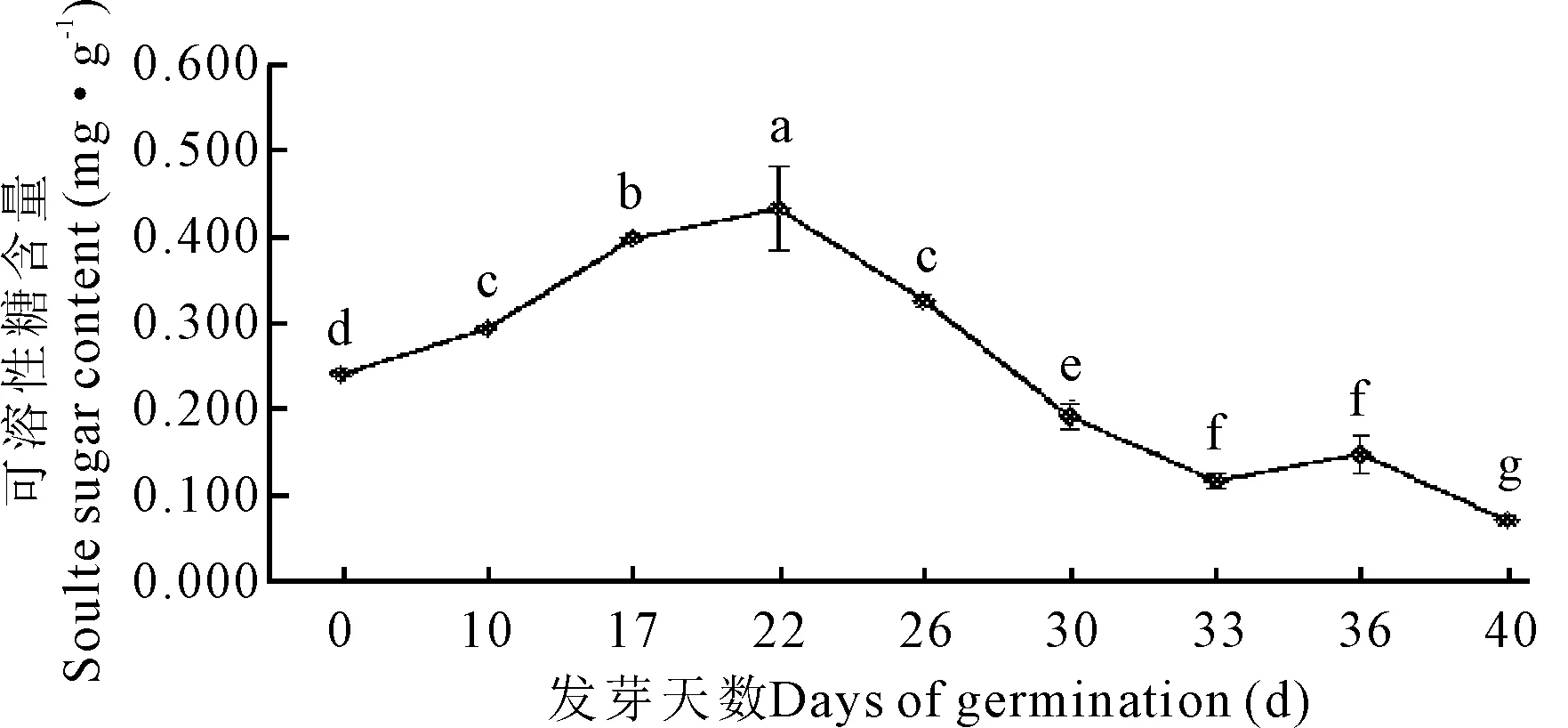
不同小写字母表示差异显著(P<0.05)
Different lowercase letters show significant differences (P<0.05)
图1 牛大力种子萌发过程中可溶性糖含量的变化
Fig.1 Changes of the content of soluble sugar during the germination ofC.speciosaseeds
2.2 牛大力种子萌发过程中抗氧化酶活性的变化
2.2.1 超氧化物歧化酶(SOD)活性的变化
在牛大力种子萌发过程中,超氧化物歧化酶活性在0—22 d上升速率最快,第22 d时SOD活性最高,达到304.24 U·g-1FW,为0 d的3.45倍,与其他阶段的酶活呈现显著差异(P<0.05)。22—30 d开始有明显的下降,30—40 d则呈现上升后下降再上升的趋势(表1,图2)。
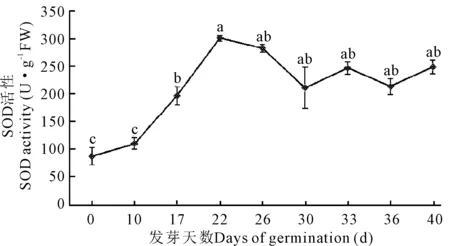
不同小写字母表示差异显著(P<0.05)
Different lowercase letters show significant differences (P<0.05)
图2 牛大力种子萌发过程中超氧化物酶活性的变化
Fig.2 Dynamic changes of the activities of SOD during the germination ofC.speciosaseeds
2.2.2 过氧化物酶(POD)活性的变化
随着种子萌发过程的进行,牛大力种子的POD活性总体呈先上升后下降的变化趋势(表1,图3)。第17 d时,POD活性达到顶峰,为240 U·g-1FW,与其他阶段的酶活呈现显著差异(P<0.05),而22 d后活性缓慢下降,在第33—40 d呈现出上升而后下降的态势。
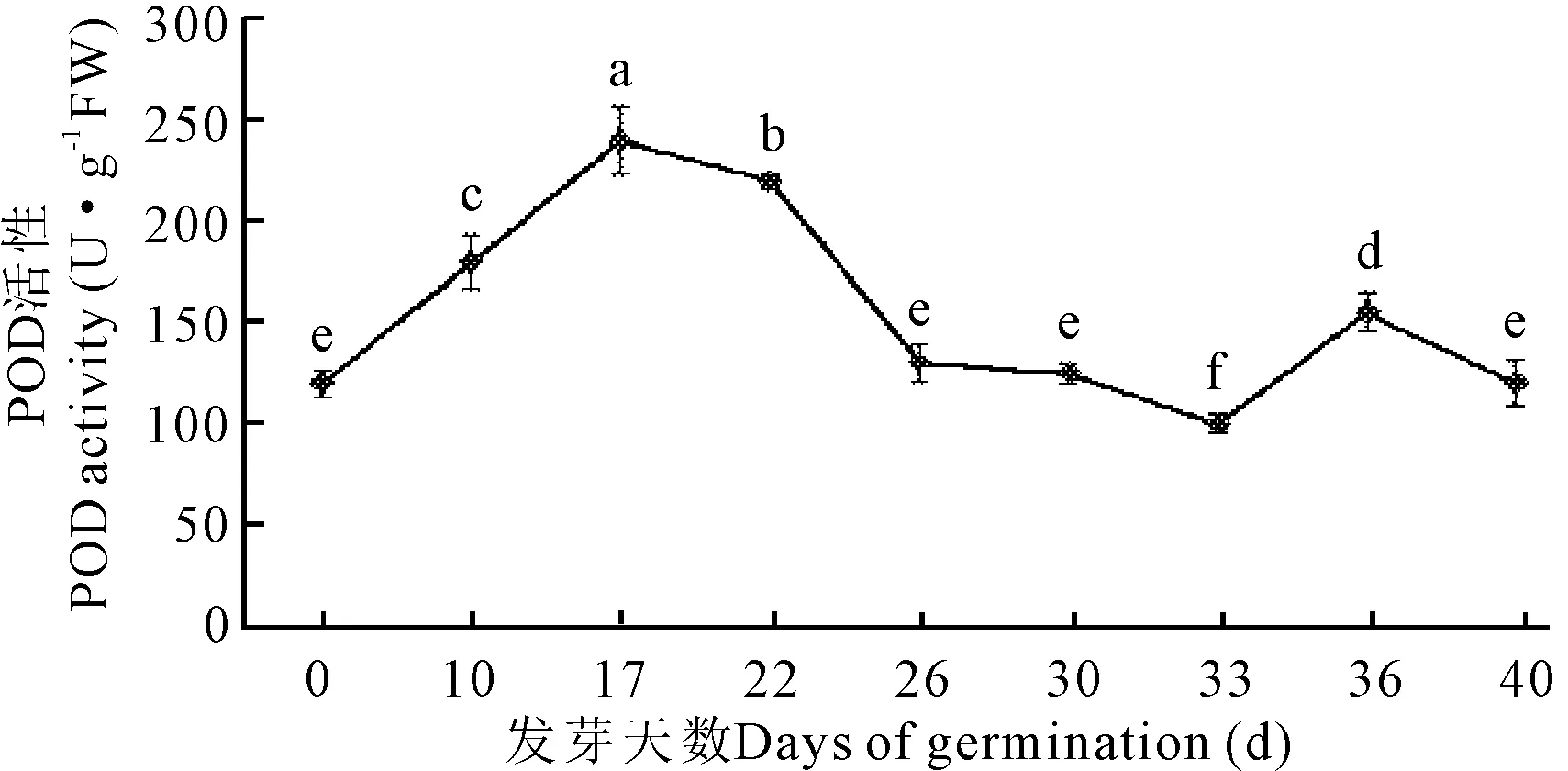
不同小写字母表示差异显著(P<0.05)
Different lowercase letters show significant differences (P<0.05)
图3 牛大力种子萌发过程中过氧化物酶活性的变化
Fig.3 Dynamic changes of the activities of POD during the germination ofC.speciosaseeds
2.2.3 过氧化氢酶(CAT)活性的变化
在牛大力种子整个萌发过程中,其CAT活性总体呈先上升后下降的变化特征(表1,图4)。种子萌发0—22 d呈上升趋势,第22 d达到最大值810 U·g-1FW,与其他阶段的酶活呈现极显著差异(P<0.05)。22 d后持续下降,到36 d又开始缓慢回升。
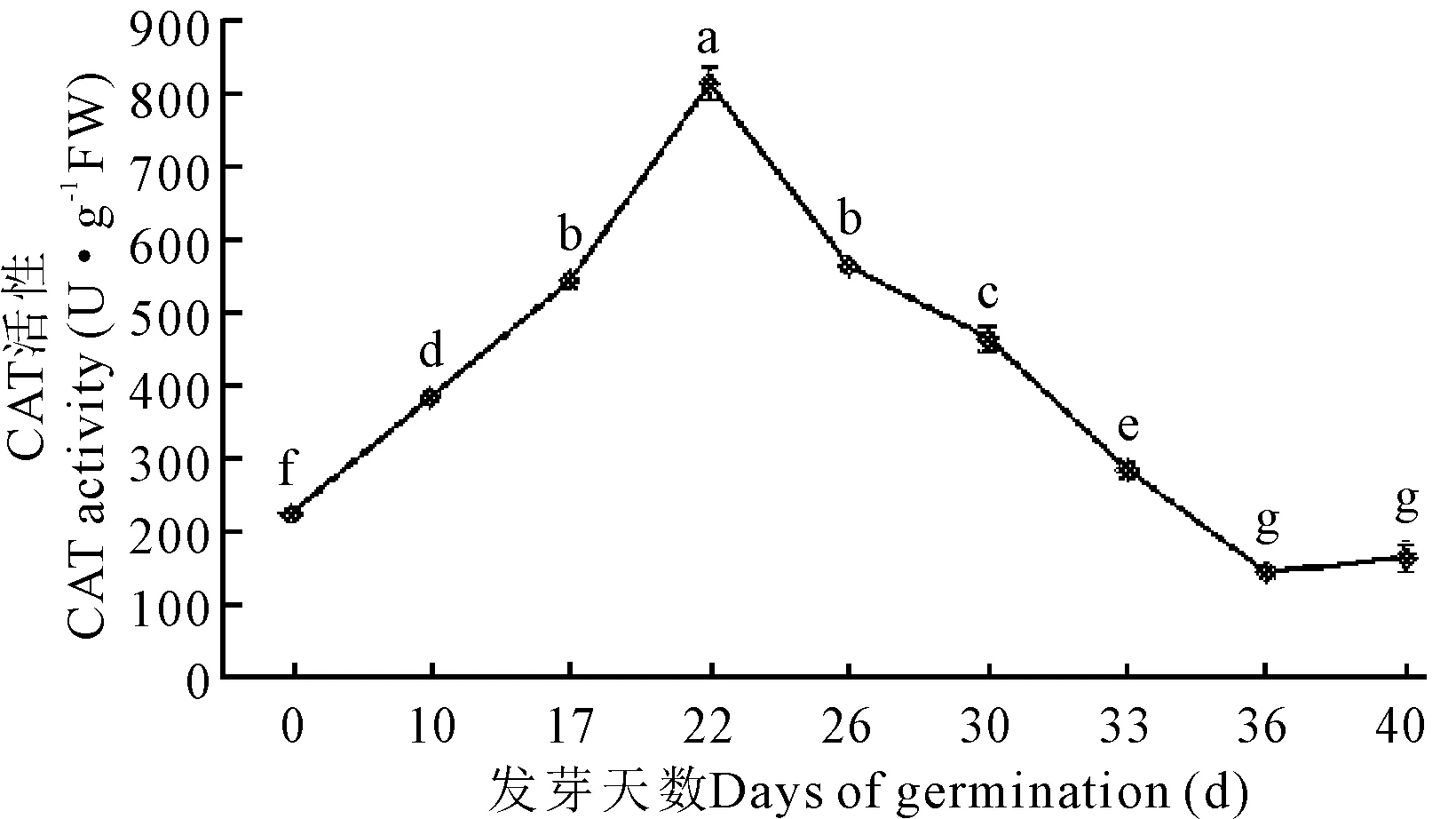
不同小写字母表示差异显著(P<0.05)
Different lowercase letters show significant differences (P<0.05)
图4 牛大力种子萌发过程中过氧化氢酶活性的变化
Fig.4 Dynamic changes of the activities of CAT during the germination ofC.speciosaseeds
2.3 牛大力种子萌发过程中游离氨基酸含量的变化
牛大力种子萌发过程中,游离氨基酸的含量呈现先升后减再陡然上升的趋势(表1,图5)。36—40 d快速增加,40 d时达到最大值121.015 mg/100 g,与其他阶段的酶活呈现显著差异(P<0.05)。
2.4 牛大力种子萌发过程中蛋白酶活性的变化
随着种子萌发的推进,蛋白酶的活性呈先上升后下降的变化趋势(表1,图6)。牛大力种子在0—22 d的吸涨阶段,蛋白酶活性不断升高;在胚根突破种皮(22 d)时,其活性达到最高值1.101 mg·g-1·h-1,与其他阶段的酶活呈现显著差异(P<0.05),22 d后蛋白酶活性开始持续下降。
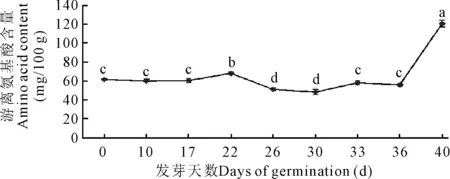
不同小写字母表示差异显著(P<0.05)
Different lowercase letters show significant differences (P<0.05)
图5 牛大力种子萌发过程中游离氨基酸含量的变化
Fig.5 Changes of the content of amino acid during the germination ofC.speciosaseeds
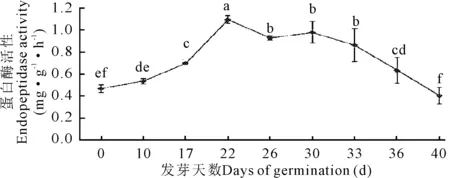
不同小写字母表示差异显著(P<0.05)
Different lowercase letters show significant differences (P<0.05)
图6 牛大力种子萌发过程中蛋白酶活性的变化
Fig.6 Dynamic changes of the activities of endopeptidase during the germination ofC.speciosaseeds
2.5 牛大力种子萌发过程中总酚含量的变化
由图7可知,牛大力种子在萌发过程中总酚的含量整体上呈降低趋势。种子萌发初期0—22 d总酚含量降幅非常明显,从77.81 μg·g-1下降至19.36 μg·g-1,下降了75.12%。随后变化趋势没有明显的规律性,但在总体上呈下降趋势。在40 d时,总酚含量下降到最低值。

不同小写字母表示差异显著(P<0.05)
Different lowercase letters show significant differences (P<0.05)
图7 牛大力种子萌发过程中总酚含量的变化
Fig.7 Changes of the total polyphenols content during the germination ofC.speciosaseeds
2.6 牛大力种子萌发过程中各生理指标的相关性分析
牛大力种子萌发过程中,种子的各生理指标的相关性分析见表2。可溶性糖含量与过氧化物酶活性、过氧化氢酶活性呈显著正相关(P<0.05),这表明牛大力种子萌发过程中物质能量代谢与酶的作用有很大关系。总酚含量与SOD活性存在显著负相关(P<0.05),与CAT及蛋白酶活性也存在负相关关系。一些酚类物质能抑制种子的萌发,且主要原因是抑制种子萌发所需的关键酶类,说明牛大力种子中含有抑制萌发的酶类,但究竟是酚类物质的哪些组分抑制萌发还有待进一步研究[8-9]。
表2 牛大力种子萌发过程中各生理指标的相关关系
Table 2 Correlation coefficients among physiological indexes during the germination ofC.speciosaseeds
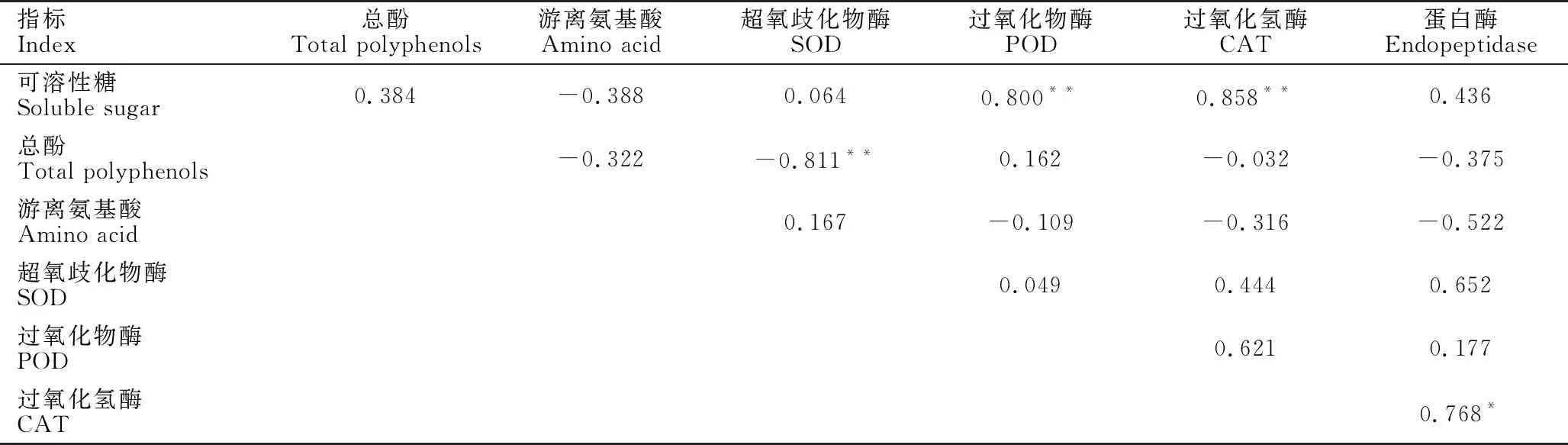
指标Index总酚Total polyphenols游离氨基酸Amino acid超氧歧化物酶SOD过氧化物酶POD过氧化氢酶CAT蛋白酶Endopeptidase可溶性糖Soluble sugar0.384-0.3880.0640.800**0.858**0.436总酚Total polyphenols-0.322-0.811**0.162-0.032-0.375游离氨基酸Amino acid0.167-0.109-0.316-0.522超氧歧化物酶SOD0.0490.4440.652过氧化物酶POD0.6210.177过氧化氢酶CAT0.768*
注:*和**表示分别在P<0.05,P<0.01水平相关性具有统计学意义
Note:* and ** indicate that the correlation is statistically significant at the level ofP<0.05 andP<0.01
3 讨论
3.1 可溶性糖的变化
种子萌发是蛋白质、淀粉和脂肪等贮藏物质的转化过程,各类酶参与调控[10]。其中,可溶性糖含量的动态变化可说明植物体内碳水化合物的运转与分配情况,是保障种子正常萌发的基础[11]。牛大力种子萌发过程中,淀粉等高分子多糖降解为可溶性糖,以提供种子萌发的呼吸底物,可溶性糖含量的高低与呼吸的消耗速率有关[12],其可溶性糖含量趋势呈先高后低的变化,这是因为在种子萌发后期的呼吸作用增强,导致了可溶性糖消耗增加[9],这与李磊[13]对掌木叶种子发芽的研究结果相类似。牛大力种子萌发初期代谢活动增强,淀粉分解成小分子糖,为种子萌发提供所需的营养,在第22 d时达到顶峰。在种子萌发后期,可溶性糖被更多用以合成或转化为其他物质,为幼苗生长提供能量,所以出现含量下降的趋势。
3.2 抗氧化酶活性的变化
大量研究表明,SOD、POD、CAT酶在植物体内起到保护植物细胞功能的作用,通过调节酶的活性,维持活性氧化代谢和植物的正常生长发育[9]。林琼等[14]对刺槐种子研究表明,在种子萌发过程中,保护酶的活性逐渐升高,达到峰值后逐渐下降。柴家荣[15]对白肋烟种子萌发过程的研究发现,POD等保护酶的活性随萌发进程均呈上升趋势,直到最高峰值开始下降。孙颖等[12]对北黄花菜种子萌发的研究发现,北黄花菜的SOD、POD、CAT酶活性在种子萌发期间均表现出升高的趋势,并且在种子萌发初期酶活性变化更加明显。本研究中,牛大力种子在萌发初期(0—22 d) SOD、POD、CAT酶活性均表现出显著增加,这3种酶都参与了活性氧代谢,以及时有效地清除细胞代谢产生的有害物质,因此都呈现升高的趋势。当胚芽开始伸长生长,3种酶活性呈降低趋势,可能是因为牛大力种子在胚芽开始伸长生长时,细胞防御功能减弱。该结果与其他作物种子萌发初期的情况相似。
3.3 游离氨基酸的变化
相关性分析可知,游离氨基酸与蛋白酶呈负相关关系。这说明在萌发期间,蛋白酶不断催化蛋白质分解为氨基酸,导致氨基酸含量增加[15]。在种子萌发初期,由于蛋白质分解强烈,致使氨基酸的含量增加;萌发后期,种子逐渐从异养过渡到自养,而这时候蛋白质的降解仍在进行,一些合成的氨基酸积累在子叶中,所以发芽后期蛋白质降解减缓但氨基酸含量仍然明显增加[13]。在本研究中,游离氨基酸含量呈先上升后下降再迅速上升的趋势,这与杨玉珍等[16]对银杏种子萌发的研究结果相类似。
3.4 蛋白酶活性的变化
蛋白质的降解,相关酶的分布,种子在萌发过程中酶的激活、合成及运输之间存在较强的相关性[17]。在本实验中,牛大力种子萌发初期代谢活动旺盛,蛋白酶活性增高,大量蛋白质被降解为氨基酸参与代谢活动;萌发中期时代谢活动减弱,蛋白酶的活性同时也减弱,游离氨基酸含量因此出现下降趋势;萌发后期幼芽开始生长,代谢活动增强,参与各种代谢的酶类也增多,游离氨基酸含量又出现快速增加的现象。这是因为子叶中的大分子蛋白质在蛋白酶的作用下被降解为蛋白质片段或氨基酸,而代谢中释放的能量用于细胞分裂、生长和分化,使种子顺利萌发和形成幼苗[17]。
3.5 总酚的变化
在牛大力种子萌发过程中,总酚含量总体呈下降趋势,总酚含量与SOD活性存在显著负相关,与CAT及蛋白酶活性也存在负相关关系,说明牛大力种子中含有抑制种子萌发的酶类。
4 结论
本实验以牛大力种子为供试材料,对牛大力种子萌发过程中的生理生化变化进行研究。研究结果表明:在牛大力种子萌发过程中,可溶性糖含量、SOD、POD、CAT和蛋白酶活性呈先升后降的变化,游离氨基酸呈先升后降再陡然上升趋势,总酚含量整体上呈降低趋势。
牛大力种苗的质量与植株中后期生长强弱尤其是根系生长有较大联系。本研究较系统地阐述了牛大力种子萌发过程中的生理生化变化特征,为进一步开展牛大力种苗质量研究提供了一定的理论支撑。由于萌发过程中代谢活动的复杂性,在大田栽培牛大力时应该要先培育壮苗,提高植株前中期生理活性,为提高牛大力栽培产量和质量奠定基础。
