血管新生过程中尖端细胞的功能及其研究进展
2020-07-03杜书嵩安明欣赵伟东
杜书嵩,安明欣,赵伟东
(中国医科大学 生命科学学院发育细胞生物学教研室,辽宁 沈阳 110122)
0 引言
血管系统主要负责将血液输送到全身的组织器官,以满足机体活动所需的氧气及各种营养物质的需要,再将代谢终产物运送到肺、肾等器官排出体外.血管系统的发育经历两个主要过程.其一为血管发生(vasculogenesis),即胚胎早期由血管祖细胞原位分化组装形成的血管;其二为血管新生(angiogenesis),即从原先存在的小血管上通过出芽的方式长出新的血管分支[1].血管系统形成的过程分为以下时期:1)初期:主要由体内外的各种刺激导致促血管生成因子分泌增多并在局部聚集,从而诱导血管新生.这些体内外刺激包括:血管损伤、缺氧、肿瘤、创伤及炎症反应等;2)增生侵入期:细胞外基质发生降解,使得血管组成细胞与周围组织间的附着力下降.3)成熟分化期:血管的管腔形成,内皮细胞产生分化,血管重新改建,根据组织需要产生变化,形成血管结构,并逐渐形成血管网络.血管新生是一个涉及多种细胞和多种分子的复杂过程.正常情况下血管新生与血管重塑处于平衡状态,一旦此平衡打破,会发生血管过度生成或血管退化,比如周围组织血管向肿瘤内过度生长,使肿瘤血管化是促进肿瘤生长和转移的重要事件[2].因此,了解血管新生的调控机理,可望发现新的用于血管相关疾病治疗的靶标.
1 尖端细胞及其在血管新生过程中的作用
血管出芽是血管新生的关键过程,血管出芽过程依赖于血管内皮细胞被诱导所形成的特殊亚型.在血管出芽时所伸出的分支的最前端的细胞,称为尖端细胞(tip cell),尖端细胞可以发出放射状的丝状伪足,用于引导血管出芽的方向.在尖端细胞后端紧邻的细胞称为茎细胞(stalk cell)[3],其增殖能力强,主要起延长新生血管分支的作用.血管间发生粘附吻合后,新生血管内开始有血液灌注的时候内皮细胞就会分化成静止的队列细胞(phalanx cell)[4].
自从1996年Kurz首次发现并提出尖端细胞的概念之后,人们对这尖端细胞的研究逐渐深入[5].尖端细胞的作用主要分为出芽和吻合两个过程.在血管出芽时,在浓度梯度血管内皮生长因子(vascular endothelial growth factor,VEGF)等因子的作用下,尖端细胞分泌基质金属蛋白酶(matrix metalloproteinase,MMP)降解位于其表面的细胞外基质,同时VEGF等因子通过促进血管内皮钙粘蛋白(vascular endothelial cadherin,VE-cadherin)的内吞导致细胞间连接不稳定,从而促进出芽形成.当新生成的血管没有血流灌注时,或尖端细胞的VEGF信号受到抑制的时候,新的出芽则会收缩,留下一个空的细胞外基质壳;如果新生血管有血流灌注,则血管内皮钙粘蛋白会被肌球蛋白(myosin)沿细胞骨架转运至尖端细胞前端丝状伪足的末梢,使得新出芽的血管与其他血管新芽或者原有血管形成吻合.血管吻合形成后,局部的促血管生成的信号减弱而抑制血管生成的信号增强,此处尖端细胞的延伸能力下降;然后,在血管的其他位置则又开始新的血管出芽,继续形成新的血管吻合[6].
2 尖端细胞的调控机理
2.1 分子调控机制
促进血管新生的生长因子包括血管内皮生长因子(VEGF),成纤维细胞生长因子(FGF),血小板衍生生长因子(PDGF),肿瘤坏死因子α(TNF-α),转化生长因子β(TGF-β)和血管生成素(Ang)等[7].其中诱导血管内皮尖端细胞出芽的关键因子是血管内皮生长因子A(VEGF-A).在小鼠胚胎脊髓、出生后小鼠的视网膜以及在斑马鱼中均发现,VEGF-A的浓度梯度可以促进血管的定向出芽[8].当血管内皮细胞暴露于促血管生成信号(例如VEGF-A)时,只有少部分血管内皮细胞转化为尖端细胞表型,而其他血管内皮细胞则在尖端细胞后端保持血管床的完整性并维持血流灌注.血管出芽时尖端细胞和茎细胞间的竞争以及表型的确定,主要由VEGF和Notch信号通路调控[9].Notch的配体一共五种:分别是Dll1、Dll3、Dll4、jagged-1、jagged-2[10].VEGF诱导血管出芽后,使得尖端细胞VEGF受体2(VEGFR2)表达升高,进而促进Dll4表达;Dll4作为配体和相邻的茎细胞表面Notch受体结合,激活茎细胞Notch信号通路,Notch胞内区被γ-分泌酶水解释放出Notch 胞内结构域,进入细胞核调节基因转录,进而使茎细胞的VEGFR1表达增高.由于VEGFR1促进血管新生的能力较VEGFR2弱,导致茎细胞和尖端细胞比较不具备竞争优势[11].简言之,尖端细胞上表达的Dll4通过激活茎细胞上Notch受体,从而抑制茎细胞诱发血管新生的能力.另一方面,茎细胞表面表达Notch的另一个配体Jagged1,Jagged1与Dll4能够竞争性结合尖端细胞上的Notch受体,但是Jagged1与Notch结合后却无法激活Notch通路,只起到竞争性拮抗的作用,因此Jagged1和Dll4在尖端细胞诱导的血管生成过程中发挥相反的作用(图1)[12,13].
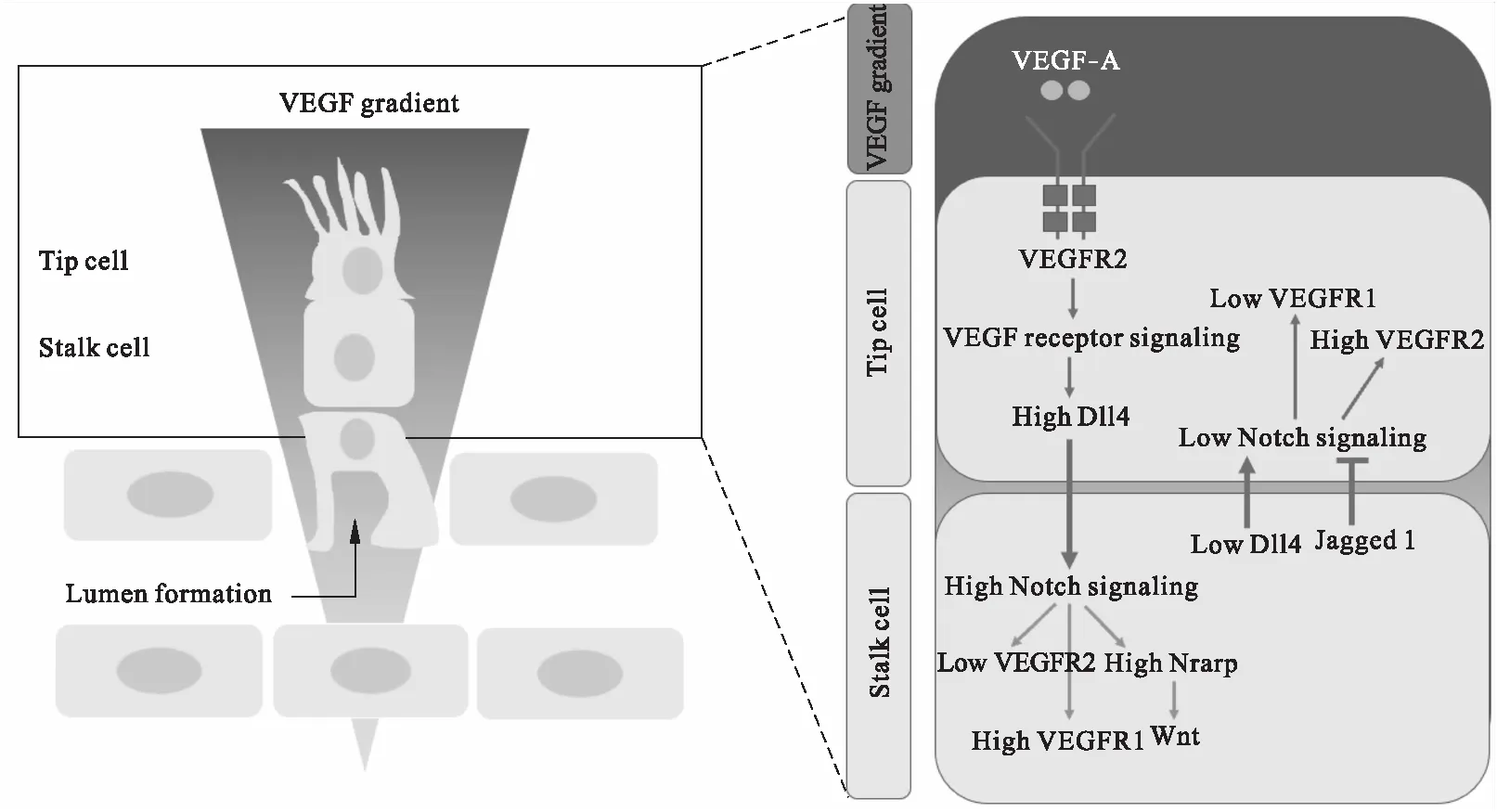
图1 VEGF-Notch信号通路协同作用调节尖端细胞与茎细胞间的平衡
2.2 代谢调控机制
新近研究显示,血管内皮细胞内的糖酵解途径对于血管新生过程具有重要意义.6-磷酸果糖激酶-1(PFK-1)是糖酵解途径中一个关键的限速酶,其主要作用是合成2,6双磷酸果糖,能够促进糖酵解途径;而PFKFB(2,6双磷酸果糖激酶)是PFK-1的变构激活剂.新近研究显示,PFKFB的主要成员PFKFB3的过表达可以增强糖酵解途径,并能够促进血管生成,且这种促进效应的强度要强于Notch信号通路对血管生成的抑制作用[14].当新生血管有血流灌注时,血流冲击血管内皮细胞会下调PFKFB3的表达而抑制糖酵解途径,使细胞处于静息状态[15].尽管血管内皮细胞排列在血管腔内,与血液中的高浓度氧气直接接触,但是血管新生时的出芽却不依赖于线粒体的氧化呼吸作用,出芽时血管内皮细胞内85%的ATP来源于糖酵解途径.血管新生时血管内皮细胞主要依赖糖酵解途径产生能量的意义在于:1)血管内皮细胞只有自身低耗氧,才能够更好地为其他组织器官供氧;2)在血管发育过程中,当血管内皮细胞出芽深入至无血管组织时,就会暴露在低氧环境中,而糖酵解途径供能则有利于血管内皮细胞适应这种低氧环境;3)尖端细胞在延伸的过程中其丝状伪足的活动依赖于ATP的能量供应,但是由于线粒体体积较大,无法进入纤薄的伪足结构中,而糖酵解途径则能够高效快速的实现局部ATP的生成,从而促进尖端细胞的迁移和延伸.
除糖酵解外,脂肪酸氧化代谢对于血管的生成也很重要.肉碱脂酰转移酶1(CPT1)是脂肪酸氧化代谢的限速酶,该酶能够运输脂肪酸进入线粒体进行β氧化,代谢产物乙酰辅酶A进入三羧酸循环.最近有研究显示,体外抑制CPT1后,血管内皮细胞增殖能力下降,影响了血管出芽过程,而细胞迁移能力没有受到影响[16].血管内皮细胞特异性敲除CPT1的转基因小鼠中,其视网膜微血管由于增殖能力降低导致血管分支数量和血管伸展面积减少,但血管成熟和消退过程不受影响,其原因在于CPT1敲除后使得DNA复制的原料dNTP的水平下降,从而抑制血管内皮细胞的增殖;当补充dNTP后,则血管出芽能力得以恢复,这说明脂肪酸氧化代谢来源的dNTP对于血管内皮细胞的增殖是必须的.此外,这种现象是血管内皮细胞特异性的,因为其他细胞如成纤维细胞则不能利用脂肪酸氧化代谢来源的dNTP参与DNA复制[17].
2.3 血管外环境因素
血管新生过程也受到血管周围微环境的影响,血管周围的其他细胞能够与新生血管通过直接相互作用或者通过旁分泌信号来影响血管出芽和吻合等过程.研究显示,在小鼠出生后的视网膜中,无血管区的星形胶质细胞可以分泌VEGF-A,形成VEGF-A浓度梯度,诱导血管的定向出芽[8].Amir Rattner等人发现,当在小鼠大脑的星形胶质细胞中特异性敲除缺氧诱导因子(hypoxia-inducible factor,HIF)后,使得VEGF分泌减少,通过影响脑血管内皮的尖端细胞,抑制脑血管内皮细胞的迁移过程[17].这些结果都说明星形胶质细胞可以通过分泌VEGF调控脑血管新生.Alessandro Fanti最近研究发现,脑内巨噬细胞能够促进脑血管发育,他们的结果显示,巨噬细胞在不依赖于VEGF的情况下能够促进尖端细胞出芽和生长;此外,巨噬细胞还直接参与了尖端细胞介导的血管间的吻合过程[18].另有研究显示,利用藻酸盐生物材料结合Th1、Th2、Th17型T细胞,注射到小鼠的缺血后肢肌肉中后,能够释放多种促血管生成的因子(如IFN-γ,TNF-α,IL-4和IL-13),促进血管内皮细胞出芽和迁移的能力,从而促进了缺血后肢体的血管再生修复[19].然而,血管周围微环境中参与血管新生的各型细胞发挥作用的时间顺序,仍有待进一步研究.
3 结论与展望
尖端细胞对于血管网络的构建形成十分重要,血管出芽依赖尖端细胞末端形成的伪足结构,尖端细胞的表型不仅受到表面受体和细胞代谢的调控,还受到血管周围微环境的影响.通过对尖端细胞调控机理的研究,能够更好的认识血管新生这一复杂的生物学过程,有助于解决生理及病理过程中的血管新生相关问题,为进一步寻找新型治疗方法提供理论依据.
