合成基因IL-6在大肠杆菌中表达及融合蛋白鉴定分析
2020-07-02唐维政孙鸿高陈少文汪凡朱中元
唐维政 孙鸿高 陈少文 汪凡 朱中元
(海南医学院第二附属医院检验科,海南 海口 570311)
临床上对细菌引起的感染性疾病的诊断“金标准”是细菌培养,但细菌培养周期长,一般3~5天才有结果,而且血培养阳性率低,还可能因污染菌造成假阳性。因此,仅靠细菌培养无法实现对细菌引起的感染性疾病的早期诊断,受细菌感染的患者尤其是重症患者也就不能及时得到抗生素治疗。近年来,白细胞介素6(IL-6)、降钙素原(PCT)、C-反应蛋白(CRP)和血清淀粉样蛋白A(SAA)等感染指标的血清学检验已越来越引起临床的重视,成为了对感染性疾病早期诊断和鉴别诊断的新手段[1-4],有效地弥补了细菌培养周期长等缺陷。
目前,国内已普遍采用免疫荧光法或免疫胶体金法快速测定PCT、CRP和SAA,以满足急诊患者诊疗需求。而IL-6的检测主要为化学发光法和酶联免疫法,这两种方法对于基层医院和偏远地区小型医院不适用。我们试图开发一种IL-6、PCT、CRP和SAA胶体金联合快速检测系统,为没有先进检测设备的医疗机构对急诊患者细菌感染的早期诊断、合理使用抗菌药物及疗效评估提供血清学依据。本实验对IL-6原核蛋白在大肠杆菌中表达及纯化,为探索建立血清IL-6快速测定方法奠定前期实验基础。
1 材料与方法
1.1材料
1.1.1质粒与菌株 pCzn1 质粒、TOP10 克隆菌株及表达菌株Arctic-ExpressTM均由南京淘普生物技术有限公司提供。
1.1.2主要试剂 限制性内切酶NdeI和XhoI购自宝生物工程(大连)有限公司,Pfu DNA聚合酶购自南京淘普生物技术有限公司(货号PC12)。胰蛋白胨、酵母粉购自英国OXOID公司,琼脂糖购自上海基因公司。DNA胶纯化试剂盒、质粒小提试剂盒购自美国AXYGEN公司。
1.2方法
1.2.1IL-6基因合成 根据基因库IL-6蛋白的基因序列,由南京淘普生物技术有限公司采用基于 PAS(PCR-based Accurate Synthesis)的方法,设计全长拼接引物,在引物的两端各设计了保护性碱基合成基因IL-6。
1.2.2重组质粒pCzn1-IL-6构建 使用限制性内切酶NdeI和XhoI分别对合成基因PCR回收产物和pCzn1空载体进行双酶切 ,酶切后产物经琼脂糖凝胶电泳后回收纯化进行连接反应,按10 μL反应体系:10×连接缓冲液1 μL、pCzn1质粒1μL、PCR产物4 μL、T4DNA连接酶1 μL,去离子水补充至10 μL。混匀后瞬时离心,置22 ℃过夜连接。连接产物化学法转化入TOP10 克隆菌株,使用含终浓度为50 mg/L氨苄西林的LB平板进行筛选,挑选PCR阳性克隆送南京淘普生物技术有限公司测序。
1.2.3质粒酶切鉴定 以限制性内切酶NdeI和XhoI对重组质粒进行切割,用1.5%琼脂糖凝胶电泳检测pCzn1线性化载体和IL-6插入基因的大小。酶切体系:质粒:3 μL,内切酶1:0.25 μL,内切酶2 :0.25 μL,10×Buffer:1.0 μL,双蒸水加至10μL。
1.2.4原核蛋白的诱导表达及鉴定 将pCZN1 -IL-6载体转化至大肠杆菌Arctic Express :将质粒1 μL加入100 μL感受态细菌中,置冰上20 min;42 ℃热激90 s,迅速置冰中5 min;加入600 μL LB培养液;37 ℃,220 r/min振摇1 h,离心后全部涂布于含50 μg/mL Amp的LB平板,37 ℃倒置培养过夜。IPTG诱导pCZN1 -IL-6载体原核蛋白的表达:挑取转化平板上的单克隆接种于3 mL LB培养液的试管中,37 ℃振摇过夜;次日按1∶100接种于30 mL LB培养液中,37 ℃ 振摇至菌体OD600为0.6~0.8;取出1 mL培养物离心弃上清,用100 μL 1×上样缓冲液重悬菌体沉淀;向剩余的培养物中加入IPTG至终浓度为0.5 mmol/L,37 ℃ 220 r/min振摇4 h,诱导融合蛋白表达;取出1 mL培养物,室温离心弃上清,用100 μL 1×上样缓冲液重悬菌体沉淀,剩余培养物离心弃上清,用 PBS重悬菌体沉淀,重悬液进行超声波破碎后,分别取上清液与沉淀液加入上样缓冲液重悬;进行12% SDS-PAGE检测分析,考马斯亮蓝染色显带。
1.2.5原核蛋白的Ni柱亲和纯化及结果分析 上述诱导表达后的菌液Ni柱纯化:利用低压层析系统按照其说明书进行纯化,对纯化样品进行12% SDS-PAGE及Western Blot鉴定。
2 结 果
2.1pCzn1-IL-6测序验证 重组质粒pCzn1-IL-6化学法转化入TOP10 克隆菌株,使用LB平板进行筛选,挑选PCR阳性克隆送南京淘普生物技术有限公司测序,测序结果与预期序列一致,证实插入基因序列正确,无突变、缺失,可以确定pCZN1 -IL-6原核表达质粒构建成功。测序结果与预期序列进行比对。见图1。
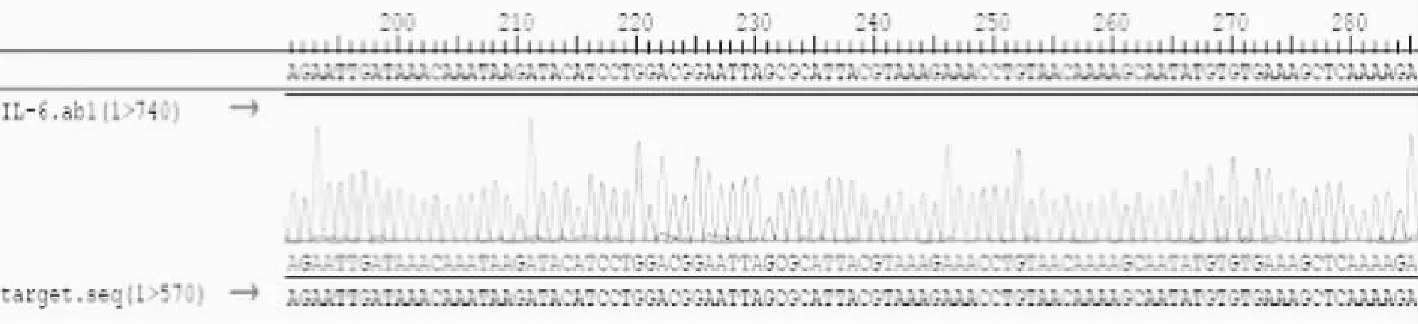
图1 部分序列比对结果图
2.2质粒酶切鉴定 重组质粒经双酶切后,经琼脂糖凝胶电泳鉴定,IL-6基因片段在500 bp稍上位置,与预期目的片段550 bp相符(图2)。
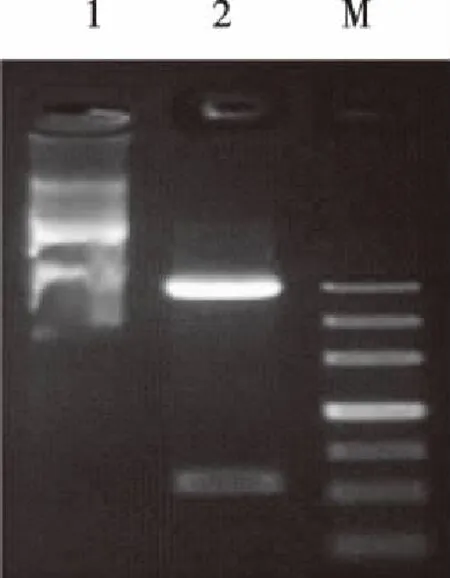
注:Marker: 200,500,800,1200,2000,3000,4500;基因名称:IL-6(OD260/OD280:1.82);酶切鉴定:NdeI - XhoI; M:Marker;Line1:酶切前质粒;Line2: 酶切后质粒图2 质粒酶切鉴定
2.3原核蛋白的诱导表达及鉴定 pCZN1 -IL-6重组质粒转化至大肠杆菌Arctic Express, 利用终浓度0.5 mmol/L IPTG诱导蛋白表达,培养物经12% SDS-PAGE分析。诱导后在目的蛋白约24.15KD 区域有明显的特异条带,未诱导的菌株无特异的表达条带,目标蛋白主要存在于沉淀中,说明原核蛋白的诱导表达成功。在诱导破碎后上清和沉淀中都有目的条带,说明IL-6蛋白以可溶性和包涵体两种形式存在于表达菌中,主要以包涵体形式存在。见图3。
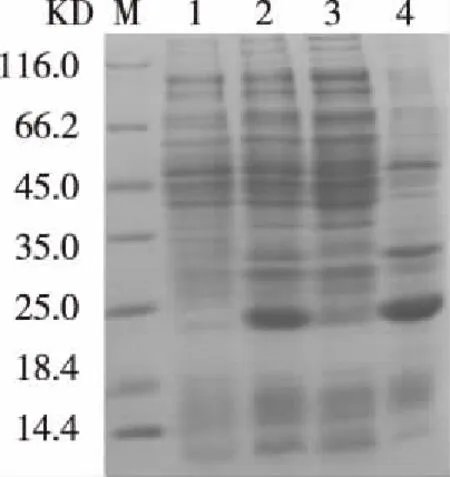
注:M:蛋白质分子质量标准, 1: 未诱导;2: 诱导后;3: 诱导破碎后上清;4: 诱导破碎后沉淀图3 蛋白表达鉴定SDS-PAGE分析
2.4原核蛋白Ni柱纯化及结果分析 包涵体经过变复性的方式,重溶目标蛋白,通过Ni柱亲和纯化获得目标蛋白,进行12% SDS-PAGE分析,结果见图4。
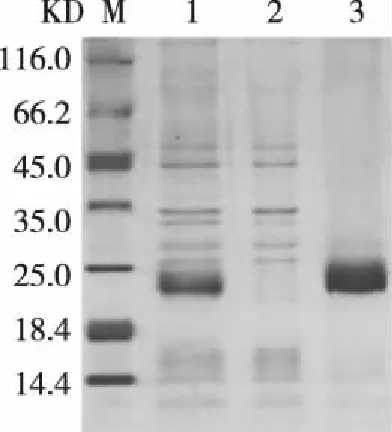
注:M:蛋白质分子质量标准;1: 破碎后处理样品;2: 流出;3: 洗脱图4 蛋白纯化SDS-PAGE分析
2.5Western Blot结果分析 取纯化样品5 μl经聚丙烯酰胺凝胶电泳、转膜,再经一抗和二抗反应,最后ECL显影,曝光。在14~25 KD之间有明显的曝光条带,目的蛋白为24.15 KD。Western Blot检测结果结果见图5。
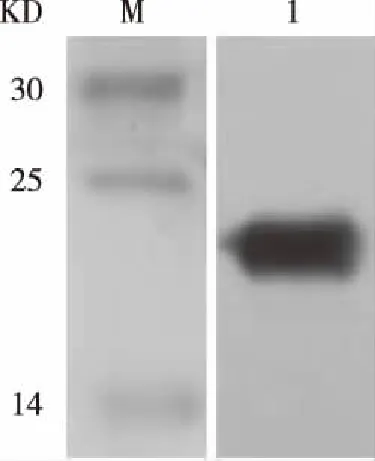
注:M:蛋白质分子质量标准 1: 纯化后样品图5 蛋白Western Blot鉴定分析
3 讨 论
IL-6是细胞因子之一,具有多种生物活性,由多种组织细胞产生,可以调节免疫应答、急性期反应以及造血功能等,在众多疾病中发挥着重要作用[5]。炎症反应发生后,IL-6率先生成,检测血清中IL-6浓度可用来辅助急性感染的早期诊断。IL-6半衰期仅1h,在感染控制后其血清浓度下降更快、幅度更大,能更快地反映抗生素治疗的效果。有研究报告IL-6还是急危重症患者感染严重程度及病情预后评估的良好指标[6-7]。研究表明,尽管单独的IL-6血清学检验有重要临床价值,但其他非感染因素也可致IL-6升高[8],其与PCT、CRP及SAA等感染指标联合检测对临床评估患者并发细菌感染时具有更佳的评估效能,可弥补各个指标单独测定的不足,更有助于医生早期发现感染[9-10],在鉴别诊断、疗效监测、预后评估上更有价值[11-13]。目前,抗菌药物临床应用管理日趋严格和规范化,由于细菌培养耗时较长及用药后也不适合做细菌培养,故治疗中判断抗生素治疗的效果主要靠感染指标的血清学检验,对于败血症和脓毒血症等重症患者来讲,快速检测感染性血清学指标就显得尤为重要。目前国内PCT、CRP和SAA单个项目的快速测定应用已较为普遍,IL-6的快速测定应用还不多见。我们试图研制一种IL-6、PCT、CRP和SAA快速联合检测卡,生产IL-6纯化蛋白用于抗体的制备是首要的任务。
本研究采用大肠杆菌表达系统获得IL-6的包涵体蛋白。大肠杆菌表达系统是基因工程中较为常用的一种,其优点是遗传背景比较清楚,表达水平较稳定,操作相对容易,实验成本低,蛋白表达量高及容易纯化等。本实验采用基于 PAS(PCR-based Accurate Synthesis)的方法,设计全长拼接引物,通过PCR得到了IL-6合成基因,并将其插入原核表达质粒pCZN1,构建了重组表达载体pCZN1 -IL6。克隆菌株经测序和载体的双酶切证明构建的表达载体正确。pCZN1 -IL6重组质粒转化至大肠杆菌Arctic Express,参照文献[14-15],利用终浓度0.5 mmol/L IPTG诱导蛋白表达,成功地在大肠杆菌Arctic Express中表达出IL-6蛋白。在诱导表达时,随着诱导时间的延长,蛋白表达量逐渐上升,至第4 h时表达量最高。该重组蛋白以可溶性和包涵体两种形式存在,主要以包涵体形式存在,通过Ni柱亲和纯化获得分子量24.15KD的目标蛋白。
本研究成功合成IL-6融合蛋白,为下一步抗体制备等后续工作奠定了必要的实验基础。
