表达单克隆抗体的CHO细胞培养工艺放大模型的研究
2020-07-01吴琰瑜金颖张光明吕红
吴琰瑜 金颖 张光明 吕红

摘 要:本文以表达单克隆抗体的CHO细胞为研究对象,在15L反应器和200L反应器中进行逐渐放大,研究放大策略及规模放大模型的建立,为后续商业化生产的进一步放大提供稳定可靠的放大策略及操作模型,为抗体药物生产提供支持。
关键词:细胞培养;放大;策略;模型
0 引言
生物反应器的规模放大是细胞培养工艺过程开发的基本组成部分。在研究哺乳动物细胞培养工艺放大的过程中,有很多需要重点考察的因素,例如:混合时间,氧气转移和二氧化碳去除等。目前在生物制药工业生产中,主要通过研究这些关键因素,进而建立大规模、高密度的哺乳动物细胞培养工艺。中国仓鼠卵巢(CHO)细胞是目前生物制药细胞培养中最常用的宿主细胞,常被用于生产各种重组蛋白。
目前细胞培养过程的工艺开发,通常先在小规模的生物反应器中进行,锁定工艺后,将其逐级放大,直至用于商业化生产的更大的生物反应器。目前国内行业的反应器规模一般可分为中试规模(200L、500L)和生产规模(1000L、5000L),而国外的大规模生产的反应器可达到15000L。
培养工艺在反应器的规模放大一直以来都是工业界具有挑战性的工作。根据文献报道,大型反应器相较于小型反应器,在混合和传质效果上的降低会引起二氧化碳逃逸效果变差、混合时间变长等问题,进而导致在小规模反应器确立的培养工艺放大至生产的大规模反应器时会出现细胞生长不如预期,表现为细胞密度降低、培养周期缩短、产量大幅下降或者产物质量难以控制等一系列问题。
近年来,随着质量源于设计(Quality by Design,QbD)
的理念在生物制药领域的推广和应用,越来越多的企业开始在工艺开发阶段就开始应用QbD的理念。因此建立合适的适用于细胞培养工艺规模放大的策略和模型,对进行稳定的大规模生产,有着十分重要的意义。
1 培养工艺的规模放大策略及可能存在的问题
1.1 放大策略
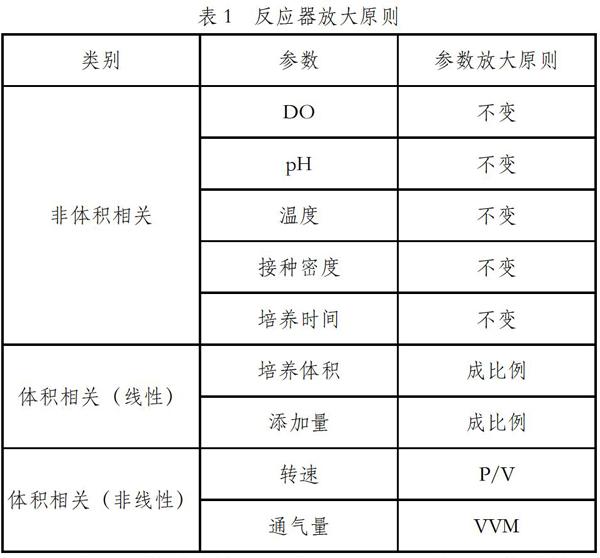
细胞培养工艺过程中的参数可以分为两类:与体积相关的参数和与体积无关的参数。不随反应器规模大小变化而变化的参数,例如:pH、DO、温度、补料时间等,这些参数在放大过程中前后两级保持一致即可。随着反应器规模大小变化而变化的参数,例如:通气速率、搅拌转速、补料体积等,在放大过程中会根据反应器通气孔径的大小和方式,以及搅拌桨的大小和形式而发生变化。一般来说,随着反应器体积的变大,通气速率一般呈线性上升的趋势。通气流速的放大一般采用单位体积单位时间的通气量(vvm)恒定的方法。其中,O2和CO2流速的放大方法在实际的操作过程中还要根据反应器中DO和pH控制器的类型以及工艺要求的控制策略做适当的调整。在参数放大过程中,反应器搅拌转速的放大需要考虑的因素比较多。大型反应器的搅拌速度需要考虑既能够为反应器提供足够的混合能力,还要避免造成由于高转速条件下剪切力所引起的不必要的细胞损伤。转速对体积氧传递系数(KLa)的影响,也是在放大过程中需要考虑的一个重要因素。另外,補料体积等参数属于与体积相关的参数,需要根据培养体积放大倍数做一定的调整。
1.2 可能存在的问题
在反应器细胞培养工艺规模放大研究过程中,目前主要集中在流体剪切力、氧传递、溶解二氧化碳的移除以及反应器混合能力四个方面,这些问题已经成为哺乳动物细胞在放大过程中公认的技术难题,是规模放大过中导致放大效果低于预期或导致放大失败的主要原因。也是目前哺乳动物细胞培养中最具挑战的难点。
2 实验设计
2.1 反应器放大策略
反应器规模放大模型的建立采用以下策略:①非体积相关的参数保持不变,如pH、DO、温度、接种密度、培养时间、补料时间等;②体积相关的参数(线性),如培养体积、补料添加量等;③体积相关的参数(非线性),如转速、通气量等。
2.2 实验材料与设备
2.3 实验方法
流加培养方法不变,按照补料策略S11每次流加初始培养体积F1和F2;每天根据葡萄糖浓度检测结果,在葡萄糖低于4g/L时,补加葡萄糖浓缩液至浓度6g/L。培养收获时间设定为14天。
15L反应器2批,200L反应器培养3批,对15L和200L
反应器的培养结果进行对比分析。
3 实验结果与讨论
3.1 反应器规模放大与缩小
3.1.1 细胞生长和细胞活率
按照设定好的工艺在2批15L和3批200L反应器中进行验证,如图1所示,随着培养时间的增加,活细胞密度不断增加。15L反应器与200L反应器在细胞生长保持一致,从第10天开始细胞密度维持在一个较高的水平,出现轻微下降的趋势。
在细胞活率方面,如图2所示。随着培养时间的增加,细胞活率在逐渐降低,但降低幅度较低。培养结束第14天时15L反应器中细胞活率是90.5%,在200L反应器中是93.5%,均处于一个活率较高的水平,并且15L反应器与200L反应器中的细胞活率的趋势保持一致。
3.1.2 细胞代谢
由图3可知,2批15L和3批200L反应器的乳酸代谢情况基本一致,从第0天到第4天为乳酸生成阶段,此阶段乳酸快速生成,第四天达到最高,之后进入乳酸消耗阶段,到第9天左右乳酸完全耗光。
由图4可知,整个培养过程中氨都是持续累计的过程,在培养前期反应器中铵离子浓度较低,从第8天开始反应器中铵离子浓度逐渐增大,15L反应器与200L反应器中氨的代谢趋势一致。
3.2 蛋白表达
图5所示为培养工艺在2批15L和3批200L反应器中的蛋白表达情况对比。由图可知,15L和200L反应器的蛋白表达情况基本一致,培养结束时产量均在3g/L左右。
3.3 蛋白質量
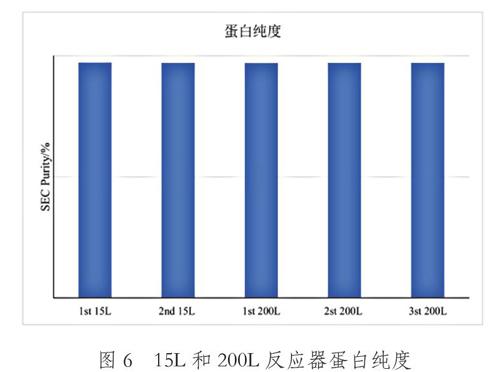
图6所示为2批15L和3批200L反应器上的抗体SEC纯度对比,由图可知,不同规模反应器的抗体SEC纯度无显著差异,最终蛋白纯度均在98%左右。
综上所述,从2批15L和3批200L反应器中进行的细胞工艺,在细胞密度、细胞活率、乳酸代谢、氨代谢、蛋白表达和蛋白质量六个方面进行对比,各参数在两级反应器中趋势基本一致,可说明该培养工艺按照既定放大策略能够稳定的放大至较大规模的反应器中。
4 小结
本文首先对15L反应器放大到200L反应器中工艺的各参数进行了分析讨论,建立了反应器规模放大的策略,之后在15L和200L反应器上进行了放大生产,实验结果表明15L反应器与200L反应器是表现一致。实验过程中,首先将放大参数按照非体积相关的参数和体积相关的参数进行分类。非体积相关的参数在放大的过程中保持不变。体积相关的参数按照线性相关和非线性相关的参数进行分类,然后选择相关参数合适的放大准则。最后,在2批15L和3批200L反应器进行了放大的实施和对比,结果表明细胞在生长、代谢、蛋白表达和蛋白质量方面等方面表现基本一致。
参考文献:
[1] Kirdar,A.O.,et al.,Application of Multivariate Analysis toward Biotech Processes:Case Study of a Cell-Culture Unit Operation. Biotechnology progress,2007,23(1):61-67.
[2] Mostafa,S.S. and X.S. Gu,Strategies for Improved dCO2 Removal in Large-Scale Fed-Batch Cultures. Biotechnology progress,2003,19(1):45-51.
[3] Zhu,M.M.,et al.,Effects of Elevated pCO2 and Osmolality on Growth of CHO Cells and Production of Antibody-Fusion Protein B1:A Case Study. Biotechnology progress,2005,21(1):70-77.
[4] Serrato,J.A.,et al.,Heterogeneous conditions in dissolved oxygen affect N–glycosylation but not productivity of a monoclonal antibody in hybridoma cultures. Biotechnology and bioengineering,2004,88(2):176-188.
[5] Yang,J.D.,et al.,Fed-batch bioreactor process scale-up from 3-L to 2,500-L scale for monoclonal antibody production from cell culture. Biotechnol Bioeng,2007,98(1):141-154.
[6] Xing,Z.,et al.,Scale-up analysis for a CHO cell culture process in large-scale bioreactors. Biotechnol Bioeng,2009,103(4):733-746.
[7] Rouiller,Y.,et al.,Application of Quality by Design to the characterization of the cell culture process of an Fc-Fusion protein. European Journal of Pharmaceutics and Biopharmaceutics,2012,81(2):426-437.
[8] Food and D. Administration,Guidance for industry PAT- a framework for innovative pharmaceutical development , manufacturing,and quality assurance. DHHS,Rockville,MD,2004.
[9] Humphrey,A.,Shake flask to fermentor:what have we learned? Biotechnology Progress,1998,14(1):3-7.
[10]Schmidt,F.,Optimization and scale up of industrial fermentation processes. Applied microbiology and biotechnology,2005,68(4):425-435.
[11]Lilly , M. , Problems in process scale-up. Special Publications of the Society for General Microbiology[SPEC. PUBL. SOC. GEN. MICROBIOL.].1983.
